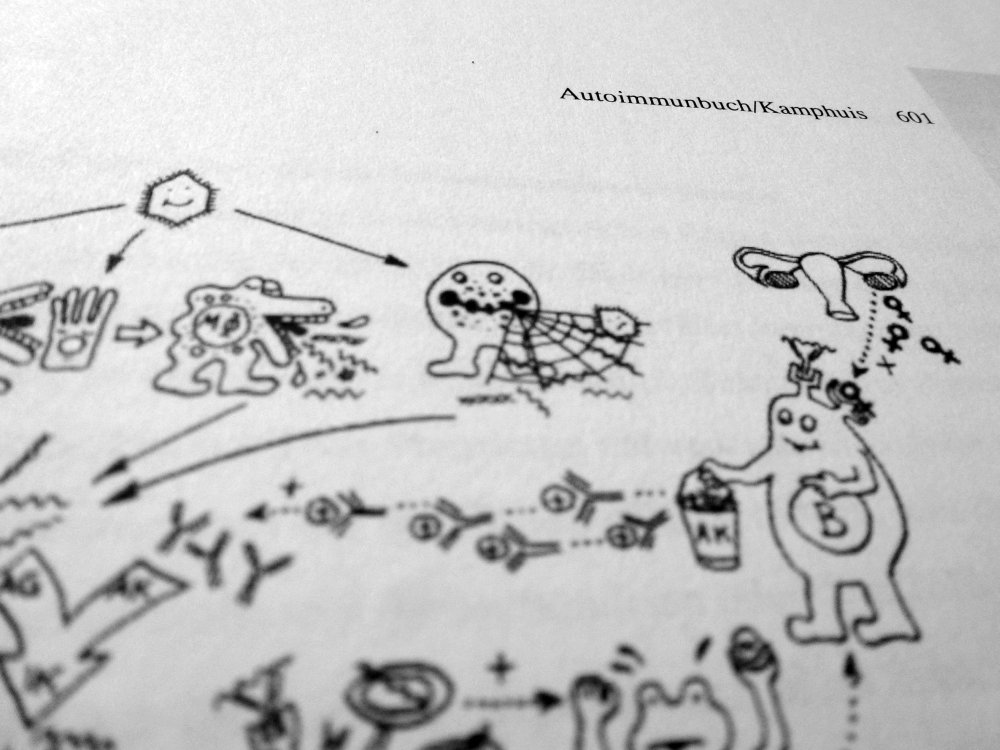
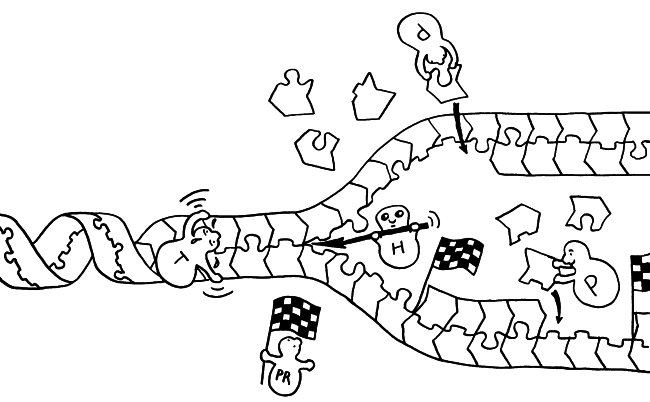
Das Autoimmunbuch hat eine radikale Wochenend-Diät hinter sich: Angesichts des hohen Verkaufspreises, den Epubli für das Buch vorsah, und der deutlichen Hinweise einer Verlegerin, dass das viel günstiger geht (1000 Dank, S.!), habe ich das Format von 17 x 24 cm auf 15,5 x 22 cm reduziert, ohne alles neu zu umbrechen. Eine solche Schrumpfkur auf 91 Prozent ist typografisch nicht das Gelbe vom Ei, aber ich denke, das Schriftbild ist noch klar genug. Um das zu prüfen, habe ich nach dem Test-Exemplar bei Epubli nun auch eines bei BOD geordert. Bitte drückt mir die Daumen, dass die Qualität stimmt.
Das Autoimmunbuch hat eine radikale Wochenend-Diät hinter sich: Angesichts des hohen Verkaufspreises, den Epubli für das Buch vorsah, und der deutlichen Hinweise einer Verlegerin, dass das viel günstiger geht (1000 Dank, S.!), habe ich das Format von 17 x 24 cm auf 15,5 x 22 cm reduziert, ohne alles neu zu umbrechen. Eine solche Schrumpfkur auf 91 Prozent ist typografisch nicht das Gelbe vom Ei, aber ich denke, das Schriftbild ist noch klar genug. Um das zu prüfen, habe ich nach dem Test-Exemplar bei Epubli nun auch eines bei BOD geordert. Bitte drückt mir die Daumen, dass die Qualität stimmt.
Denn dann kann ich das Buch für 15 Euro anbieten, also für nicht einmal die Hälfte dessen, was ich bei Epubli nehmen müsste. Ein paar Freiexemplare wird es trotzdem geben (1000 Dank, A.!).
In den nächsten Tagen widme ich mich der Leseprobe (1000 Dank, R.!), den Merchandising-Produkten (TTT: Taschen, Tassen, T-Shirts) und der Book Release Party im Mai (1000 Dank, D.!).