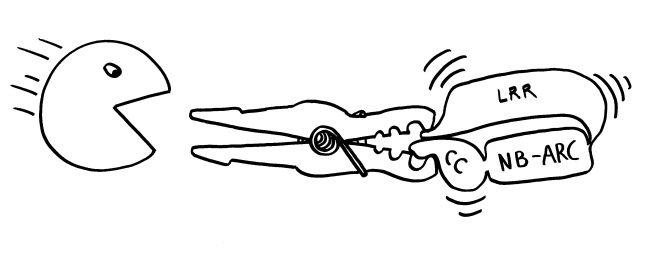
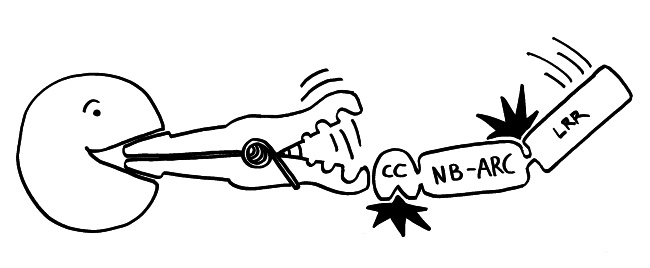
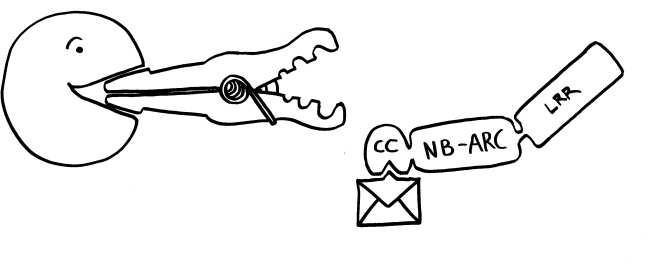
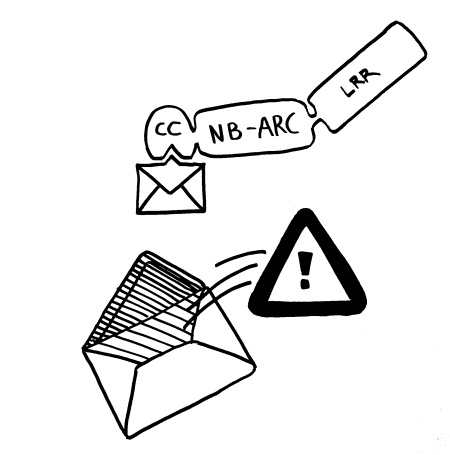
Neue Skizzen, Erläuterungen folgen im Buch.
Archiv für den Monat: November 2012
Hormonwerte sind nicht alles: Hypothyreose-unabhängige Symptome bei Hashimoto-Thyreoiditis
In der Patientenszene häufen sich seit Jahrzehnten Berichte von Hashimoto-Patienten, denen es trotz Hormonwerten im Normalbereich schlecht geht. Viele kämpfen gegen die TSH-Wert-Fixierung ihrer Ärzte an, die so etwas gerne als „psychisches Problem“ abtun. Neuerdings zeichnet sich in der Fachwelt ein Umdenken ab: Mehrere Forschergruppen bestätigen die Existenz von ernsten Symptomen und krankhaften Gewebsveränderungen bei Hashimoto-Thyreoiditis, die nicht von der Schilddrüsenhormonversorgung abhängen, sondern vermutlich durch die Autoimmunreaktionen selbst bedingt sind. Hier fasse ich einige Arbeiten zusammen – wie immer noch nicht allgemein verständlich aufbereitet, gesundheitsbedingt ziemlich flüchtig und wahrscheinlich mit noch mehr Tippfehlern als sonst: Ich sehe momentan sehr schlecht, möchte aber meinen Rückstand aufholen.
Johannes Ott et al.: The incidence of lymphocytic thyroid infiltration and Hashimoto’s thyroiditis increased in patients operated for benign goiter over a 31-year period. Virchows Arch 2011, 459, 277-281, doi: 10.1007/s00428-011-1130-x
Die HT-Inzidenz scheint in den letzten Jahrzehnten gestiegen zu sein. Autoren haben Lymphpzyten-Infiltration der Schilddrüse (lymphocytic thyroid infiltration = LTI) in Gewebsproben von 1050 Patienten untersucht, die wegen eines gutartigen Kropfs an der Schilddrüse operiert worden waren. Ausmaß LTI (Grad 0-4) korreliert positiv mit HT. Vergleich der Jahre 1979-1989 und 1994-2009: Nach der Erhöhung der Salziodierung in Österreich höhere HT-Inzidenz als vorher – was natürlich kein Beleg für einen kausalen Zusammenhang ist. [Weiteres Problem: die winzige Zahl histologisch eindeutiger Hashimoto-Fälle – insgesamt 8 von 1050, also 0,8%!] In der Lit. genannte mögliche Ursachen für steigende Inzidenz: intauterine Erreger-Exposition (Enterovirus usw.), industrielle Endokrindisruptoren oder Schwermetalle, radioaktive Strahlung (Tschernobyl), Iodierung. Mögliche pathophysiologische Mechanismen: erhöhte Immugenität von stark iodiertem Thyreoglobulin, toxische Wirkung von Iod auf Schilddrüsenzellen oder direkte Stimulation der Immunzellen durch Iod. [Arbeit für meine Zwecke unergiebig.]
Johannes Ott et al.: Hashimoto’s Thyroiditis Affects Symptom Load and Quality of Life Unrelated to Hypothyroidism: A Prospective Case–Control Study in Women Undergoing Thyroidectomy for Benign Goiter. Thyroid 2011, 21(2), 161-167; doi: 10.1089/thy.2010.0191.
Prospektive Kohortenstudie an 426 euthyreoiden Frauen, die wegen gutartigen Kropfs operiert wurden. Gewebsuntersuchung: 28 der Frauen (6,6%) hatten HT. Aufteilung in zwei Gruppen: Anti-TPO-Antikörper-Werte > bzw. ≤ 121,0 iU/ml. In beiden Gruppen nahmen etwa 30% Schilddrüsenhormone. Mittlere Zahl der von den Patientinnen berichteten Symptome war in der Gruppe mit hohen Anti-TPO-Antikörper-Werten signifikant größer. TSH-Werte: kein signifikanter Unterschied (1,7 bzw. 1,4 µU/ml). Chronische Erschöpfung, trockenes Haar, chronische Reizbarkeit, chronische Nervosität, chronische Schwäche, Schlafstörungen, Vorgeschichte Brustkrebs und frühe Fehlgeburten sowie niedrigere Lebensqualität (allgemeiner Gesundheitszustand, Einschränkungen durch körperliche Beeinträchtigungen, Vitalität, Teilnahme am Sozialleben, geistige Gesundheit; ermittelt mit SF-36-Fragebogen): alle signifikant mit hohen Anti-TPO-Antikörper-Werten assoziiert. Schluss: Diese HT-typischen Symptome können auch auftreten, wenn keine Hypothyreose vorliegt. Weiterlesen
Bell’s palsy: vermischte schnelle Notizen zur Literatur, Teil 2 (Saisonalität und Klima)
Campbell und Brundage (2002): Effects of Climate, Latitude, and Season on the Incidence of Bell’s Palsy in the US Armed Forces, October 1997 to September 1999
Die Autoren haben Daten über Gesundheitszustand und Demografie von US-Militärangehörigen aus zwei Jahren auf Korrelationen zwischen Lähmungsrisiko und Klima, Jahreszeit oder Breitengrad untersucht. 1997-1999 1181 Fälle von Bell’s palsy beim US-Militär, allgemeine Inzidenz 42,77 pro 100.000 Personen pro Jahr – höher bei Älteren, Frauen, Schwarzen, Latinos, Verheirateten und Soldaten (enlisted service members). Trockenes Klima erhöhte die Rate gegenüber feuchtem Klima um den Faktor 1,34; in den kalten Monaten des Jahres (Nov. bis März) lag das Risiko um den Faktor 1,31 über dem der warmen Jahreszeit (Mai bis Sept.). Der Breitengrad war kein signifikanter unabhängiger Prädiktor. Die Ergebnisse passen zur Hypothese einer viralen Beteiligung (z. B. Herpes-simplex-Reaktivierung) an Bell’s palsy. Niedrige Luftfeuchtigkeit (draußen), UV-Strahlung, Koinfektionen der oberen Atemwege und trockene Raumluft könnten Trigger sein.
Diego et al. (2002): Effect of atmospheric factors on the incidence of Bell’s palsy
Retrospektive Studie an 662 spanischen Patienten mit Bell’s palsy (1992-1996), bei der anhand der Daten des spanischen Wetteramts Temperatur, Luftdruck und Luftverschmutzung (SO2, CO, O3, NO2, NO, CH4 und gesamter organischer Kohlenstoff) an ihrem Wohnort ermittelt wurden. Einziger signifikanter Zusammenhang: Niedrigere Temperaturen gingen mit höherer Inzidenz einher.
Narcı et al. (2012): Seasonal Effects on Bell’s Palsy: Four-Year Study and Review of the Literature
Studie an 634 türkischen Patienten mit Fazialislähmung, von denen 533 (84%) Bell’s palsy hatten. Mittleres Alter 55 ± 24,7 Jahre, 51,4% Männer. Inzidenz (in dieser Studie 12,7, weltweiter Durchschnitt 40,2 pro 100.000 Personen pro Jahr) ist in Japan, Israel und Mexiko am größten und in Schweden am kleinsten. Monate mit den meisten Fällen: Mai (11,06%), März (10,13%), April (9,56%); Monate mit den wenigsten Fällen: Juli (6,38%), Dezember (6,38%) und Januar (6,56%); Unterschied signifikant. Nach Jahreszeiten: Winter (21,57%), Frühjahr (31,70%), Sommer (22,70%) und Herbst (24,95%); Unterschied Winter/Frühlahr signifikant. Im Frühjahr die meisten Infektionen der oberen Atemwege; evtl. HSV-1-Reaktivierungen als Auslöser. Andere Studien zum Thema: Park et al. (Land?), Adour et al. (Land?) und Peitersen (Dänemark) fanden keine signifikante Korrelation mit Jahreszeiten, Spengos et al. (Griechenland) fanden Peaks im Herbst und Winter und einen Rückgang im Sommer.
Immunneuropathien am Beispiel des Guillain-Barré-Syndroms
Ein Buchkapitel – für mich überwiegend nur am Rande interessant (wegen der Ansicht einiger Autoren, Bell’s palsy sei eine mononeuritische GBS-Variante), aber gute, einfache Darstellung des Grundmodells (Abb.):
M. Mäurer et al. (2012): Immunneuropathien. In: M. Stangel und M. Mäurer, Autoimmunerkrankungen in der Neurologie, Springer
Sowohl dem Guillain-Barré-Syndrom (GBS) als typischer akuter inflammatorischer Neuropathie als auch der chronisch inflammatorischen demyelinisierenden Polyneuropathie (CIDP) liegen Autoimmunreaktionen gegen Myelin zugrunde. Lymphozyten und Makrophagen dringen in die peripheren Nerven ein (Infiltration). Primär meist Demyelinisierung, sekundär Schädigung der Axone. Tiermodell: experimentelle autoimmune Neuritis (EAN), die durch Immunisierung von genetisch anfälligen Versuchstieren mit peripherem Myelin, Myelinprotein P2 oder einer Peptidsequenz daraus oder mit den Myelinproteinen P0, MBP, PMP oder MAG ausgelöst wird. Molekulare Mimikry bei GBS, analog zu MS: Antigenpräsentierende Zellen (APCs) präsentieren auf ihren MHC-II-Molekülen Epitope, die Myelinstrukturen sehr ähneln -> Aktivierung und klonale Expansion naiver T-Zellen, die auch Myelin attackieren – z. B. nach Campylobacter-jejeuni-Infektionen. Bei etwa der Hälfte der GBS-Patienten Antikörper gegen Ganglioside (in Zellmembran verankerte Sphingolipide) gefunden, die als „lipid drafts“ für die Nervenimpulsübertragung wichtig sind. Je nach GBS-Variante andere Antigangliosid-Antikörper. Aus Patienten isolierter C.-jejeuni-Keime exprimieren Lipooligosaccharide (LOS), die den Kohlenwasserstoffanteilen der Ganglioside ähneln. Antikörper kreuzreaktiv, erkennen also sowohl die LOS als auch die Gangliosid-Komplexe. Bei GBS aber auch Antikörper gegen andere Glykolipide und Myelinproteine nachgewiesen; Zielstruktur also noch unklar. Weiterlesen
Bell’s palsy: vermischte schnelle Notizen zur Literatur, Teil 1
Barut et al. (2009): Bell’s palsy and choreiform movements during peginterferon α and ribavirin therapy
Größtenteils irrelevant für mich (Fallbeschreibung einer an Chorea Huntington leidenden Frau mit Hepatitits C und Fazialislähmung); interessant nur, was sie zur Hypothyreose der Frau schreiben: „Hypothyroidism may be another cause for the primary right-sided palsy“ (leider ohne Literaturverweis) – und: Einige Nebenwirkungen von IFN-α (das die Frau als Hepatitis-C-Therapie bekam) kommen vermutlich durch Immundysregulation zustande, Autoimmun-Thyreoiditis zum Beispiel. Frühere Studien an BP-Patienten haben gezeigt, dass die Lähmung durch Lymphozyten-Attacken auf den Fazialisnerv bedingt sein dürfte, wobei die Membran der Schwann-Zellen oder der Nerv selbst das Autoantigen liefert. Da Peginterferon und Ribavirin die zelluläre Immunabwehr unterstützen, können sie auch die Nervenschädigung verstärken. Weiterlesen
Veränderungen peripherer mononukleärer Blutzellen: Indizien für Autoimmunstörung bei idiopathischer peripherer Fazialislähmung
Stefan S. Kassner et al.: Changes in Peripheral Blood Mononuclear Cells – Novel Evidence for an Immunomodulatory Aspect in Bell’s Palsy? Journal of Neurology Research, Vol. 2, No. 3, Jun 2012; doi:10.4021/jnr108w
Abstract: Früheren Studien zufolge ist bei Patienten mit Bell’s palsy (BP) die Zahl der T- und B-Lymphozyten signifikant verringert. Als mögliche Ursachen der Erkrankung gelten Vireninfektionen und Autoimmunprozesse. In dieser Studie wurden die peripheren mononukleären Blutzellen (PBMCs) von 15 BP-Patienten anhand ihrer Oberflächenmarker (CD) genauer charakterisiert: Bei den Monozyten (= Makrophagenvorläuferzellen, CD14+), Makrophagen (CD68+), T-Lymphozyten (CD3+) und B-Lymphozyten (CD19+) wurde der Anteil der Zellen sowie die Expression entzündungsfördernder (CD40+, TNF-α und COX-2), apoptosefördernder (Caspase-3, PARP), adhäsionsfördernder (CD38+) und mit oxidativem Stress verbundener (MnSOD) Proteine gemessen. Die Ergebnisse deuten auf eine Beteiligung des Immunsystems an Bell’s palsy hin.
Einleitung: Der Mangel an antikörperproduzierenden CD19+-B-Zellen bei BP-Patienten wird in der Literatur als mögliche Unrsache für den Krankheitsausbruch oder -fortgang diskutiert, weil dadurch womöglich neurotrope Viren (ihre DNA und/oder ihre Hüllen) nicht mehr effizient aus den infizierten Nerven entfernt werden können. HSV-1-DNA (Herpes simplex) wurde in der Nervenflüssigkeit und im Speichel von BP-Patienten nachgewiesen. Im Tiermodell ließ sich BP durch HSV-1-Reaktivierung im Verbund mit Immunsuppression auslösen. Weiterlesen
Idiopathische periphere Fazialislähmung und Autoimmunität

Dokumentation und zugleich Kommentar zur Lage: Versuch, beide Mundwinkel anzuheben (vulgo: zu lächeln)
A. Greco et al.: Bell’s palsy and autoimmunity. Autoimmunity Reviews (2012), article in press; doi:10.1016/j.autrev.2012.05.008
Abstract: 60-75% aller Fälle einseitiger Fazialislähmungen sind idiopathische periphere Fazialislähmungen = Bell’s palsy. Inzidenz: 15-30/100.000 Personen pro Jahr. Ätiologie unbekannt, mögliche Pathomechanismen: Vireninfektionen und/oder Autoimmunerkrankung. Evtl. durch Reaktivierung latenter Herpesvireninfektion (Herpes simplex, Herpes zoster) im Schädelnervenganglion ausgelöst und/oder durch zellulär vermittelte Autoimmunreaktion gegen das Myelin-Basische Protein (MBP) bedingt. Die Erkrankung kann als mononeuritische (d. h. nur einen Nervenstrang befallende) Variante des Guillain-Barré-Syndroms (GBS) aufgefasst werden, einer neurologischen Störung, bei der sich die zellvermittelte Immunabwehr gegen Myelin-Autoantigene des peripheren Nervensystems richtet. Sowohl bei GBS als auch bei Bell’s palsy könnte eine Vorinfektion oder eine Reaktivierung eines latenten Virus die Autoimmunreaktion auslösen. Die Autoren empfehlen bei Patienten, die innerhalb der ersten drei Tage ihrer Lähmung Hilfe suchen, eine Kombination aus Corticosteroiden (zur Immunsuppression) und Acyclovir oder Valacyclovir (antivirale Therapie). [Letzteres ist durch die aktuellen evidenzbasierte Leitlinien und Metaanalysen nicht gedeckt – AK.] Weiterlesen
Das Bell-Phänomen
Heute, am vierten Tag der Fazialislähmung und der Prednison-Einnahme, ist das nach Charles Bell benannte Bell-Phänomen zu bewundern: Ich bekomme das rechte Auge (wegen Spiegel auch im Bild rechts) inzwischen nicht mehr ganz zu, und man sieht das Weiße des Augapfels, weil dieser beim Schließen nach oben gedreht wird. Das geschieht auch bei gesunden Menschen, nur sieht man es bei ihnen wegen der normalen Beweglichkeit der Augenlider nicht.
Auf Englisch heißt die idiopathische periphere Fazialislähmung übrigens „Bell’s palsy“.
Tja, Verbesserungen kann ich noch nicht erkennen. Aber dafür ist es auch noch zu früh: Der Fazialisnerv hat an der Stelle, wo er durch das Schläfenbein nach außen tritt, aufgrund einer akuten Entzündung bzw. einer Autoimmunattacke seine Myelinscheide eingebüßt. Die muss in den nächsten Wochen ganz langsam wieder aufgebaut werden, damit der Nerv wieder Signale weiterleiten kann.
Inklusion durch Piraterie
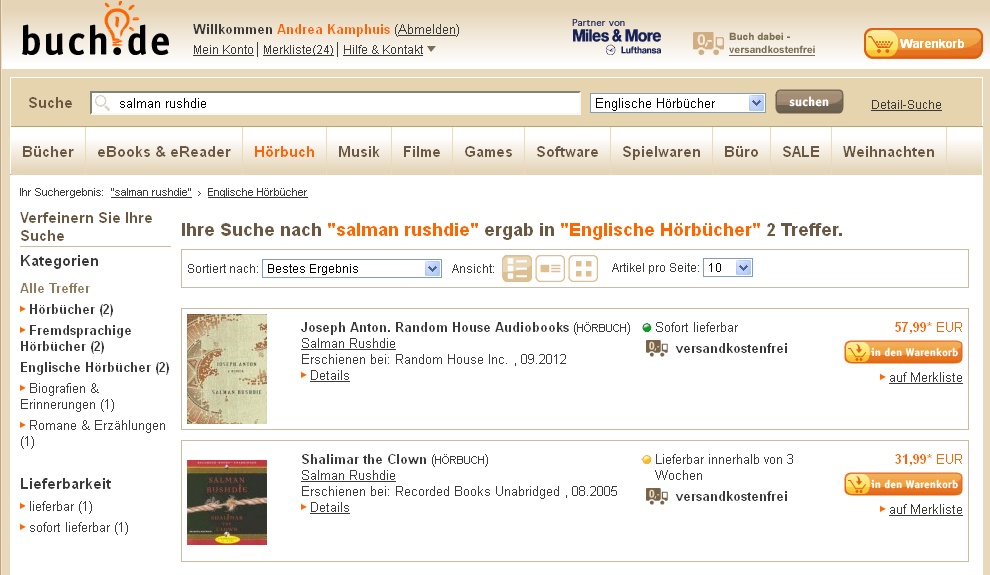
Zum zweiten Mal in diesem Jahr aus gesundheitlichen Gründen auf Hörbücher angewiesen, wollte ich gerade einige Rushdie-Romane zum Anhören kaufen. Es folgt ein Screenshot. Fuck you, buch.de! Und wenn die Buchbranche das nächste Mal über die schlimme Piraterie klagt, werde ich schallend lachen.
Gesichtslähmung
Ich dachte eigentlich, ich hätte mein diesjähriges Kontingent an „interessanten“ Erkrankungen bereits ausgeschöpft, aber nein. Seit gestern habe ich eine rechtsseitige Gesichtslähmung, genauer: eine idiopathische periphere Fazialisparese. Die vorangegangenen starken Nackenschmerzen lassen zwar nach, aber da mein rechtes Auge wegen des stark reduzierten Lidschlags leicht austrocknet, kann ich längst nicht mehr so lange am Bildschirm arbeiten oder lesen wie gewohnt. Eine solche Lähmung kann einige Wochen oder einige Monate oder (mit einer Wahrscheinlichkeit von etwa zehn Prozent) ein Leben lang anhalten.
Es wurmt mich, dass sich dadurch die Arbeit am Autoimmunbuch schon wieder erheblich verzögert. Das tut mir so leid für meine Unterstützer, die nun noch länger auf das Buch warten müssen. Ich tue alles, was in meiner Macht steht, um die Regeneration zu unterstützen. Dazu gehört momentan eine massive Medikation mit Prednison, einem Glucocorticoid, das stark immunsupprimierend wirkt und daher auch – in viel niedrigeren Dosen – bei einigen Autoimmunerkrankungen verschrieben wird. Dazu gehört aber auch, dass ich mein rechtes Auge wirklich schone, denn das linke ist ja schon seit der Netzhautablösung am Anfang dieses Jahres nicht mehr so doll. :-/ Ich kann nur an eure Geduld appellieren – und an meine eigene.