Es geht, wie so oft, um Ressourcen-Allokation. Wir können jede Kalorie nur einmal ausgeben: zum Nachdenken, für die Vermehrung, im Dienste der Abwehr – am besten dort, wo sie im Moment am dringendsten benötigt wird. Und wenn gerade alles im Lot ist, lagern wir sie ein für kommende Notlagen.
Wohin die Energie fließt, das regelt der Stoffwechsel oder Metabolismus. Er umfasst sowohl biochemische Reaktionswege, auf denen einfachen Rohstoffe unter Energieeinsatz zu komplexeren Strukturen aufgebaut werden, als auch Pfade, auf denen komplexe Biomoleküle zu einfachen Komponenten zerlegt werden, wobei Energie frei wird. Kurz: Metabolismus = Anabolismus + Katabolismus. Damit sich diese Prozesse nicht in die Quere kommen, laufen sie oftmals in getrennten innerzellulären Räumen oder zu unterschiedlichen Zeiten ab.
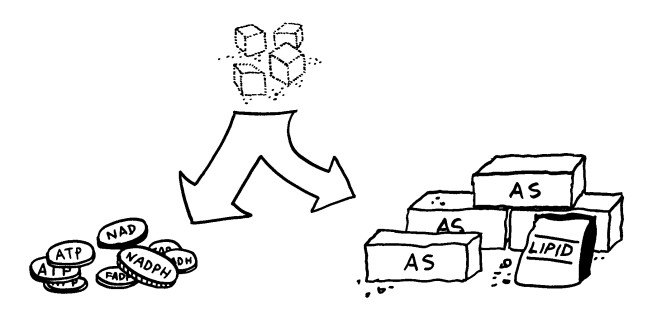
Action und Substanz: Teile des Zellstoffwechsels machen aus dem Zucker Glukose Energiewährung wie ATP. Andere Zweige des Stoffwechsels produzieren Protein- und Lipidbausteine wie Amino- oder Fettsäuren.
Energie ist eine knappe Ressource; jede Investition in einen Lebensbereich wird mit einem Mangel in einem anderen Bereich erkauft. Das gilt zum einen für ganze Organismen und ihre Organe, etwa für Guppies. Ein Forscherteam hat einen Stamm dieser Aquarienfische über einige Generationen hinweg auf besonders große und besonders kleine Gehirne hin selektiert und dann die Stärke der Immunreaktionen auf transplantierte Guppy-Schuppen gemessen: Die angeborene Abwehr wird schwächer, wenn mehr Energie in die Ausbildung und den Unterhalt eines großen Gehirns fließt. Die erworbene Abwehr bleibt dagegen gleich stark (A. Kotrschal et al., 2016, PDF).
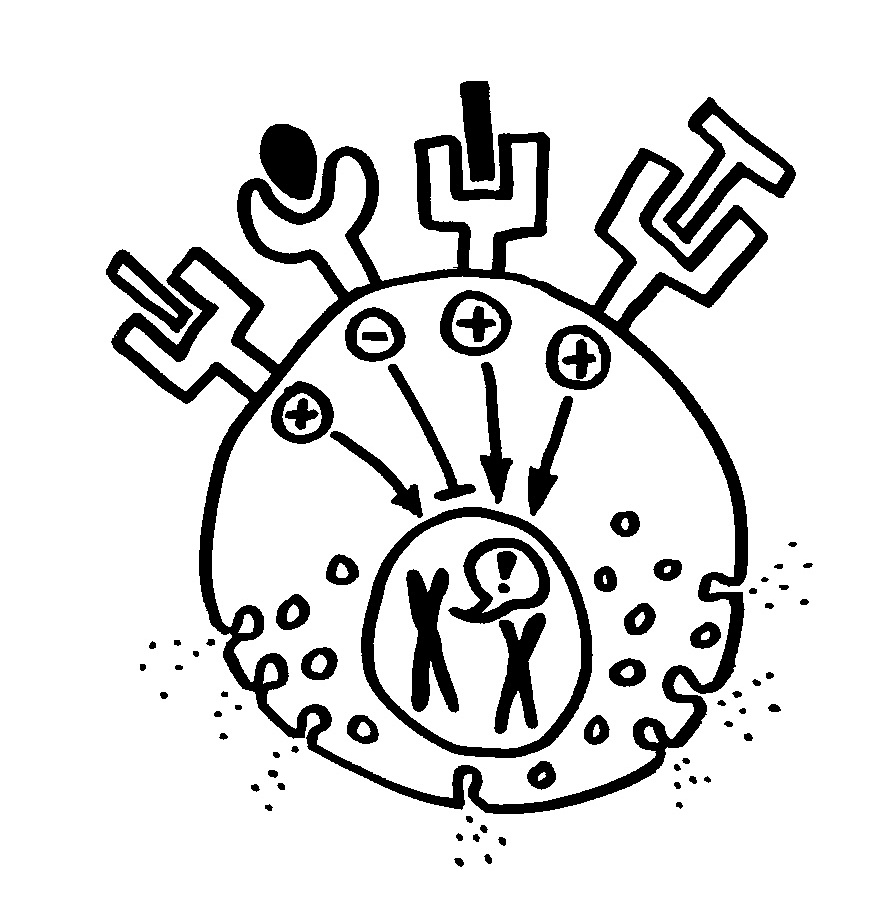
Das gilt aber auch für einzelne Zelltypen wie Tumorzellen oder die Zellen des Immunsystems, die mit Krebszellen einiges gemeinsam haben – etwa die Fähigkeit zur raschen Vermehrung, für die in kurzer Zeit viel Energie benötigt wird. Die Energiequelle ist Glukose oder Traubenzucker, der aus dem Blut in die Zellen gelangt. Naive, d. h. noch nicht mit einem passenden Antigen konfrontierte T-Zellen haben zunächst einen niedrigen Energieumsatz. Sobald sie aber ein zu ihren Rezeptoren passendes Antigen präsentiert bekommen und dadurch aktiviert werden, geht es los: Sie müssen sich massiv vermehren, u. U. weit und mühsam an ihren Einsatzort wandern und eine Menge Wirkstoffe wie Zytokine herstellen. Anschließend leben einige von ihnen als sogenannte Gedächtniszellen noch Jahre bis Jahrzehnte weiter, um bei einem erneuten Auftreten desselben Antigens, also der Rückkehr derselben Gefahr, sehr schnell wieder aktiv zu werden.
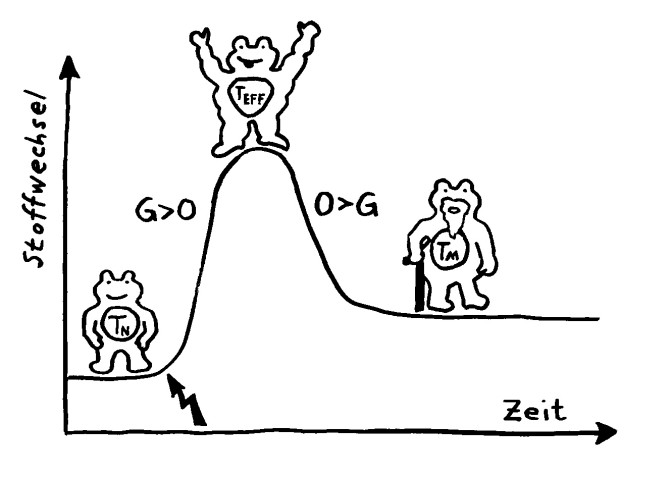
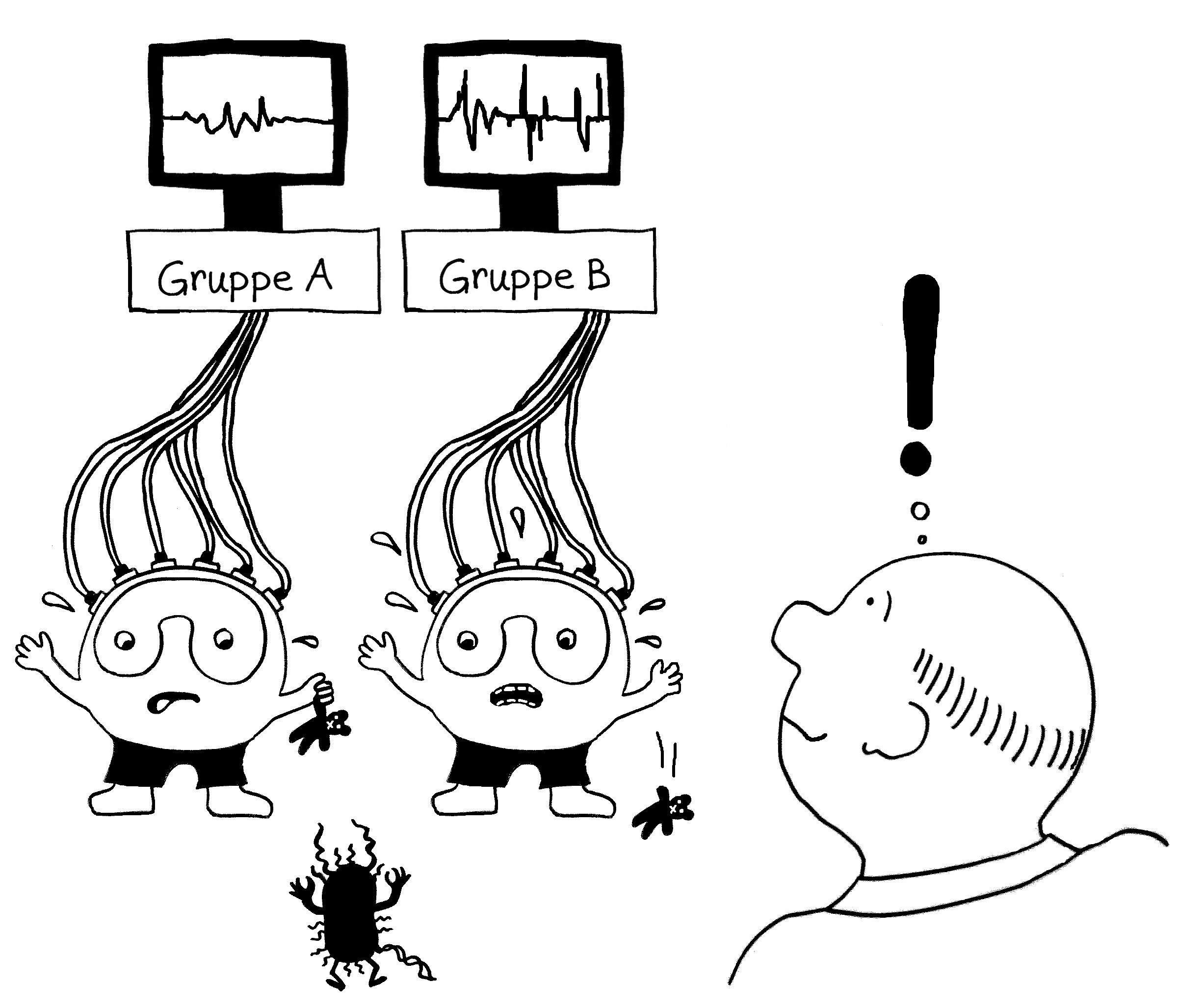
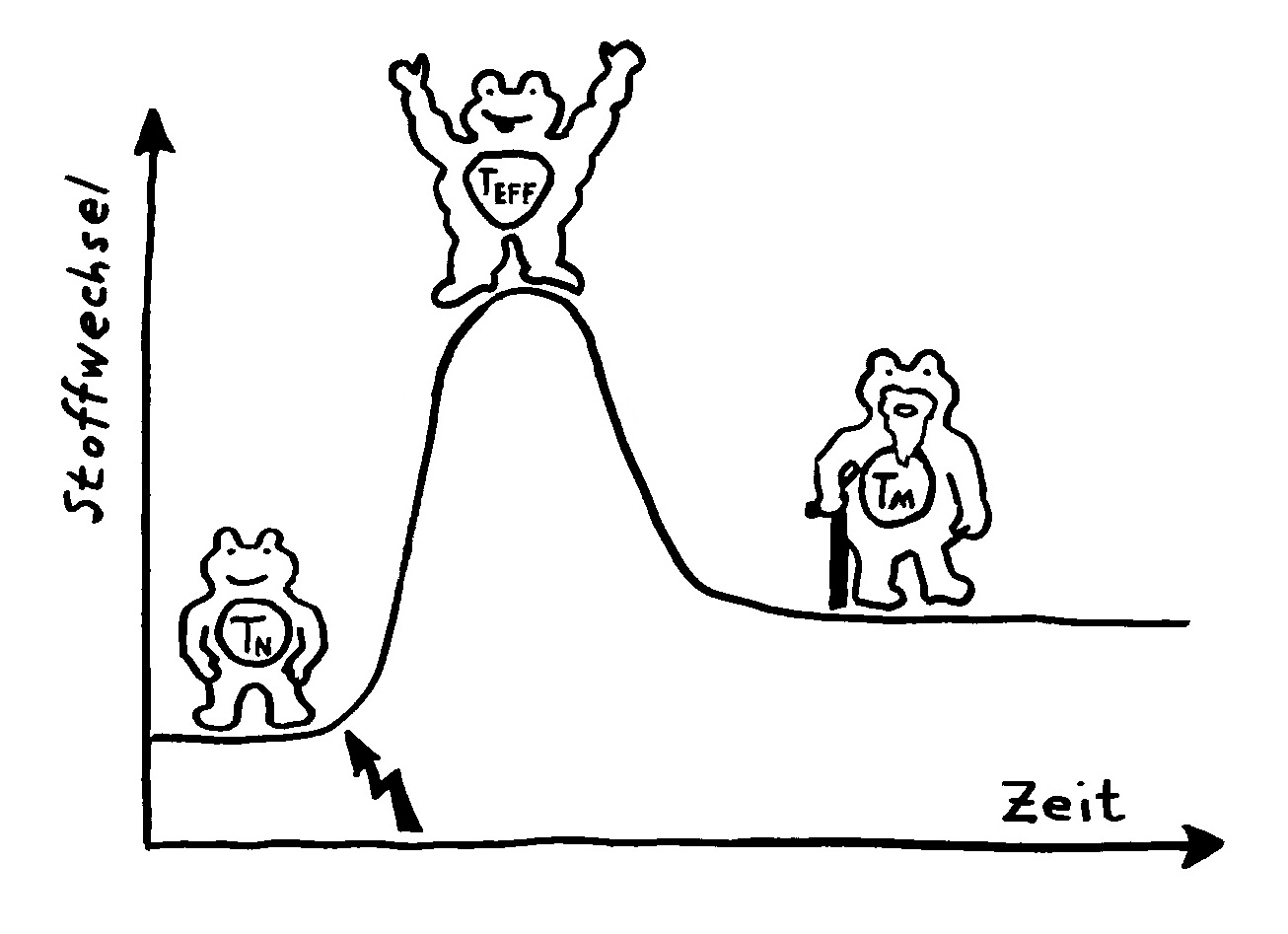
Wird eine naive T-Zelle durch ein Antigen aktiviert (Blitz), kurbelt sie die Glykolyse (G) an, um als Effektor-T-Zelle schnell schlagkräftig zu werden und sich zu vermehren. Als langlebige Gedächtniszelle (M für memory) setzt sie sie danach stärker auf die oxidative Phosphorylierung (O).
Ihr Stoffwechsel passt sich dem Bedarf in diesen drei Lebensphasen an, wobei jede T-Zell-Subpopulation (etwa CD4+, CD8+ oder Treg) ein etwas anderes Programm verfolgt.
Im Ruhezustand gewinnen die naiven T-Zellen Energie aus allen möglichen Quellen, nämlich Glukose, Fettsäuren und Aminosäuren, und zwar größtenteils in ihren Mitochondrien, den Kraftwerken unserer Zellen. Die darin ablaufenden Stoffwechselwege heißen Citratzyklus und oxidative Phosphorylierung, kurz OXPHOS. Sie sind sehr effizient, liefern also sehr viel von dem Energieträgermolekül ATP – das aber recht langsam: ideal für ruhende T-Zellen, die gemächlich durch die Blutgefäße und die Lymphknoten patrouillieren und auf die Präsentation eines Antigens warten, das zu ihren Rezeptoren passt.
Bei ihrer Aktivierung schalten die T-Zellen auf einen als Glykolyse bezeichneten Stoffwechselweg um, der stattdessen im Zellplasma abläuft und Glukose abbaut, um daraus möglichst rasch ATP und die einfachen Grundbausteine Pyruvat und Lactat zu gewinnen. Aus diesen Zwischenprodukten wird dann Zellsubstanz aufgebaut (im Wesentlichen Nukleinsäuren, Fette und Proteine) und die Zellteilung sowie die Wirkstoffproduktion angetrieben. Die Glykolyse hat eine schlechtere Energiebilanz als die Stoffwechselwege in den Mitochondrien, aber dafür ist sie schnell – und auf Tempo kommt es an, wenn eine T-Zelle ihr passendes Antigen erkannt hat und sich rasant vermehren muss, um die Gefahrenquelle zu bekämpfen, bevor der Körper großen Schaden nimmt.
Gedächtnis-T-Zellen sind dagegen wieder auf den Citratzyklus und OXPHOS angewiesen, denn sie müssen sehr lange überleben, um als Archiv für ehemalige Infektionen und andere überstandene Gefahren zu dienen. Sie müssen aber, solange sie nicht reaktiviert werden, kaum Immunsystem-Wirkstoffe herstellen oder einlagern, können also Aminosäuren und Fettsäuren aus nicht mehr benötigten Proteinen und Lipiden ruhig abbauen bzw. in Energieträgermoleküle umwandeln.
Ein Forscherteam um Zhen Yang ist 2015 der Frage nachgegangen, ob die autoreaktiven T-Zellen, die bei Autoimmunerkrankungen auftreten, womöglich einen charakteristisch veränderten Zellstoffwechsel aufweisen. Ihre Idee: Eine Stoffwechselstörung, etwa eine ständige Überproduktion von Energie, könnte die Immunzellen chronisch überaktiv machen – und eine chronische Entzündung unter Beteiligung autoreaktiver T-Zellen ist für Autoimmunerkrankungen typisch, etwa für rheumatoide Arthritis (RA) oder systemischen Lupus erythematodes (SLE). Dann könnte man diese Erkrankungen womöglich durch Eingriffe in den Stoffwechsel der T-Zellen bremsen oder gar heilen.
Das wäre natürlich zu schön gewesen. Leider stellt sich die Lage komplexer dar: Sowohl bei RA als auch bei SLE ist der Stoffwechsel der T-Zellen verändert – aber nicht gleichartig.
Bei RA fahren frisch stimulierte CD4+-T-Zellen die Glykolyse nicht so schnell hoch wie bei Gesunden; sie produzieren nicht so viel ATP und Lactat, teilen sich aber trotzdem lebhaft. Die Bremse ist ein Glykolyse-Enzym mit dem furchteinflößenden Namen 6-Phosphofructo-2-Kinase/Fructose-2,6-Bisphosphatase 3, das wir zum Glück PFKFB3 nennen dürfen. An diesem Enzym herrscht in den T-Zellen von Rheumatikern Mangel, da das entsprechende Gen viel zu schwach abgelesen wird. Die Zwischenprodukte, die sich vor diesem Nadelöhr in der Glykolyse anstauen, weichen auf einen anderen Stoffwechselweg aus: den Pentosephosphatweg. Das führt zu einem Mangel an sogenannten reaktiven Sauerstoffspezies (ROS). Ein ROS-Mangel wiederum geht mit starken Gelenkentzündungen einher; ROS schützt vor Arthritis.
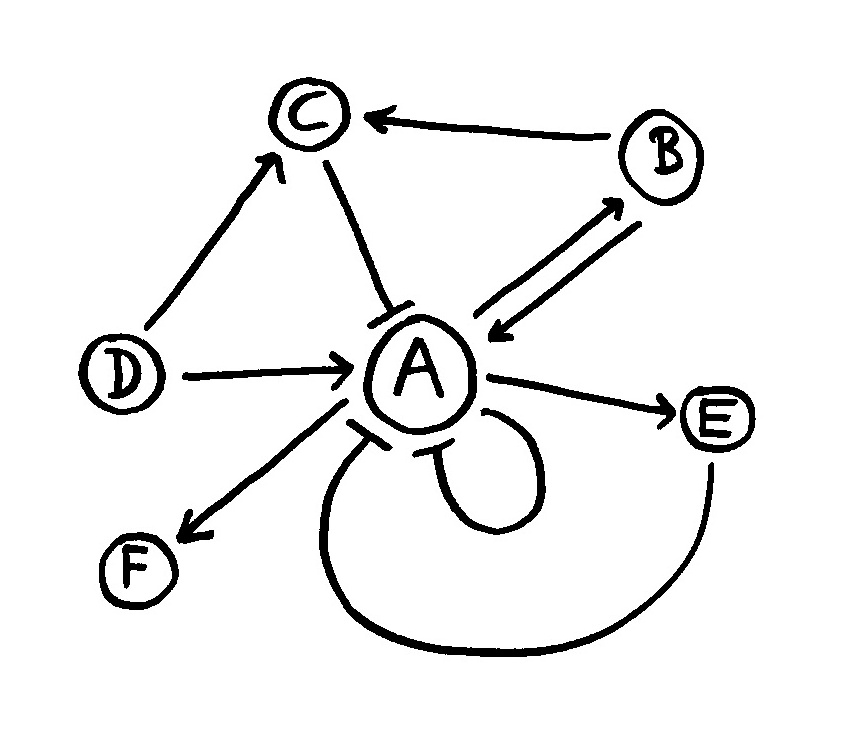
Warum das Enzym PFKFB3 nicht richtig abgelesen wird, ist unklar. Die T-Zellen von RA-Patienten altern vorzeitig. Aber ob diese zelluläre Frühvergreisung durch Energiedefizite aufgrund des Enzymmangels zustande kommt oder umgekehrt das Enzym nicht richtig abgelesen wird, weil die Zellvergreisung das Erbgut schädigt und die Gen-Expression beeinträchtigt, weiß man nicht. Jedenfalls sterben T-Zellen, die nicht genug ATP produzieren, vorzeitig ab. Der dadurch drohende Lymphozyten-Mangel (Lymphopenie genannt) zwingt den Organismus, die Produktion neuer naiver T-Zellen zu beschleunigen. Das geschieht bei älteren Erwachsenen nicht etwa im Thymus, der sich ja bereits zurückgebildet hat, sondern durch verstärkte Teilung der schon im Körper kreisenden naiven T-Zellen: die sogenannte homöostatische T-Zell-Proliferation. Bei diesem Prozess scheinen sich autoreaktive T-Zellen bevorzugt zu vermehren, was zu einer Autoimmunerkrankung führen kann.

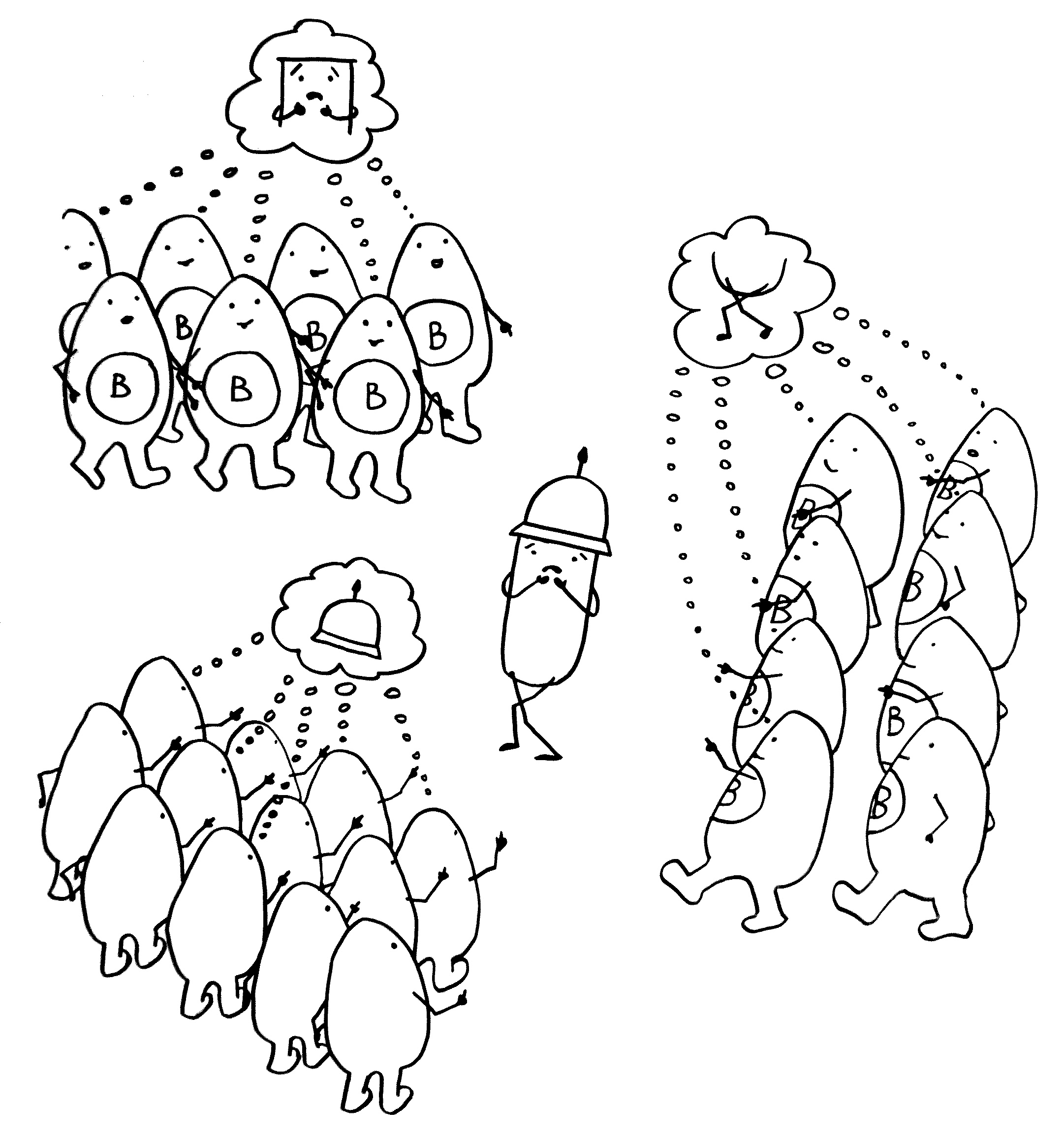
Homöostatische T-Zell-Proliferation: Das Repertoire der naiven T-Zellen mit unterschiedlichen Rezeptoren (oberste Reihe: drei Zellklone) bleibt normalerweise bis ins Alter erhalten, weil Verluste durch Teilung der übrigen Zellen kompensiert werden. Bei einer Lymphopenie, also dem massenhaften vorzeitigen Sterben von T-Zellen, wird die homöostatische Proliferation verstärkt. Dabei können Klone verloren gehen (weiß) und autoreaktive T-Zellen (schwarz) sich so stark vermehren, dass eine Autoimmunerkrankung ausbricht.
Auch die T-Zellen von Lupus-Patienten haben einen auffälligen Stoffwechsel. Aber sie produzieren ihr ATP primär auf dem OXPHOS-Weg in den Mitochondrien, nicht durch Glykolyse. Sie produzieren mehr ROS als normale T-Zellen, nicht weniger. Ihre Energiegewinnung ist gestört; sie bauen weder Glukose noch Fettsäuren noch Aminosäuren so effizient ab wie normale T-Zellen. Vor allem freie Fettsäuren häufen sich wegen des gestörten Abbaus an. Der gestörte Fettstoffwechsel wirkt sich auch auf die Fähigkeit der T-Zell-Rezeptoren zur Wahrnehmung von Antigenen aus: Die Zellmembranen von SLE-Patienten enthalten übermäßig viele Glycosphingolipide, also Lipide mit außen anhängenden Zuckermolekülen. Diese speziellen Lipide lagern sich in der ansonsten nahezu flüssigen Zellmembran gerne zu festeren Regionen zusammen, sogenannten Lipid-Flößen, in die wiederum viele T-Zell-Rezeptoren eingebettet sind. Wohl daher nehmen die T-Zellen von Lupus-Patienten besonders leicht Autoantigen-Signale wahr und aktivieren dann ihrerseits B-Zellen, die Autoantikörper herstellen.
Was lehren uns diese gegensätzlichen Stoffwechseldefekte von T-Zellen bei zwei wichtigen Autoimmunerkrankungen aus dem rheumatischen Formenkreis? Dass die Erkrankungsmechanismen ganz verschieden sein können, auch wenn es sich in beiden Fällen um chronische Entzündungen handelt, bei denen das Immunsystem körpereigenes Gewebe angreift. Dass es daher vermutlich nicht das eine Heilmittel geben und überhaupt noch lange dauern wird, bis wir Autoimmunerkrankungen heilen können. Aber auch, dass man vor lauter Botenstoffen, Signalkaskaden und Erbinformationsableserei den Energiehaushalt des Immunsystems nicht außer Acht lassen darf: Das ist nicht etwa reine Information, die da zwischen und in den Zellen weitergeleitet wird. Es sind vielmehr Substanzen, deren Herstellung und Beseitigung zur rechten Zeit, am rechten Ort und in der rechten Menge Kraftakte und logistische Meisterleistungen des Zellstoffwechsels sind.