Skizzen zu den Arbeiten von Klein et al. und Stoeckle et al., die ich im vorigen Beitrag vorgestellt habe:
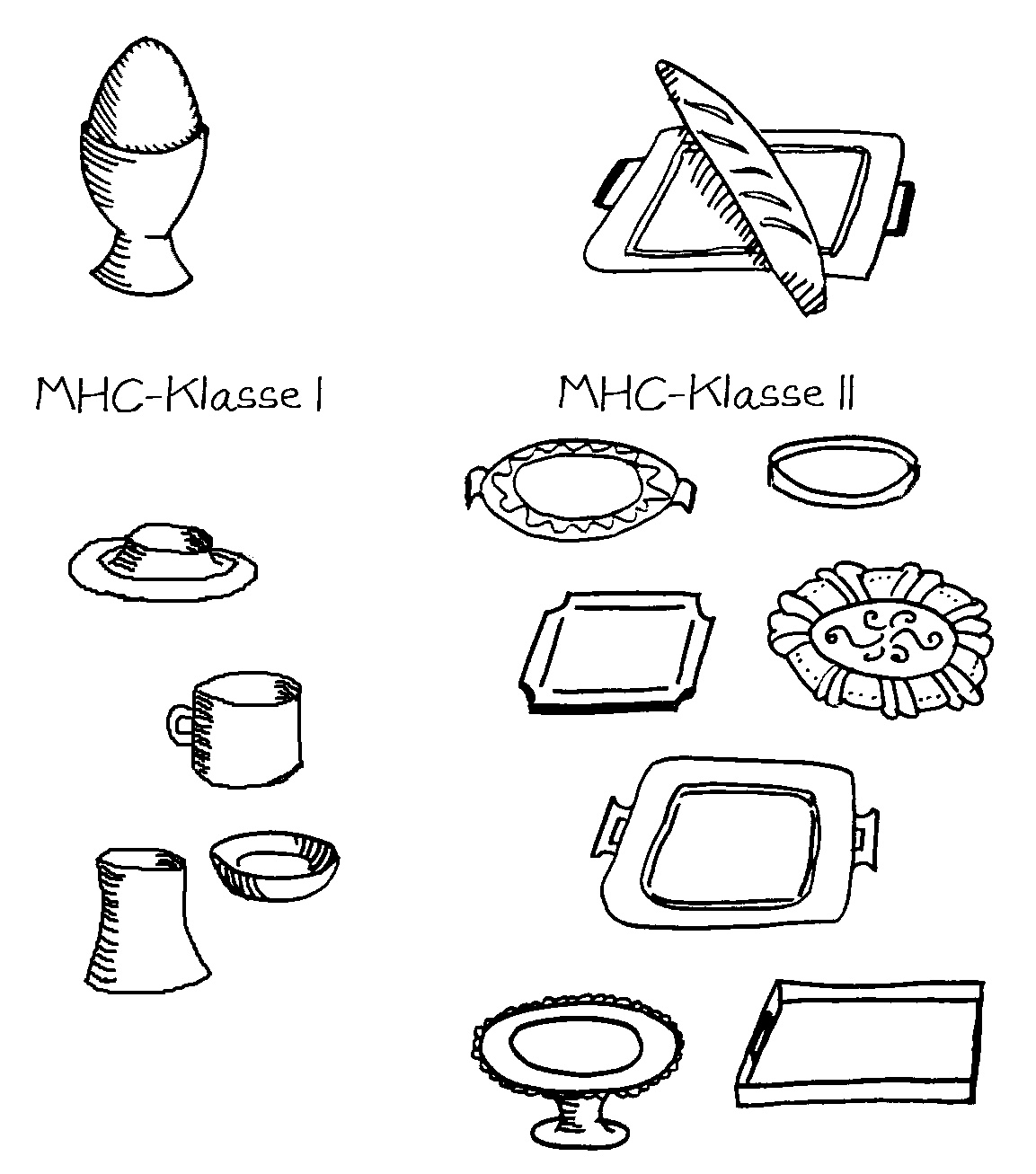
Wie bereits früher dargestellt, präsentieren medulläre Thymus-Epithelzellen (mTECs) den künftigen T-Zellen im Zuge der negativen Selektion alle möglichen Autoantigene, um diejenigen Thymozyten auszusondern, die zu Autoimmunreaktionen neigen. Dazu müssen die Autoantigene im Inneren der mTECs zunächst aufbereitet werden – so, wie Speisen in einer Restaurantküche durch viele Hände gehen, bevor sie den Kunden auf Serviertellern präsentiert werden.

In allen antigenpräsentierenden Zellen (APCs) zerlegen Proteasen, also Protein-verdauende Enzyme, die Antigene, damit diese auf die MHC-Klasse-II-Moleküle (die Servierteller) passen. Bei der Autoantigen-Präsentation durch die mTECs im Thymus kommen dabei andere Proteasen zum Einsatz als in den APCs in der Peripherie, die später den T-Zellen alle möglichen aufgeschnappten Antigene vorführen.
Daher kann es passieren, dass die zentrale Toleranz lückenhaft bleibt. Die Protease Cathepsin S (CatS) etwa schneidet das wichtige Autoantigen MBP, gegen das unser Immunsystem bei der Autoimmunerkrankung Multiple Sklerose reagiert, an bestimmten Stellen in der Aminosäurekette durch – hier in der Mitte der Wurst (gepunktete Linie):
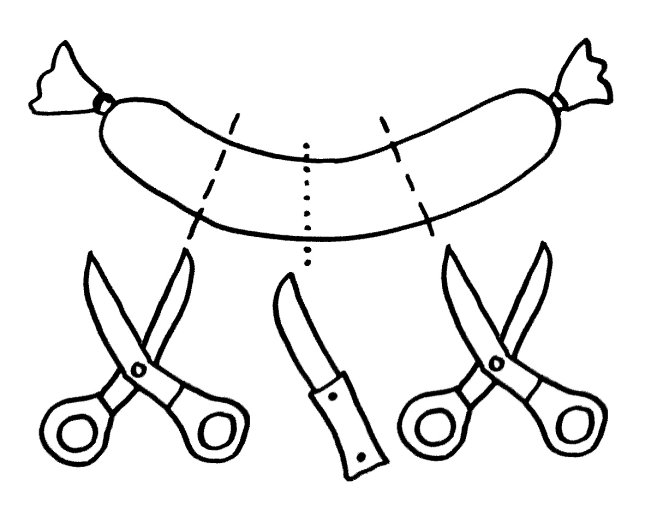
So entstehen kürzere Aminosäureketten oder Proteinstücke, die nach ihrer weiteren Bearbeitung durch andere Enzyme auf den MHC-Klasse-II-Molekülen der APCs präsentiert werden. In unserem Beispiel werden im Thymus linke und rechte Wursthälften präsentiert, und alle Thymozyten, die auf deren Erkennungsmuster (etwa die Wurstzipfel) zu stark reagieren, werden im Rahmen der negativen Selektion aussortiert, um dem Körper Autoimmunreaktionen zu ersparen.
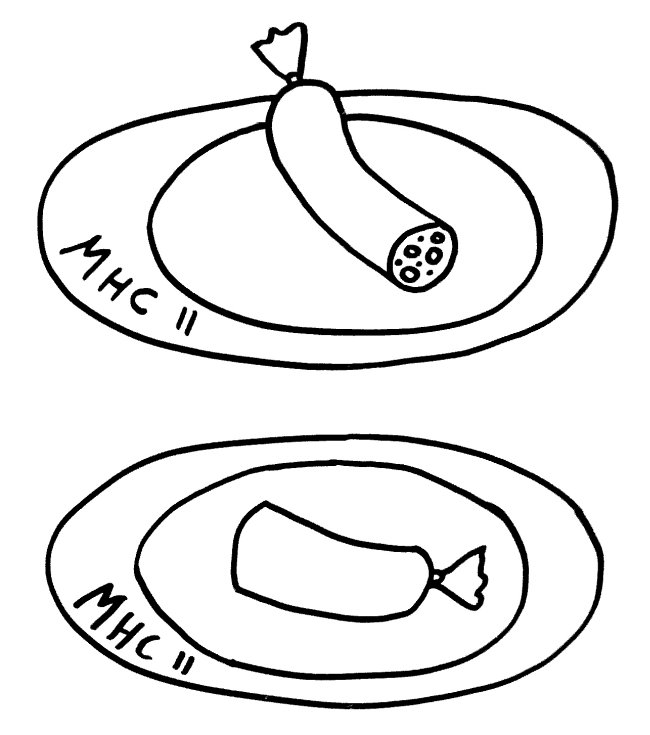
Aber was, wenn APCs außerhalb des Thymus das Protein MBP mit ihren Proteasen anders zerlegen – etwa an den gestrichelten Stellen, sodass auch Mittelstücke ohne Zipfel entstehen?

Im Thymus wurden keine Wurstmittelstücke präsentiert. Daher kann es passieren, dass T-Zellen mit Wurtstmittelstück-Rezeptoren, die im Körper patrouillieren, bei der Präsentation Alarm schlagen: eine Autoimmunreaktion von T-Zellen, die der negativen Selektion im Thymus entwischt sind.