Nur wenige Forscher beschäftigen sich mit der Entwicklung des gesamten Immunsystems, also all der Komponenten sowohl der angeborenen als auch der erworbenen Abwehr, über das ganze Leben hinweg: von der Geburt bis ins hohe Alter. Hier stelle ich eine dieser wenigen Arbeiten vor:
Petter Brodin et al. (2015): Variation in the Human Immune System Is Largely Driven by Non-Heritable Influences (Open Access)
Die Autoren haben an 105 gesunden Zwillingspaaren, also 210 Personen, 204 Immunsystem-Parameter untersucht, darunter die Häufigkeit von 95 verschiedenen Immunzelltypen, die Konzentration von 51 Zytokinen, Chemokinen und Wachstumsfaktoren im Serum und die Veränderungen dieser Werte nach Anregung der Immunzellen durch Botenstoffe. 78 Zwillingspaare waren eineiig, 27 zweieiig. Bei der großen Mehrheit, nämlich 77 Prozent der Parameter waren die Unterschiede zwischen den Zwillings-Messwerten überwiegend (nämlich zu mehr als der Hälfte) nicht erblich, sondern durch unterschiedliche Umwelteinflüsse bedingt. Die Unterschiede bei 58 Prozent der Immunsystem-Parameter waren sogar ganz überwiegend (zu mehr als 80 Prozent) nicht erblich bedingt. Außerdem unterschieden sich die Immunsysteme älterer Zwillingspaare deutlich stärker als die jüngerer: Der Umwelteinfluss nimmt mit den Jahren zu.
Mit den Jahren entwickeln sich Zwillinge immunologisch immer weiter auseinander, weil unterschiedliche Umwelteinflüsse auf sie einwirken, etwa Impfungen, Infektionen, Zellgifte oder ihre Kost.
Die Erblichkeit der Parameter wurde anhand von Messungen an eineiigen und zweieiigen Zwillingspaaren ermittelt. Zwischen eineiigen Zwillingen sollten erbliche Faktoren (also Gene und dauerhafte epigenetische Markierungen des Erbguts) zu 100 Prozent übereinstimmen, zwischen zweieiigen Zwillingen dagegen – wie bei anderen Geschwisterpaaren – nur zu 50 Prozent. Umweltfaktoren (darunter auch stochastische epigenetische Veränderungen) sollten dagegen ein- und zweieiige Zwillinge gleichermaßen beeinflussen.
Unter den Immunzelltypen gab es einige wenige, deren Häufigkeit im Blut der Probanden stark erblich bedingt war, also zwischen eineiigen Zwillingen sehr gut übereinstimmte – vor allem naive CD27+-T-Zellen und CD4+-Gedächtnis-T-Zellen. Die Häufigkeit der meisten Zellen der erworbenen (T- und B-Zellen) sowie der angeborenen Abwehr (Granulozyten, Monozyten und NK-Zellen) unterschied sich dagegen zwischen eineiigen Zwillingen praktisch ebenso stark wie zwischen zweieiigen Zwillingen, sodass man annehmen muss, dass Zufälle und Umweltreize wie Infektionen die Werte prägen.
Unter den Zytokinen erwies sich IL-12p40 als besonders stark erblich. Varianten im Gen dieses Proteins werden mit Krankheiten wie Psoriasis oder Asthma in Verbindung gebracht, an denen das Immunsystem beteiligt ist. Bei vielen anderen Zytokinen war der erbliche Einfluss gering.
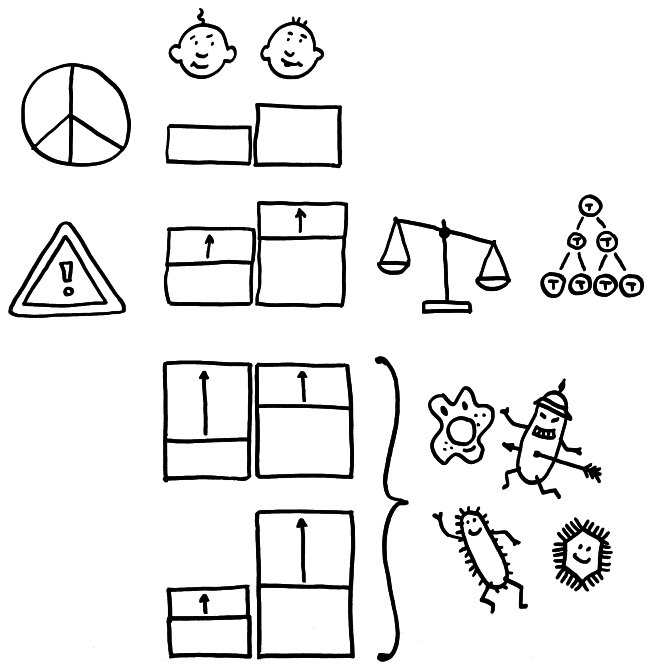
Schon im Ruhezustand (oben) unterscheiden sich viele Immunparameter zwischen Zwillingen. Eine Anregung des Immunsystems löst bei den wenigen erblich dominierten Parametern (etwa den homöostatischen Zytokinen IL-2 und IL-7, die die Vermehrung von T-Zellen steuern) gleich starke Veränderungen aus (Zeile 2). Bei den vielen nicht erblich dominierten Parametern (etwa IL-6, IL-20 oder IL-21) können die unterschiedlichen Reaktionsstärken die Unterschiede zwischen den Basiswerten ausgleichen oder verstärken.
Das galt sowohl für die Basiswerte, die ohne Stimulation des Immunsystems erhoben wurden, als auch für viele Werte, die nach Anregung einer Immunreaktion ermittelt wurden. Eine stark erbliche Komponente fand sich bei den sogenannten homöostatischen Zytokinen IL-2 und IL-7, die bei einer Aktivierung des Immunsystems für die Vermehrung und die richtige Spezialisierung von T-Zellen sorgen. Die meisten Messwerte variierten jedoch nach der Immunsystem-Stimulation zwischen eineiigen Zwillingen fast ebenso unterschiedlich wie zwischen zweieiigen Zwillingen. Dabei waren schwache und starke Immunsystem-Reaktionen gleichermaßen nicht erblich, also durch Umweltfaktoren geprägt.
Stellt man alle gemessenen Immunsystem-Parameter als Netzwerk dar, in dem voneinander abhängige Größen durch Linien verbunden sind, zeigt sich: Die relativ wenigen Parameter mit starker Erblichkeit sind von Parametern umgeben, deren Variabilität durch die Umwelt bedingt ist. Das könnte erklären, warum bekannte Risiko-Genvarianten für bestimmte Krankheiten des Immunsystems oft nur für einen kleinen Teil des Erkrankungsrisikos verantwortlich zeichnen: Ihr Einfluss wird durch andere, nicht erbliche Faktoren abgepuffert, die zum Beispiel in denselben Signalketten oder Regelkreisen angesiedelt sind.
Der im Laufe des Lebens zunehmende Einfluss der Umwelt, vor allem wohl der Infektions- und Impfgeschichte auf den Zustand des Immunsystems war bei den regulatorischen T-Zellen oder Tregs am auffälligsten: Während ihre Häufigkeit bei jungen Zwillingspaaren gut übereinstimmte (Erblichkeit 0,78 von maximal 1,0), waren die Werte bei alten Zwillingspaaren so gut wie unkorreliert (Erblichkeit 0,24, also knapp über der Nachweisbarkeitsgrenze von 0,2). Besonders großen Einfluss auf das Immunsystem nimmt offenbar das Cytomegalovirus (CMV), das uns – wie andere Herpesviren – ein Leben lang erhalten bleibt. In 16 eineiigen Zwillingspaaren aus der Versuchspopulation war ein Geschwister mit CMV infiziert und das andere nicht. Viele ihrer Immunsystem-Parameter unterschieden sich stark, und zwar sowohl im Basiszustand als auch nach Stimulation.
Die Antikörperproduktion nach einer Grippeschutzimpfung war bei den Zwillingspaaren so gut wie gar nicht erblich beeinflusst, sondern fiel – wohl je nach Impf- und Infektionsgeschichte der Individuen – recht unterschiedlich aus.
Angesichts dieser Ergebnisse ist es kein Wunder, dass unter Geschwistern, die dieselben Risikogenvarianten für Autoimmunerkrankungen erben, oftmals nur eines wirklich erkrankt.
