Die Funktion einer Immunzelle wird während ihrer Entwicklung von der Stammzelle im Knochenmark zur reifen Effektorzelle immer weiter festgelegt. Aber es gibt Ausnahmen. So bringt die sogenannte Trogozytose (vom griechischen trogo = nagen, knabbern) Flexibilität ins Spiel: Zellen können Oberflächenmarker an andere Zellen – insbesondere Immunzellen – übergeben. Die Empfängerzelle übernimmt dann trotz eines unveränderten Genexpressionsprofils neue Aufgaben, etwa Antigenpräsentation oder Toleranzinduzierung. In der Fachliteratur wird dieser Mechanismus auch als „cross-dressing“ bezeichnet.
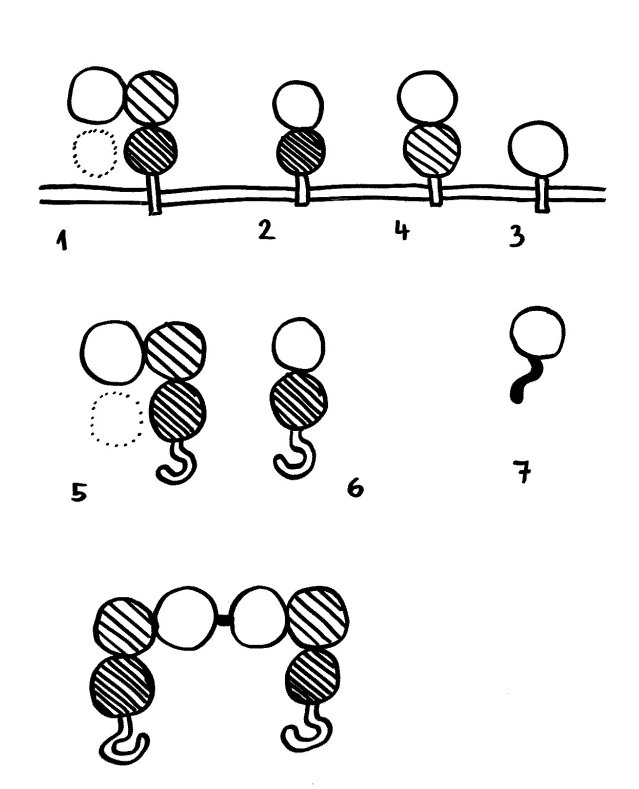
So können etwa Monozyten oder Makrophagen Immunkomplexe aus Antigenen und Antikörpern des Typs IgG von B-Zellen übernehmen. Spender und Empfänger bilden dazu eine Synapse, eine innige Verbindung, bei der Fcγ-Rezeptoren an der Oberfläche der Empfänger an die freien konstanten Ende der Antikörper binden, die wiederum mit ihrer antigenspezifischen Seite an die Antigene gebunden sind, die die B-Zellen auf ihrer Oberfläche tragen. Wenn sich die Zellen wieder voneinander lösen, bleibt ein Teil der Membran des Spenders mitsamt Antikörpern und Antigenen an der Empfängerzelle haften. Die Spenderzelle schnürt diesen Membranteil ab, ohne dabei Schaden zu nehmen. Der Empfänger baut die geklauten Proteine ab oder präsentiert sie auf seiner Oberfläche, wo sie von anderen Zellen erkannt werden können.
Nach diesem Schema verläuft auch die Übernahme von Antigen-beladenen MHC-Komplexen durch T-Zellen: Weiterlesen