Neulich las ich, dass selbst schwaches Nachtlicht eine Brustkrebstherapie u. U. wirkungslos machen kann, weil das Licht die nächtliche Melatoninproduktion stört, was wiederum die Tumorzellen stärkt. Beim Nachrecherchieren führte eins zum anderen, und zack: Schon muss das Autoimmunbuch um ein Kapitel erweitert werden. Wie die sogenannte circadiane Rhythmik – das Schwingen aller möglicher Abläufe in unserem Körper mit einer Periode von etwa 24 Stunden – und der nächtliche Schlaf unser Immunsystem regeln, ist nämlich hochspannend und auch für Autoimmunerkrankungen relevant.
Von dem Dutzend Arbeiten, die ich zum Thema gelesen habe, empfehle ich vor allem die Übersicht „T Cell and Antigen Presenting Cell Activity During Sleep“ von Tanja Lange und Jan Born (2011), auf der die meisten der folgenden Abbildungen basieren.
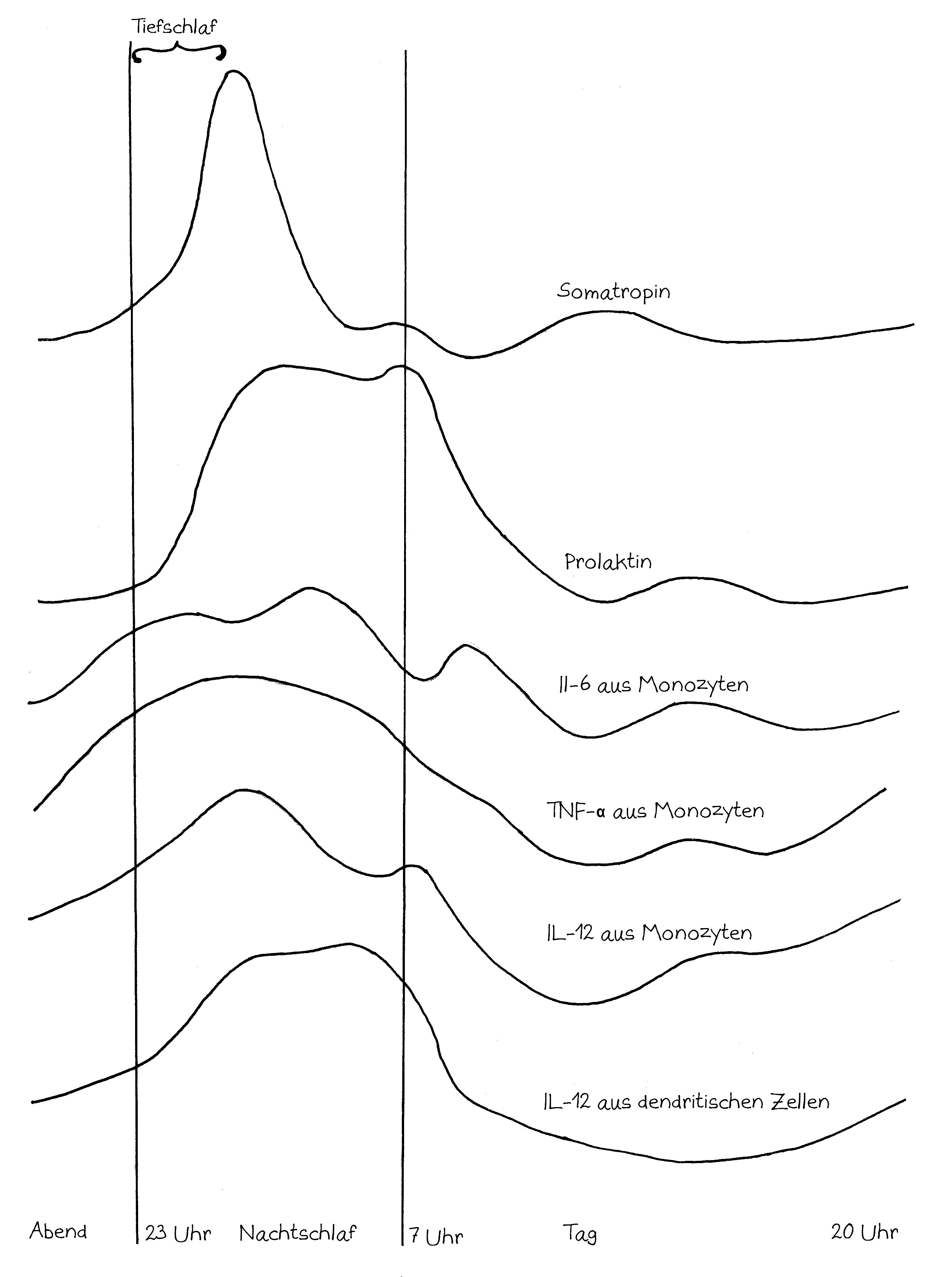
Wie stellt das Immunsystem sicher, dass sich entzündungsfördernde und entzündungshemmende Signale, die angeborene und die erworbene Abwehr sowie der Th1- und der Th2-Arm der erworbenen Abwehr nicht ins Gehege kommen? Durch räumliche und zeitliche Trennung: Der Tag gehört den entzündungshemmenden Signalen, der angeborenen Abwehr und denjenigen Zellen der erworbenen Abwehr, die Pathogene unmittelbar bekämpfen: den zytotoxischen T-Zellen. Und in der Nacht – vor allem, wenn man schläft und nicht durchwacht – dominieren Entzündungsreaktionen, die uns tags bei lebensnotwendigen Aktivitäten stören würden. Außerdem wird nachts durch die Kontakte zwischen antigenpräsentierenden Zellen und T-Helferzellen das immunologische Gedächtnis angelegt.
Hormone aus der Zirbeldrüse und der Hypophyse im Gehirn sowie aus der Nebennierenrinde, deren Ausschüttung von der zentralen inneren Uhr im Hypothalamus gesteuert wird, sorgen dafür, dass die richtigen Zellpopulationen zu jeder Zeit am richtigen Ort sind – also im Blut, im Lymphsystem, im peripheren Gewebe oder im Knochenmark. Die zentrale innere Uhr basiert auf einer Handvoll Gene, deren Ableseprodukte (die Proteine PER, CRY, REV-ERB, ROR, CLOCK und BMAL) wechselseitig ihre eigene Ablesung ein- und ausschalten. Ohne äußere Impulse oszilliert diese Rückkopplung mit einer Periode von etwas mehr als 24 Stunden. Durch Tageslichtsignale – von Nervenzellen in der Netzhaut an den Hypothalamus übermittelt – wird sie auf genau 24 Stunden eingestellt.
Die zentrale Uhrzeit wird vor allem durch das Zirbeldrüsen-Hormon Melatonin an die Zellen im gesamten Körper übermittelt. Die Melatoninkonzentration ist mitten in der Nacht am höchsten, fällt noch in der Nacht steil ab und bleibt tags sehr niedrig, bis sie abends wieder anzusteigen beginnt:
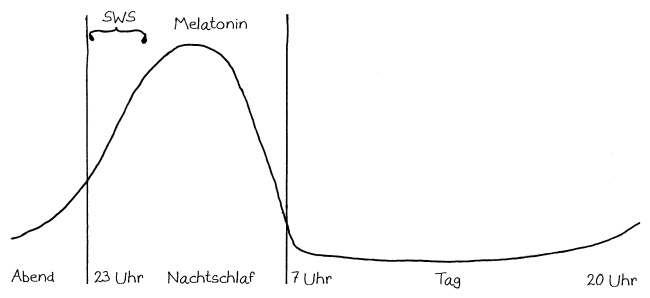 In dieser und den folgenden Abbildungen ist die Konzentration im Blut während etwas mehr als 24 Stunden dargestellt, beginnend mit dem Abend eines Tages bis zum Abend des nächsten Tages. Die beiden senkrechten Linien markieren die Nacht, in der man idealerweise zwischen 23 und 7 Uhr schläft. In der ersten Nachthälfte gerät man in den Tiefschlaf, hier wegen der englischen Bezeichnung slow-wave sleep als SWS bezeichnet. Diese Schlafphase ist für die Regelung des Immunsystems entscheidend.
In dieser und den folgenden Abbildungen ist die Konzentration im Blut während etwas mehr als 24 Stunden dargestellt, beginnend mit dem Abend eines Tages bis zum Abend des nächsten Tages. Die beiden senkrechten Linien markieren die Nacht, in der man idealerweise zwischen 23 und 7 Uhr schläft. In der ersten Nachthälfte gerät man in den Tiefschlaf, hier wegen der englischen Bezeichnung slow-wave sleep als SWS bezeichnet. Diese Schlafphase ist für die Regelung des Immunsystems entscheidend.
Weiterlesen →