Viele genetische Varianten sorgen nicht für einen anderen Aufbau und damit eine veränderte Wirkung eines Proteins. Stattdessen verändern sie nur die Menge, die zu einem bestimmten Zeitpunkt in einem Zelltyp hergestellt wird. Solche Genvarianten bezeichnet man als expression quantitative trait loci oder eQTL, also als Genorte (loci), deren Merkmal (trait) eine variable Expressionsmenge (expression quantitative) ist.
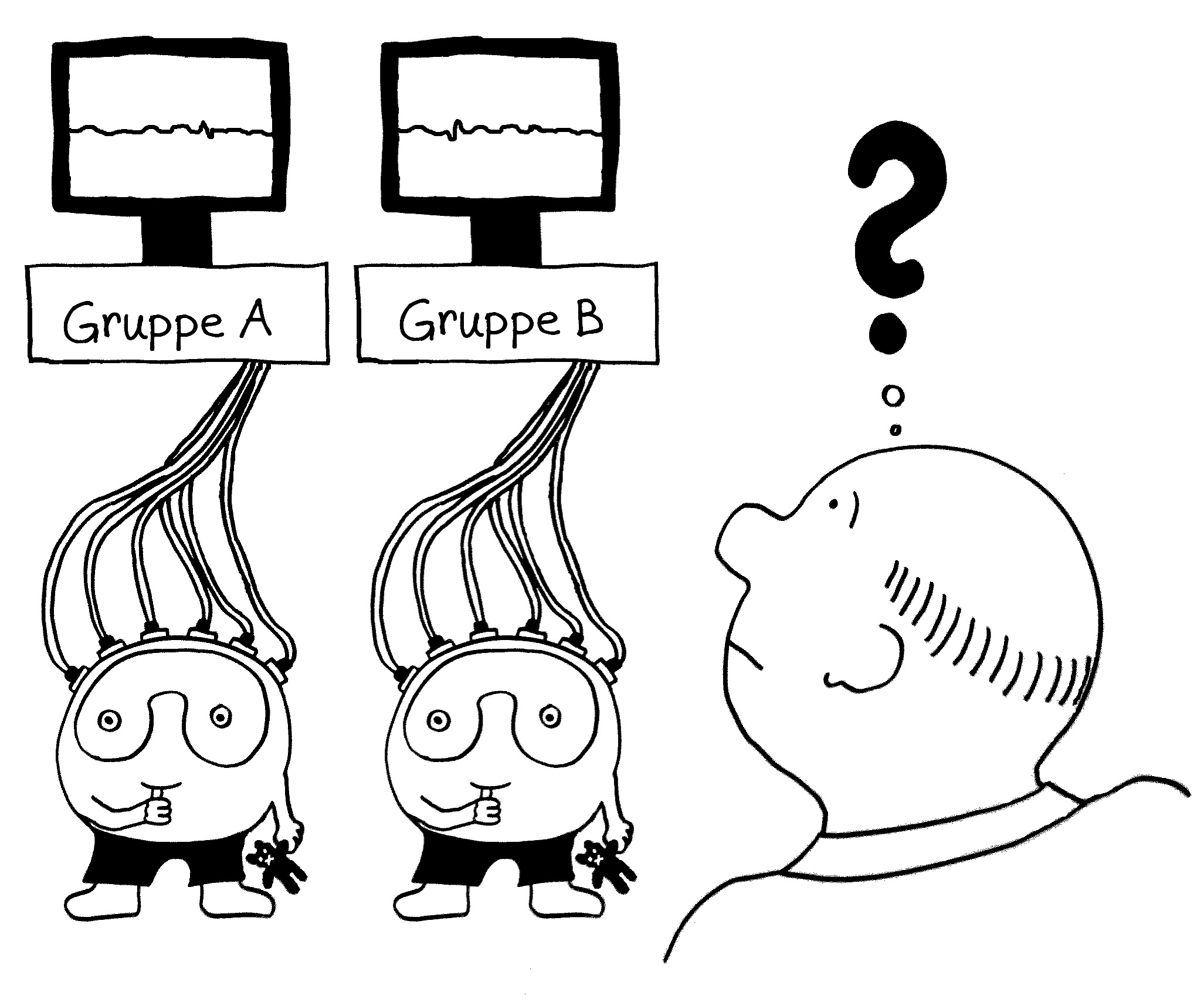
Früher hat man untersucht, wie sich kleine genetische Varianten, die statistisch mit Autoimmunerkrankungen korrelieren, auf die Ablesestärke von Immunsystem-Genen in einem Gemisch weißer Blutkörperchen (Monozyten, T-Zellen, B-Zellen usw.) auswirken. Das ist ungefähr so witzlos wie ein Elektroenzephalogramm von einer ganzen Gruppe von Leuten.
Dann hat man einzelne Immunzelltypen aus den Blutproben von gesunden Probanden isoliert und beispielsweise die Ablesung bestimmter Immunsystem-Gene in den Monozyten von Europäern mit der Ablesung derselben Gene in den Monozyten von Asiaten verglichen. Bei vielen Genen, die man im Verdacht hat, das Risiko für Autoimmunerkrankungen in bestimmten Bevölkerungsgruppen zu beeinflussen, sah man allerdings keine großen Unterschiede. Das ist kein Wunder, denn die Immunzellen wurden im nicht angeregten Grundzustand untersucht.
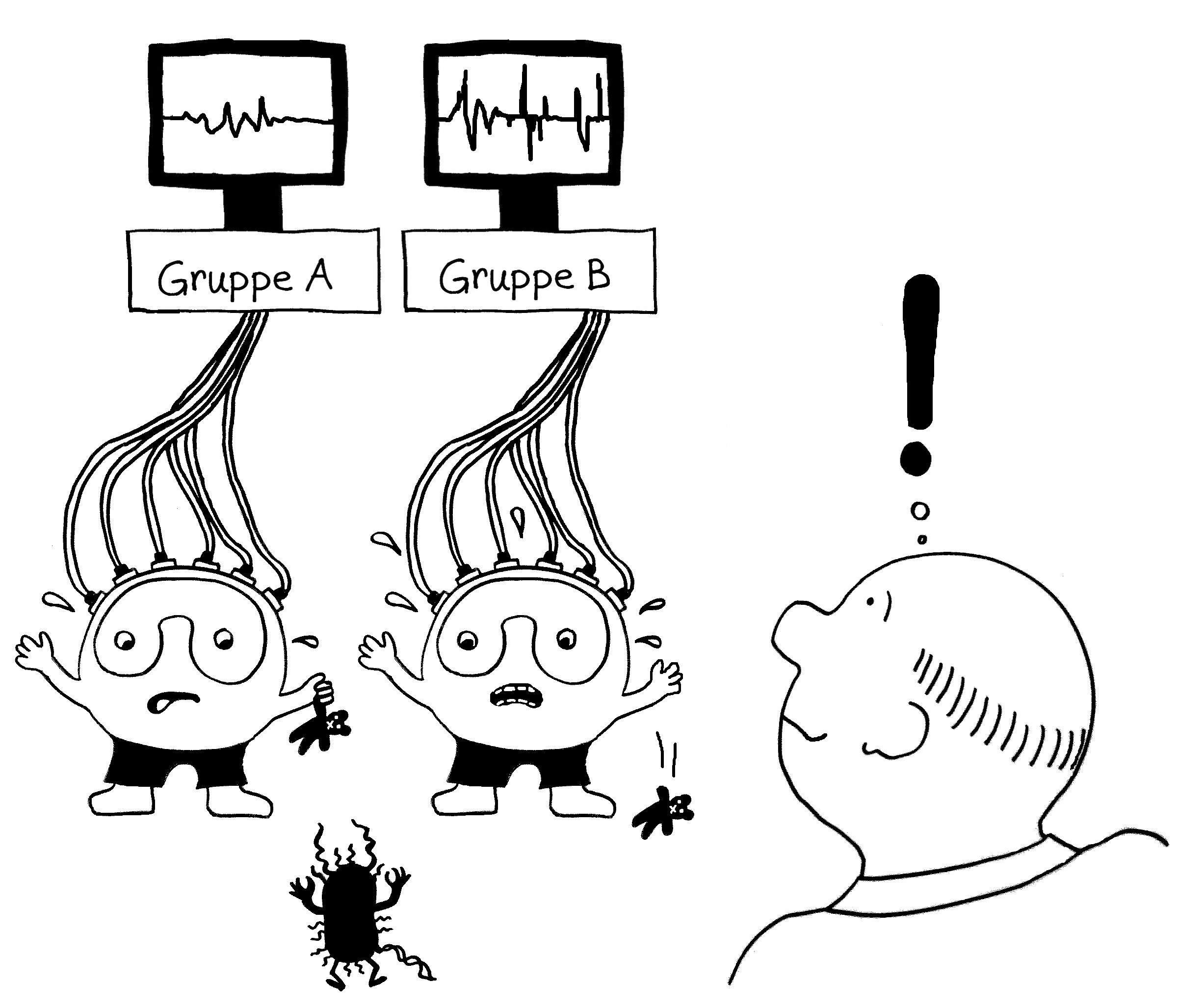
Immunreaktionen werden durch Alarmsignale ausgelöst, zum Beispiel durch Moleküle, die für
Bakterien typisch sind. Also hat man im nächsten Schritt bestimmte Zelltypen aus dem Blut
unterschiedlicher Probandengruppen durch Gefahrensignale aktiviert. Und siehe da: Bestimmte Immunsystem-Gene werden nach der Aktivierung eines Immunzelltyps (hier Monozyten) besonders stark abgelesen, wenn die DNA der Probanden an anderer Stelle eine Risiko-Genvariante enthält.
Sie dürfen diese Zeichnung gerne in Folien etc. übernehmen, sofern Sie die Quelle angeben: Dr. Andrea Kamphuis, https://autoimmunbuch.de