Vorab: Im Unterschied zu den meisten anderen Artikeln enthält dieser Beitrag Abbildungen, die ich nicht selbst erstellt habe, als Bildzitate. Sie stehen nicht unter der sonst hier üblichen CC-Lizenz (siehe „Über dieses Blog“).
Der Thymus ist seit der Antike bekannt, wenn auch seine Funktion lange unklar blieb. Seine Histologie ist bereits in Gray’s Anatomy korrekt dargestellt: Zwischenwände aus Bindegewebe (Trabekel oder Septen) unterteilen jeden Lappen in mehrere Läppchen, die größtenteils mit dunkler Rinde (Cortex) gefüllt sind, während das hellere Mark (Medulla) die Mitte einnimmt. In den Trabekeln verlaufen Blutgefäße.
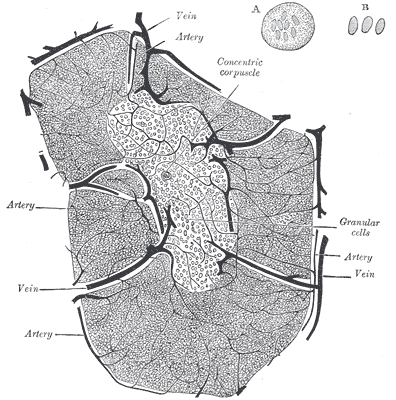
aus: Henry Gray (1918) Anatomy of the Human Body
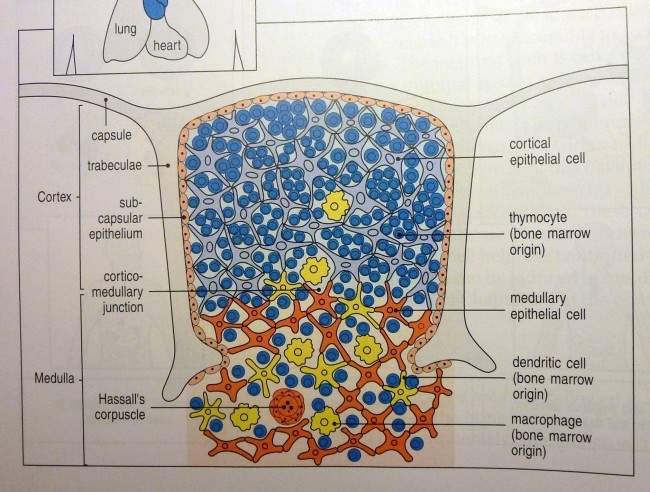
In der folgenden Abbildung von der Website des OpenStax College ist eine Schemazeichnung mit fünf Zelltypen enthalten:
- Thymozyten – die aus dem Knochenmark stammenden, über die Blutgefäße in den Thymus eingewanderten Vorläufer der T-Zellen,
- Rinden-Epithelzellen,
- Mark-Epithelzellen,
- dendritische Zellen und
- Makrophagen.
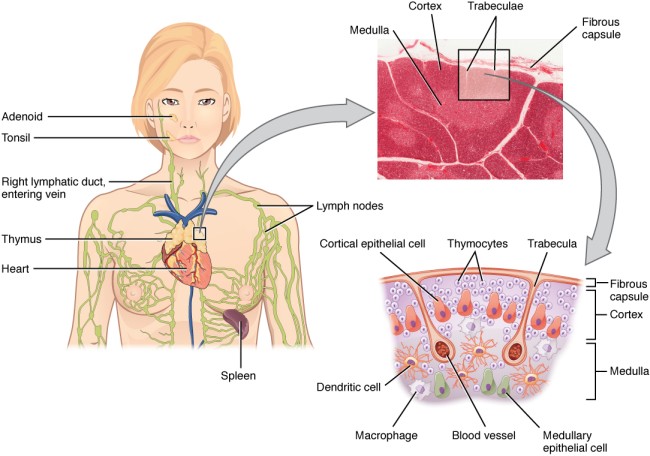
By OpenStax College [CC BY 3.0 (http://creativecommons.org/licenses/by/3.0)], via Wikimedia Commons
Alles schön übersichtlich, alles passt zur Erzählung: Die Rinden-Epithelzellen sind für die positive Selektion zuständig, vermitteln also nur solchen Thymozyten ein Überlebenssignal, die nach der Neuanordnung ihrer T-Zell-Rezeptor-Gene schwach an die ihnen präsentierten MHC-Autoantigen-Komplexe binden. Dann wandern die überlebenden Thymozyten weiter in das Mark, wo die Mark-Epithelzellen und die klassischen antigenpräsentierenden Zellen die negative Selektion vornehmen: Sie sondern alle Thymozyten aus, die zu stark an die präsentierten Autoantigene binden und daher später Autoimmunreaktionen auslösen könnten. So wird die sogenannte zentrale Toleranz des Immunsystems hergestellt. Anschließend wandern die verbliebenen T-Zellen über die Blutgefäße in den Körper aus, wo sie ständig nach Antigenen suchen, die zu ihren Rezeptoren passen, und bei einer entsprechenden Begegnung eine Immunreaktion auslösen.
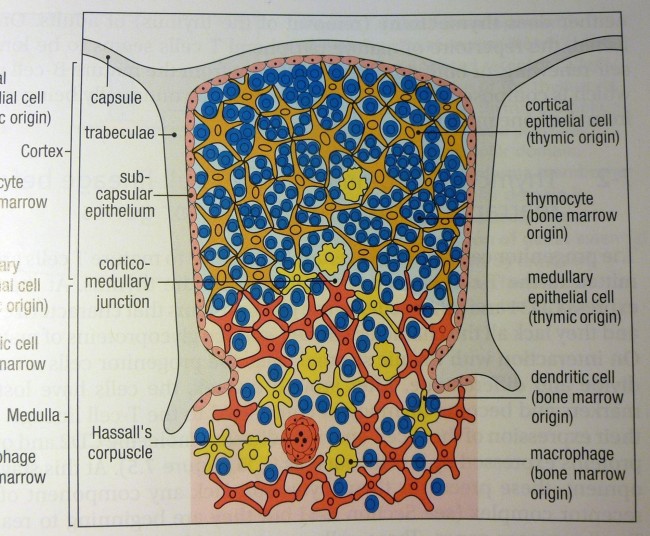
Ähnliche Abbildungen finden sich in fast jedem Lehrbuch der Immunologie, angefangen vermutlich mit der ersten Auflage des Janeway’s. Hier die Version aus der siebten Auflage:
K. M. Murphy, P. Travers, M. Walport: Janeway’s Immunobiology. Taylor & Francis, 7. Auflage, 2008; Abb. 7-15 (S. 274)
Die Epithelzellen mit ihren langen Ausläufern bilden ein lockeres Netz, dessen Hohlräume in der Rinde nahezu vollständig mit Thymozyten angefüllt sind. Im Mark herrscht weniger Gedränge, da viele Thymozyten bereits in der Rinde eingegangen sind. Dafür findet sich hier nun ein neues Objekt: das Hassall-Körperchen, von dem es im Text lapidar heißt, es sei vermutlich an der Vernichtung der aussortierten Thymozyten beteiligt.
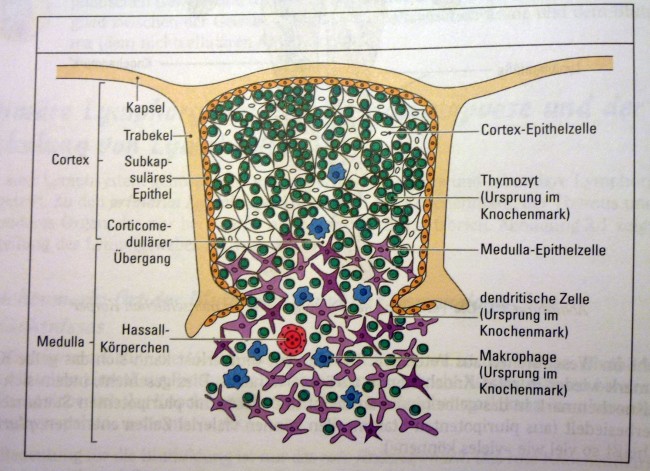
Dieselbe Zeichnung wird auch in Peter Parhams The Immune System (2015) verwendet, was kein Wunder ist, da dieses Buch auf dem Janeway’s aufbaut:
P. Parham: The Immune System. GarlandScience, 4. Auflage, 2015; Abb. 7.3, S. 179
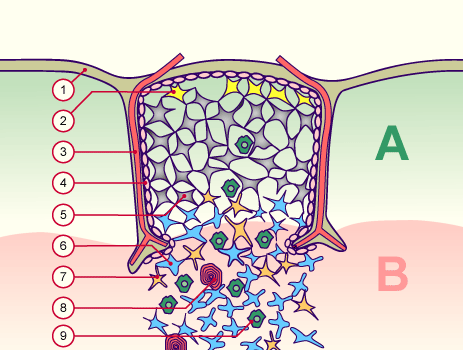
Auch andere Verlage bedienen sich dieser Vorlage, so Wiley in dem Titel Immunologie für Dummies:
B. Häcker: Immunologie für Dummies. Wiley-VCH, 1. Auflage, 2014; Abb. 3.2 (S. 58)
Nicht, dass ich mich über diese schlichte Nachzeichnung empören möchte: Ich selbst habe es nicht anders gemacht. Allerdings habe ich außer Janeway’s auch diese Vorlage von der Website Embryology.ch herangezogen, die um einen weiteren Zelltyp ergänzt ist, nämlich die gelben Sternchen an der Außenwand des Läppchens (Nr. 2): die thymic nurse cells, zu Deutsch: Ammenzellen.
Quelle: http://www.embryology.ch/allemand/qblood/lymphat03.html#anchaut
Hier das Ganze noch einmal mit Thymozyten in den Hohlräumen zwischen den Epithelzellen:
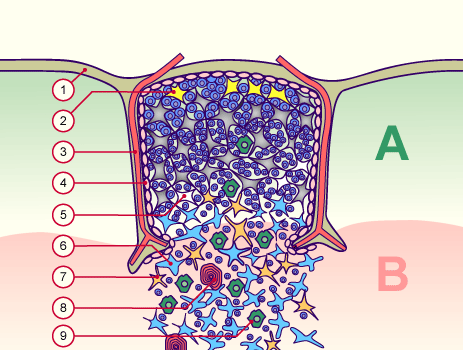
Quelle: http://www.embryology.ch/allemand/qblood/lymphat03.html#anchaut
In meiner Zeichnung habe ich die Thymozyten im zentralen Läppchen weggelassen, damit sie nicht zu unruhig wird, und dafür rechts nur die Thymozyten dargestellt:
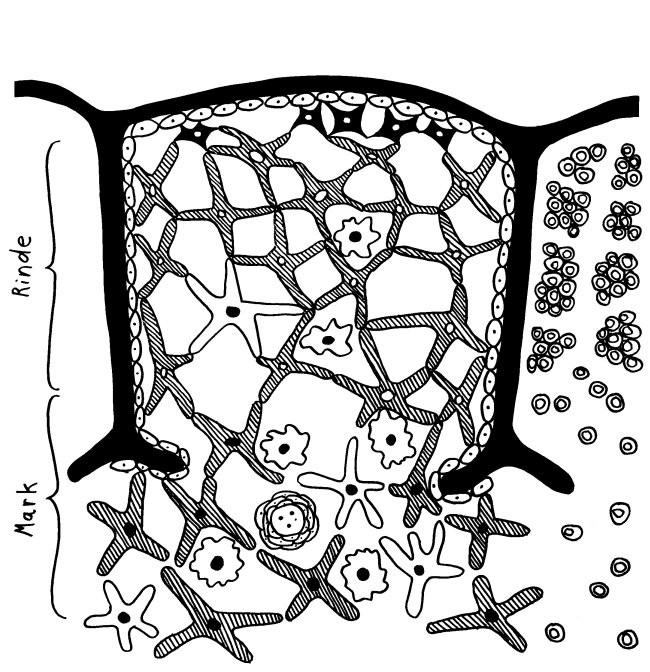
Die mysteriösen Ammenzellen werden ganz unterschiedlich dargestellt, weil man noch Jahrzehnte nach ihrer Entdeckung wenig über sie weiß: In Thymus-Präparaten sind sie optisch nicht von den anderen Rinden-Epithelzellen zu unterscheiden, und wenn man sie in Kultur hält, runden sie sich ab. Auch wo sie im Thymus zu finden sind, scheint nicht endgültig geklärt. In dieser Zeichnung hält sich ein Teil von ihnen am Außenrand des Läppchens auf und eine andere Population im inneren Rindenbereich:
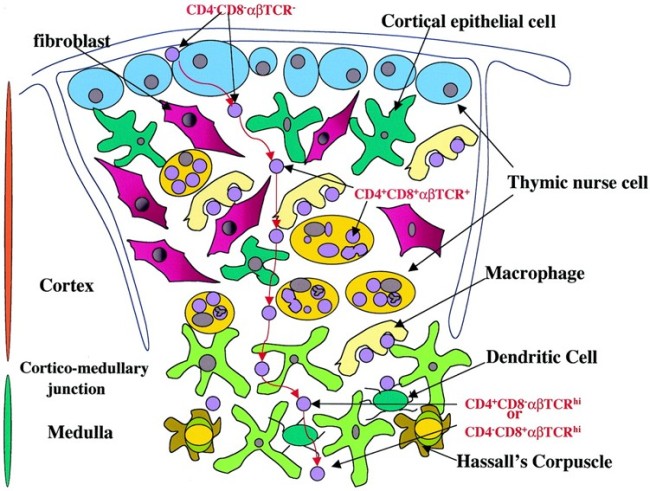
M. Pezzano et al. (2001): Questionable Thymic Nurse Cell. MICROBIOLOGY AND MOLECULAR BIOLOGY REVIEWS, DOI: 10.1128/MMBR.65.3.390–403.2001; Abb. 1
Kurioserweise scheinen sie Thymozyten zu enthalten. Tatsächlich zeichnet genau das Ammenzellen aus: Sie können andere Zellen aufnehmen und lebend wieder ausscheiden. Das hat auch T. V. Rao in seiner Zeichnung darzustellen versucht, wobei die nurse cells hier wiederum nur am äußeren Rand der Rinde angesiedelt sind:
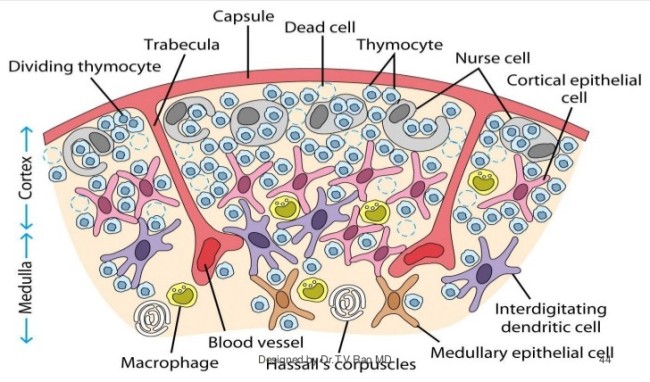
Quelle: Dr. T. V. Rao, MD; http://image.slidesharecdn.com/immunesystem-pptbestfile-120108004634-phpapp01/95/immune-system-structure-and-functions-44-728.jpg?cb=1325984729
Eine französische Quelle gibt der cellule nourricière (links) eine unregelmäßigere Kontur; ihre Ausläufer umfangen Thymozyten und verschlingen sie, während die Rinden-Epithelzelle (rechts) die Thymozyten zwischen ihren „Strahlen“ nur äußerlich bindet:
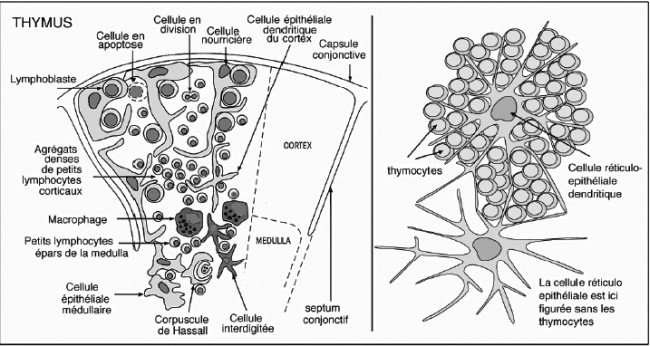
Quelle: http://www.affaireweb.promety.net/
Ganz gleich, wie man sie nun darstellt: Die Existenz von Thymus-Ammenzellen ist inzwischen ebenso gesichert wie die der Hassall-Körperchen, und wir dürfen annehmen, dass beide Strukturen im Thymus wichtige Aufgaben übernehmen. Dass ihre Aufgaben noch nicht genau bekannt sind, sollte nicht dazu verleiten, sie in den Schemazeichnungen zu unterschlagen, um die schöne, glatte Erzählung vom „Bildungsweg“ der Thymozyten im Thymus zu retten. Vielleicht trägt die Aufklärung ihrer Funktion Entscheidendes zum Verständnis von Autoimmunerkrankungen bei.
Wie thymic nurse cells unter dem Elektronenmikroskop aussehen, welche Rolle sie eindeutig nicht und welche sie mutmaßlich wohl spielen und wie sie überhaupt entdeckt wurden, beschreibe ich im nächsten Beitrag. Dass der „Ammenmärchen“ heißen wird, ist ja wohl klar! Kleiner Teaser: Das neuerdings in der Populärliteratur zum „Kuschelhormon“ avancierte Neuropeptid Oxytocin spielt darin eine große Rolle. Es hat mit den Forschern Verstecken gespielt.
Oxytocin (Grafik gemeinfrei)