Man ist ja dankbar für jeden anschaulichen Wirkstoffnamen.

Skizze für das Kapitel über die Organe des Immunsystems in Teil 2 des Buches: ein Thymus-Läppchen, bestehend aus Rinde (Kortex) und Mark (Medulla); Vorlagen: Janeway’s, 7th edition, S. 274, und eine Abbildung auf embryology.ch
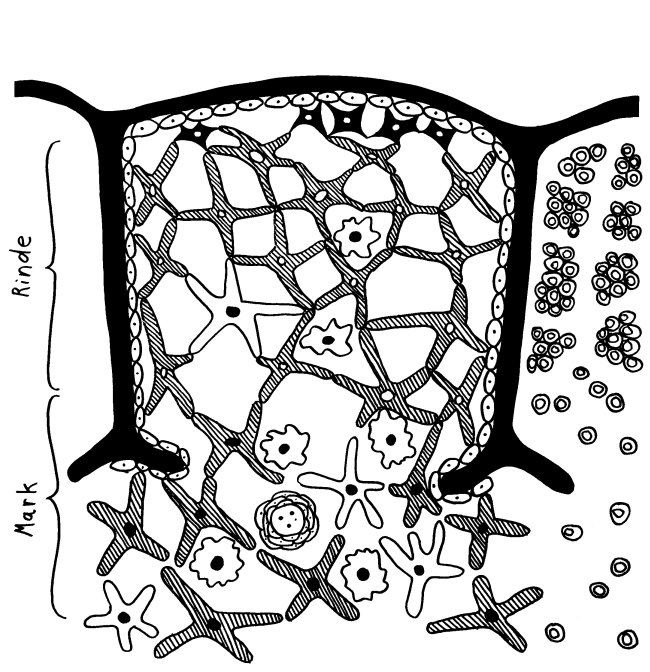 Außer der Kapsel und den Septen, in denen auch – nicht dargestellte – Blutgefäße verlaufen, sehen wir
Außer der Kapsel und den Septen, in denen auch – nicht dargestellte – Blutgefäße verlaufen, sehen wir
In den Hohlräumen des Netzwerks, das die Thymus-Epithelzellen aufspannen, drängen sich T-Zellen – besonders dicht in der Rinde. Um die Abbildung nicht zu unübersichtlich zu machen, habe ich sie im mittleren Thymus-Läppchen weggelassen und ihre Verteilung im angeschnittenen rechten Läppchen angedeutet. Die positive Selektion in der Rinde und die negative Selektion im Mark sorgen für eine starke Ausdünnung, die zum Teil durch die Teilungen der T-Zellen während ihrer Wanderung von der Rinde ins Mark kompensiert wird – siehe nächster Beitrag.
Die negative Selektion habe ich im Mai schon mal im Comic-Stil skizziert.
Weiter geht’s mit der Ausbeute der aufgelaufenen Wissenschafts-Newsletter. T1-T5 sind die Buchteile, für die der Artikel jeweils relevant sein könnte (T1 Einführung, T2 Grundlagen Immunsystem, T3 Ablauf [Auto]Immunrekation, T4 Entwicklung Immunsystem von der Zeugung bis ins Alter, T5 Evolution Immunsystem).
How HIV Destroys Immune Cells T3
Dogs, Dust Microbes, and Allergies T4, T5 (Koevolution Immunsystem – Mikrobiom)
Nishikawa H et al. (2013): Sex differences in the protection of host immune systems by a polyembryonic parasitoid (Abstract) T3, T5
Kallio ER et al. (2013): Maternal antibodies contribute to sex-based difference in hantavirus transmission dynamics (Abstact) T4
Bolte S et al. (2913): Specific immune priming in the invasive ctenophore Mnemiopsis leidyi (Abstract) T5
Rosengaus RB et al. (2013): Immune-priming in ant larvae: social immunity does not undermine individual immunity (Abstract) T3, T5
McFall-Ngai M et al. (2913): Animals in a bacterial world, a new imperative for the life sciences (Open Access) T4, T5 (Mikrobiom)
Zuk M, Borrello ME (2103): Parasites and altruism: converging roads (Open Access) T5
Potlukova, Eliska, et al. (2013): Association between Low Levels of Mannan-Binding Lectin and Markers of Autoimmune Thyroid Disease in Pregnancy (Open Access) T3, T4
Choi YM et al. (2013): Low Levels of Serum Vitamin D3 are Associated with Autoimmune Thyroid Disease in Pre-Menopausal Women (Abstract) T3, T4
Miskinyte M et al. (2013): The Genetic Basis of Escherichia coli Pathoadaptation to Macrophages (Open Access) T3, T5
Dazu auch How Bacteria Evade the Immune System
David LA et al. (2013): Diet rapidly and reproducibly alters the human gut microbiome (Abstract) T4, T5
Dazu auch Gut Bacteria Vary with Diet
Probst AJ et al. (2013): Archaea on Human Skin (Open Access) T4, T5
Dazu auch Neue Mitbewohner auf der menschlichen Haut entdeckt
Ristori G et al. (2103): Effects of Bacille Calmette-Guérin after the first demyelinating event in the CNS (Abstract) T3
Dazu auch TB Vaccine Protects Against MS
Hsiao EY et al. (2013): Microbiota Modulate Behavioral and Physiological Abnormalities Associated with Neurodevelopmental Disorders (Open Access) T4
Dazu auch Gut Microbes and Autism
Joseph CG et al. (2013): Association of the Autoimmune Disease Scleroderma with an Immunologic Response to Cancer (Abstract) T3
Dazu auch A Cancer Culprit in Autoimmunity
Und noch eine Grundlagenskizze fürs Buch:
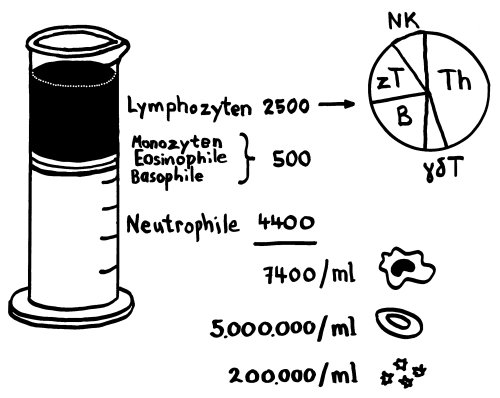 Unter den etwa 7400 Leukozyten (weißen Blutkörperchen) in einem MilliMikroliter Blut eines gesunden Menschen sind ungefähr 2500 Lymphozyten.
Unter den etwa 7400 Leukozyten (weißen Blutkörperchen) in einem MilliMikroliter Blut eines gesunden Menschen sind ungefähr 2500 Lymphozyten.
Von diesen wiederum sind etwa 46% T-Helferzellen, 19% zytotoxische T-Zellen, 7% natürliche Killerzellen, 5% γδ-T-Zellen und 23% B-Zellen.
Einige Leukozytentypen wie die dendritischen Zellen kommen im Blut kaum vor, da sie nach ihrer Entstehung gleich ins Gewebe einwandern und dort bleiben.
Die roten Blutkörperchen oder Erythrozyten und die Blutplättchen oder Thrombozyten sind viel zahlreicher als die Leukozyten.
(All diese Werte haben auch bei Gesunden eine große Spannbreite; Abweichungen von den hier genannten Zahlen sind noch kein Grund zur Sorge.)
Neue Skizze fürs Buch:
 Die Zellen des Immunsystems stellen sich in mehreren Abwehrreihen auf. Vorn stehen Zellen der angeborenen Immunität wie Mastzellen, dendritische Zellen und Makrophagen, im Mittelfeld die unterschiedlichen Granulozyten und in der letzten Verteidigungsreihe zytotoxische T-Zellen, T-Helferzellen, natürliche Killer-T-Zellen und ILCs. Der Torwart ist eine Plasmazelle (B-Zelle). Regulatorische T-Zellen (Tregs) pfeifen das Spiel rechtzeitig ab.
Die Zellen des Immunsystems stellen sich in mehreren Abwehrreihen auf. Vorn stehen Zellen der angeborenen Immunität wie Mastzellen, dendritische Zellen und Makrophagen, im Mittelfeld die unterschiedlichen Granulozyten und in der letzten Verteidigungsreihe zytotoxische T-Zellen, T-Helferzellen, natürliche Killer-T-Zellen und ILCs. Der Torwart ist eine Plasmazelle (B-Zelle). Regulatorische T-Zellen (Tregs) pfeifen das Spiel rechtzeitig ab.
Die letzte Skizze für heute:
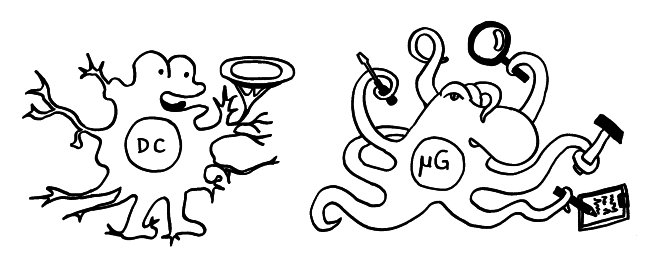 Dendritische Zellen nehmen im Gewebe Antigene auf, verarbeiten sie weiter und präsentieren sie nach ihrer Wanderung in einen Lymphknoten auf ihren MHC-Klasse-II-Molekülen (Tablett) den T-Zellen. Hier ein Frühstadium; das spätere Stadium als antigenpräsentierende Zelle (APC) habe ich schon letztes Jahr skizziert.
Dendritische Zellen nehmen im Gewebe Antigene auf, verarbeiten sie weiter und präsentieren sie nach ihrer Wanderung in einen Lymphknoten auf ihren MHC-Klasse-II-Molekülen (Tablett) den T-Zellen. Hier ein Frühstadium; das spätere Stadium als antigenpräsentierende Zelle (APC) habe ich schon letztes Jahr skizziert.
Mikrogliazellen übernehmen im Gehirn ähnliche Aufgaben wie Makrophagen oder dendritische Zellen: Zwischen den Nervenzellen sitzend, tasten sie mit ihren zahlreichen Ausläufern ständig ihre Umgebung ab, um den Zustand der Synapsen zu überprüfen, gegebenenfalls Nervenverbindungen zu reparieren oder abzubauen und bei Infektionen Erreger zu verschlingen sowie Alarmsignale auszusenden. Das Kuriose: Sie stammen nicht aus dem Knochenmark und auch nicht aus den embryonalen blutbildenden Organen wie der Embryo-Leber, sondern aus dem Dottersack!
Da ich die Makrophagen bereits vor einigen Monaten gezeichnet habe, ist die Skizzenserie zu den Zellen der angeborenen Immunabwehr damit abgeschlossen.
Endlich wieder eine Skizze fürs Buch: Um die irrsinnig komplexen Regelungsvorgänge im Immunsystem zu verstehen, muss man sich vergegenwärtigen, dass unsere Immunzellen eine Vielzahl von Aufgaben wahrnehmen. Sie sind nicht einfach auf die Pathogen-Abwehr optimiert.
Makrophagen und andere phylogenetisch alte Zellen des angeborenen Immunsystems sorgen auch für den sicheren Abbau und Abtransport von Zellen und Geweben, die während der Embryonalentwicklung oder auch bei der Amphibien-Metamorphose überflüssig werden. So schaffen sie Platz für neue Organe. (Wer früher Kaulquappen im Aquarium gehalten hat, erinnert sich vielleicht noch an die Verwunderung, dass der fertige Frosch deutlich kleiner ist als die Kaulquappe kurz vor der Verwandlung.)
Das Hormon, das die Metamorphose der Kaulquappen auslöst, ist übrigens genau das, das ich jeden Morgen schlucke: Thyroxin (T4). Der Regelkreis, der bei Menschen mit Hashimoto-Thyreoiditis wegen der allmählichen autoimmunen Zerstörung der Schilddrüse entgleist, existiert schon bei den Amphibien.
Ich habe meine Fazialislähmung zum Anlass genommen, für das Buch zu skizzieren, wie eine Immunneuropathie abläuft. Zu den Immunneuropathien zählen Autoimmunerkrankungen wie Multiple Sklerose, das Guillain-Barré-Syndrom, chronisch inflammatorische demyelinisierende Polyneuropathie (CIDP) oder vaskulitische Neuropathie. Bei einigen ist das periphere, bei anderen das zentrale Nervensystem betroffen. Oft beschränkt sich die Störung (wie bei der Fazialislähmung) auf einen einzelnen Nerv.
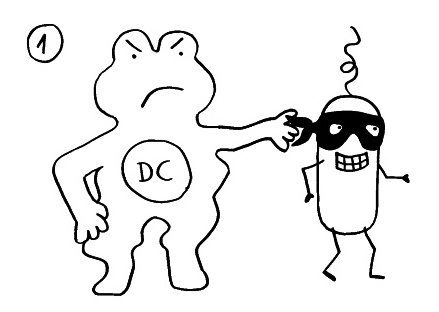
Am Anfang steht vermutlich immer die Reaktivierung eines latenten Virus (z. B. Herpes) oder eine oftmals unbemerkte, da symptomfreie (sogenannte stumme oder maskierte) Infektion, hier durch ein maskiertes Bakterium dargestellt. Eine in der Blutbahn oder im Gewebe patrouillierende Immunzelle – hier eine dendritische Zelle (DC) – entdeckt den Eindringling:
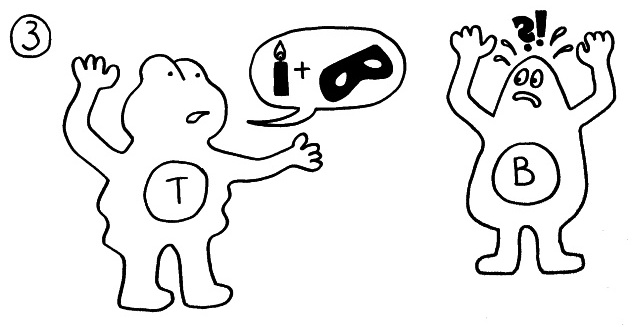
 Die dendritische Zelle nimmt Teile des Erregers auf und verarbeitet sie zu einem präsentablen Antigen weiter. Sie verwandelt sich in eine antigenpräsentierende Zelle (APC), die einer T-Helferzelle das Antigen auf ihrem MHC-Klasse-II-Rezeptor (hier: Tablett) präsentiert. Damit es nicht zu Fehlalarmen kommt, gibt es einen Sicherheitsmechanismus: T-Helferzellen reagieren nur dann auf ein Antigen, wenn ihnen gleichzeitig auf einem anderen Rezeptor ein sogenanntes kostimulierendes Signal präsentiert wird, das anzeigt, dass wirklich eine Infektion oder eine andere Gefahr vorliegt, die bekämpft werden muss (hier: Kerze). Auf der Oberfläche der T-Zelle gibt es für beide Signale spezifische Rezeptoren (hier: Augen/Blickkontakt):
Die dendritische Zelle nimmt Teile des Erregers auf und verarbeitet sie zu einem präsentablen Antigen weiter. Sie verwandelt sich in eine antigenpräsentierende Zelle (APC), die einer T-Helferzelle das Antigen auf ihrem MHC-Klasse-II-Rezeptor (hier: Tablett) präsentiert. Damit es nicht zu Fehlalarmen kommt, gibt es einen Sicherheitsmechanismus: T-Helferzellen reagieren nur dann auf ein Antigen, wenn ihnen gleichzeitig auf einem anderen Rezeptor ein sogenanntes kostimulierendes Signal präsentiert wird, das anzeigt, dass wirklich eine Infektion oder eine andere Gefahr vorliegt, die bekämpft werden muss (hier: Kerze). Auf der Oberfläche der T-Zelle gibt es für beide Signale spezifische Rezeptoren (hier: Augen/Blickkontakt):
 Die T-Helferzellen reichen die Information über das Vorliegen eines Gefahr (Kerze) und über die genaue Art der Gefahrenquelle, also das Antigen (Augenbinde des Bakteriums), über Rezeptoren und Signalstoffe (Sprechblase) an B-Zellen weiter und regen diese so zur Produktion spezifischer Antikörper an:
Die T-Helferzellen reichen die Information über das Vorliegen eines Gefahr (Kerze) und über die genaue Art der Gefahrenquelle, also das Antigen (Augenbinde des Bakteriums), über Rezeptoren und Signalstoffe (Sprechblase) an B-Zellen weiter und regen diese so zur Produktion spezifischer Antikörper an:
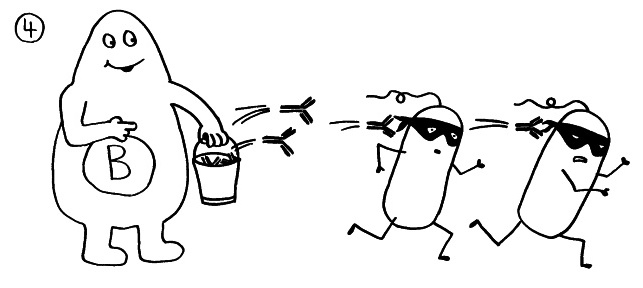
 Die B-Zellen schütten massenhaft Antikörper aus (Eimer), die spezifisch an „ihr“ Antigen binden und die Gefahrenquellen so zum Teil direkt schachmatt setzen, zum Teil zur anschließenden Zerstörung und Entsorgung markieren:
Die B-Zellen schütten massenhaft Antikörper aus (Eimer), die spezifisch an „ihr“ Antigen binden und die Gefahrenquellen so zum Teil direkt schachmatt setzen, zum Teil zur anschließenden Zerstörung und Entsorgung markieren:
 Diese normale Immunreaktion spielt sich in der Blutbahn, im Lymphgewebe und lokal im infizierten Gewebe ab. Aber manchmal läuft etwas schief: Aktivierte T-Zellen können die Blut-Nerven-Schranke durchdringen und von der Blutbahn (im nächsten Bild links) in einen Nerv (rechts) überwechseln. Das sollte eigentlich nicht passieren, da Nerven zu den sogenannten immunprivilegierten Orten im Körper gehören: Da Entzündungsreaktionen hier viel Schaden anrichten können, sind diese Orte für die meisten Immunzellen tabu. Weiterlesen
Diese normale Immunreaktion spielt sich in der Blutbahn, im Lymphgewebe und lokal im infizierten Gewebe ab. Aber manchmal läuft etwas schief: Aktivierte T-Zellen können die Blut-Nerven-Schranke durchdringen und von der Blutbahn (im nächsten Bild links) in einen Nerv (rechts) überwechseln. Das sollte eigentlich nicht passieren, da Nerven zu den sogenannten immunprivilegierten Orten im Körper gehören: Da Entzündungsreaktionen hier viel Schaden anrichten können, sind diese Orte für die meisten Immunzellen tabu. Weiterlesen
Ein Buchkapitel – für mich überwiegend nur am Rande interessant (wegen der Ansicht einiger Autoren, Bell’s palsy sei eine mononeuritische GBS-Variante), aber gute, einfache Darstellung des Grundmodells (Abb.):
M. Mäurer et al. (2012): Immunneuropathien. In: M. Stangel und M. Mäurer, Autoimmunerkrankungen in der Neurologie, Springer
Sowohl dem Guillain-Barré-Syndrom (GBS) als typischer akuter inflammatorischer Neuropathie als auch der chronisch inflammatorischen demyelinisierenden Polyneuropathie (CIDP) liegen Autoimmunreaktionen gegen Myelin zugrunde. Lymphozyten und Makrophagen dringen in die peripheren Nerven ein (Infiltration). Primär meist Demyelinisierung, sekundär Schädigung der Axone. Tiermodell: experimentelle autoimmune Neuritis (EAN), die durch Immunisierung von genetisch anfälligen Versuchstieren mit peripherem Myelin, Myelinprotein P2 oder einer Peptidsequenz daraus oder mit den Myelinproteinen P0, MBP, PMP oder MAG ausgelöst wird. Molekulare Mimikry bei GBS, analog zu MS: Antigenpräsentierende Zellen (APCs) präsentieren auf ihren MHC-II-Molekülen Epitope, die Myelinstrukturen sehr ähneln -> Aktivierung und klonale Expansion naiver T-Zellen, die auch Myelin attackieren – z. B. nach Campylobacter-jejeuni-Infektionen. Bei etwa der Hälfte der GBS-Patienten Antikörper gegen Ganglioside (in Zellmembran verankerte Sphingolipide) gefunden, die als „lipid drafts“ für die Nervenimpulsübertragung wichtig sind. Je nach GBS-Variante andere Antigangliosid-Antikörper. Aus Patienten isolierter C.-jejeuni-Keime exprimieren Lipooligosaccharide (LOS), die den Kohlenwasserstoffanteilen der Ganglioside ähneln. Antikörper kreuzreaktiv, erkennen also sowohl die LOS als auch die Gangliosid-Komplexe. Bei GBS aber auch Antikörper gegen andere Glykolipide und Myelinproteine nachgewiesen; Zielstruktur also noch unklar. Weiterlesen
Stefan S. Kassner et al.: Changes in Peripheral Blood Mononuclear Cells – Novel Evidence for an Immunomodulatory Aspect in Bell’s Palsy? Journal of Neurology Research, Vol. 2, No. 3, Jun 2012; doi:10.4021/jnr108w
Abstract: Früheren Studien zufolge ist bei Patienten mit Bell’s palsy (BP) die Zahl der T- und B-Lymphozyten signifikant verringert. Als mögliche Ursachen der Erkrankung gelten Vireninfektionen und Autoimmunprozesse. In dieser Studie wurden die peripheren mononukleären Blutzellen (PBMCs) von 15 BP-Patienten anhand ihrer Oberflächenmarker (CD) genauer charakterisiert: Bei den Monozyten (= Makrophagenvorläuferzellen, CD14+), Makrophagen (CD68+), T-Lymphozyten (CD3+) und B-Lymphozyten (CD19+) wurde der Anteil der Zellen sowie die Expression entzündungsfördernder (CD40+, TNF-α und COX-2), apoptosefördernder (Caspase-3, PARP), adhäsionsfördernder (CD38+) und mit oxidativem Stress verbundener (MnSOD) Proteine gemessen. Die Ergebnisse deuten auf eine Beteiligung des Immunsystems an Bell’s palsy hin.
Einleitung: Der Mangel an antikörperproduzierenden CD19+-B-Zellen bei BP-Patienten wird in der Literatur als mögliche Unrsache für den Krankheitsausbruch oder -fortgang diskutiert, weil dadurch womöglich neurotrope Viren (ihre DNA und/oder ihre Hüllen) nicht mehr effizient aus den infizierten Nerven entfernt werden können. HSV-1-DNA (Herpes simplex) wurde in der Nervenflüssigkeit und im Speichel von BP-Patienten nachgewiesen. Im Tiermodell ließ sich BP durch HSV-1-Reaktivierung im Verbund mit Immunsuppression auslösen. Weiterlesen