Das habe ich mir jedenfalls gerade anhören müssen. 🙂 Dennoch eine neue Skizze fürs Buch: die Code-Sonne, die zeigt, welches Basentriplett bei der Translation in welche Aminosäure übersetzt wird. Für zwei der 20 natürlichen Aminosäuren sind auch die Strukturformeln zu sehen. Rechts in den Strukturformeln der bei allen Aminosäuren identische Teil. Durch Verbindung der Aminogruppe (NH2) einer Aminosäure mit der Hydroxygruppe (OH) des Säurerests der nächsten Aminosäure entstehen unter Wasserabscheidung Peptide; der rechte Teil wird also zum Grundgerüst der Polypeptidkette. Links der variable Rest: die Seitenkette der Aminosäure, die mal kleiner, mal (wie hier) größer ausfällt und entweder hydrophil oder hydrophob sein kann.
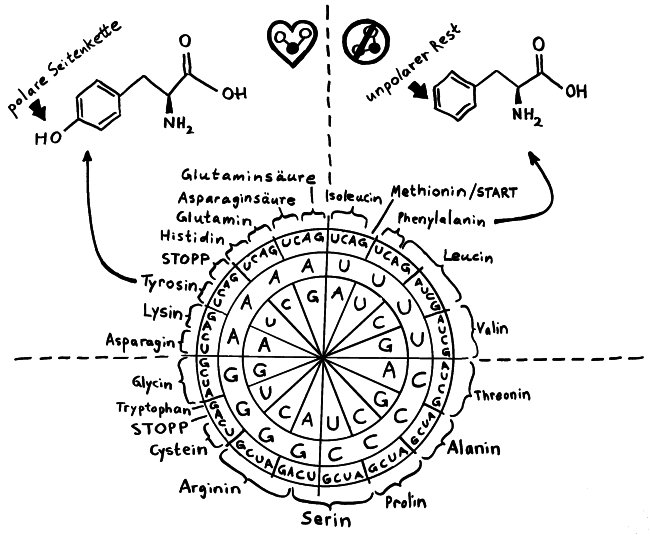 Die Dastellung ist unorthodox: Ich habe alles nach der zweiten (mittleren) Base der Tripletts sortiert und nicht nach der ersten (in der Sonne ganz innen). So erkennt man, dass immer dann, wenn die mittlere Base ein U ist, eine Aminosäure mit hydrophober/apolarer Seitenkette in das Polypeptid eingebaut wird. Wenn in der Mitte des Tripletts dagegen die komplementäre Base, das A, steht, werden überwiegend Aminosäuren mit hydrophiler/polarer Seitenkette eingebaut. Die dritte Base des Tripletts ist in vielen Fällen unbedeutend; egal, ob dort A, U, C oder G steht – in das Polypeptid wird dieselbe Aminoäsure eingebaut.
Die Dastellung ist unorthodox: Ich habe alles nach der zweiten (mittleren) Base der Tripletts sortiert und nicht nach der ersten (in der Sonne ganz innen). So erkennt man, dass immer dann, wenn die mittlere Base ein U ist, eine Aminosäure mit hydrophober/apolarer Seitenkette in das Polypeptid eingebaut wird. Wenn in der Mitte des Tripletts dagegen die komplementäre Base, das A, steht, werden überwiegend Aminosäuren mit hydrophiler/polarer Seitenkette eingebaut. Die dritte Base des Tripletts ist in vielen Fällen unbedeutend; egal, ob dort A, U, C oder G steht – in das Polypeptid wird dieselbe Aminoäsure eingebaut.
Einer (Außenseiter-)Hypothese zufolge ist die Polaritätssortierung anhand der mittleren Base kein Zufall: Wenn beide DNA-Stränge in Gegenrichtung, aber im selben Raster abgelesen werden, sodass immer dann, wenn auf einem Strang ein A in der Mitte eines Tripletts steht, auf dem Gegenstrang ein T in der Mitte steht (das dem U auf der mRNA entspricht), entstehen zwei Polypeptide, die komplementäre Verteilungen hydrophiler und hydrophober Aminosäuren aufweisen. Diese beiden Polypeptide sollen sich dann auch komplementär zusammenfalten: Hydrophile Aminosäuren landen im wässrigen innerzellulären Milieu an der Oberfläche der Proteine und bilden dort Ausstülpungen (maximale Berührungsfläche mit dem Wasser), während hydrophobe Aminosäuren sich eher vom wässrigen Zytoplasma zurückziehen und Einstülpungen bilden (minimale Wechselwirkung mit dem Wasser). Diese beiden Proteine würden dann wie Puzzlestücke aneinanderpassen. Solche Proteinpaare könnten z. B. in den Regulierungsnetzwerken des Immunsystems eine Rolle spielen und evtl. auch an Autoimmunerkrankungen beteiligt sein.
