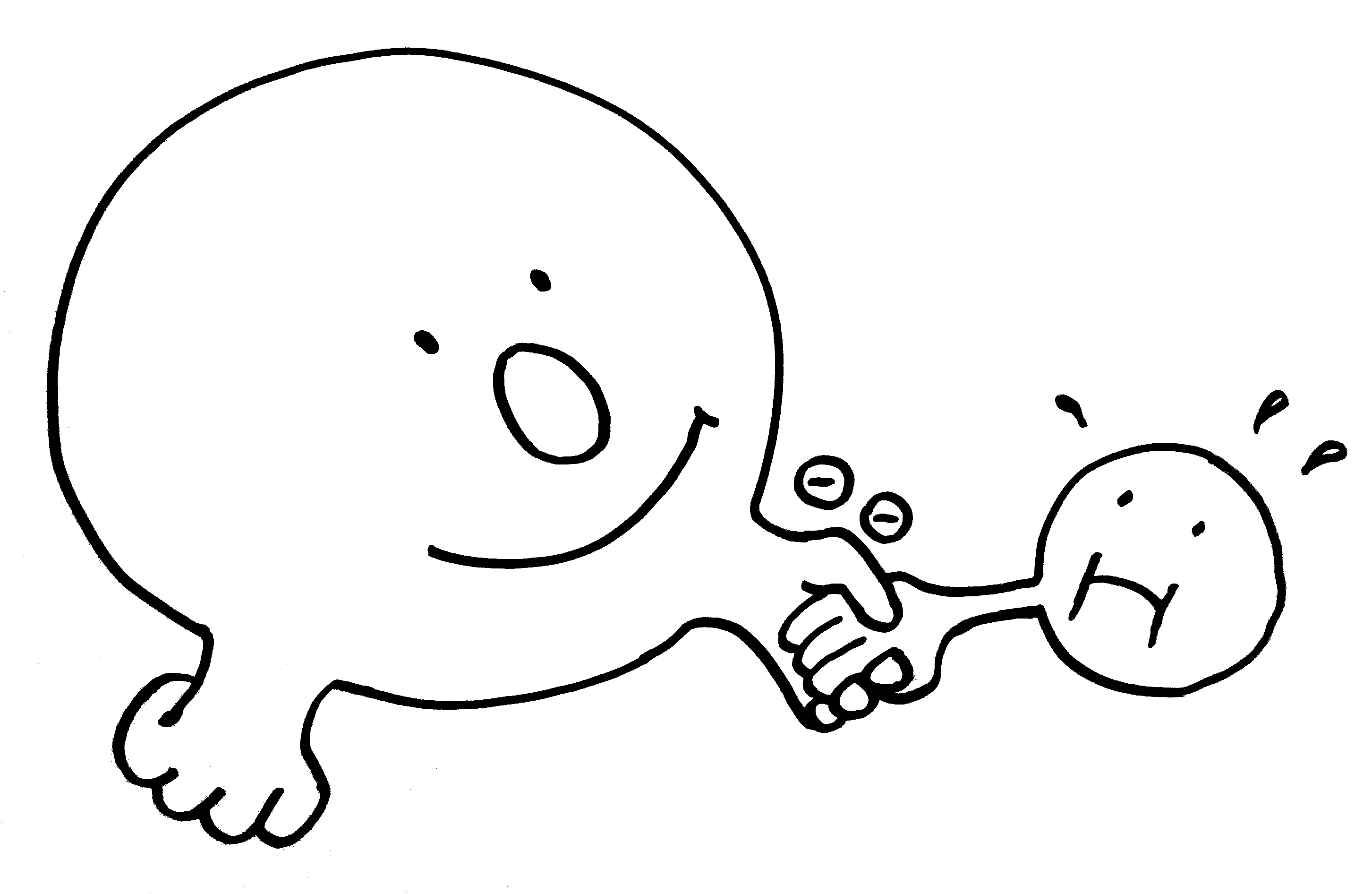
Polarität: An einer einfachen Atombindung sind stets zwei Elektronen beteiligt, eines von jedem Atom. Manche Atome wie hier links der Sauerstoff sind »elektronegativ«: Sie ziehen das bindende Elektronenpaar an und sind daher leicht negativ geladen, während ihr Bindungspartner (hier ein Wasserstoffatom) leicht positiv wird. Eine Hydroxylgruppe (OH) ist also polar. Hielte das Sauerstoffatom an seiner anderen Hand ebenfalls ein Wasserstoffatom, so hätten wir ein Wassermolekül (H2O) vor uns, das ebenfalls polar ist: Die Seite, an der die beiden Wasserstoffatome stehen, ist positiver als die Sauerstoff-Seite. Polare Moleküle sind hydrophil: Sie vertragen sich gut mit dem ebenfalls polaren Wasser; die negative Seite des einen Stoffes lagert sich an die positive des anderen an. Halten dagegen zwei Wasserstoffatome Händchen (H2), bleibt das Elektronenpaar genau in der Mitte zwischen ihnen; das Molekül ist unpolar. Auch reine Kohlenwasserstoffe sind unpolar. Solche unpolaren Stoffe stoßen Wasser ab; sie sind hydrophob. Stoffe mit einem polaren und einem unpolaren Teil, zum Beispiel Alkohole, sind gute Lösungsmittel, da sie beide Welten – die hydrophile und die hydrophobe – verbinden.
Sie dürfen diese Zeichnung gerne in Folien etc. übernehmen, sofern Sie die Quelle angeben: Dr. Andrea Kamphuis, https://autoimmunbuch.de