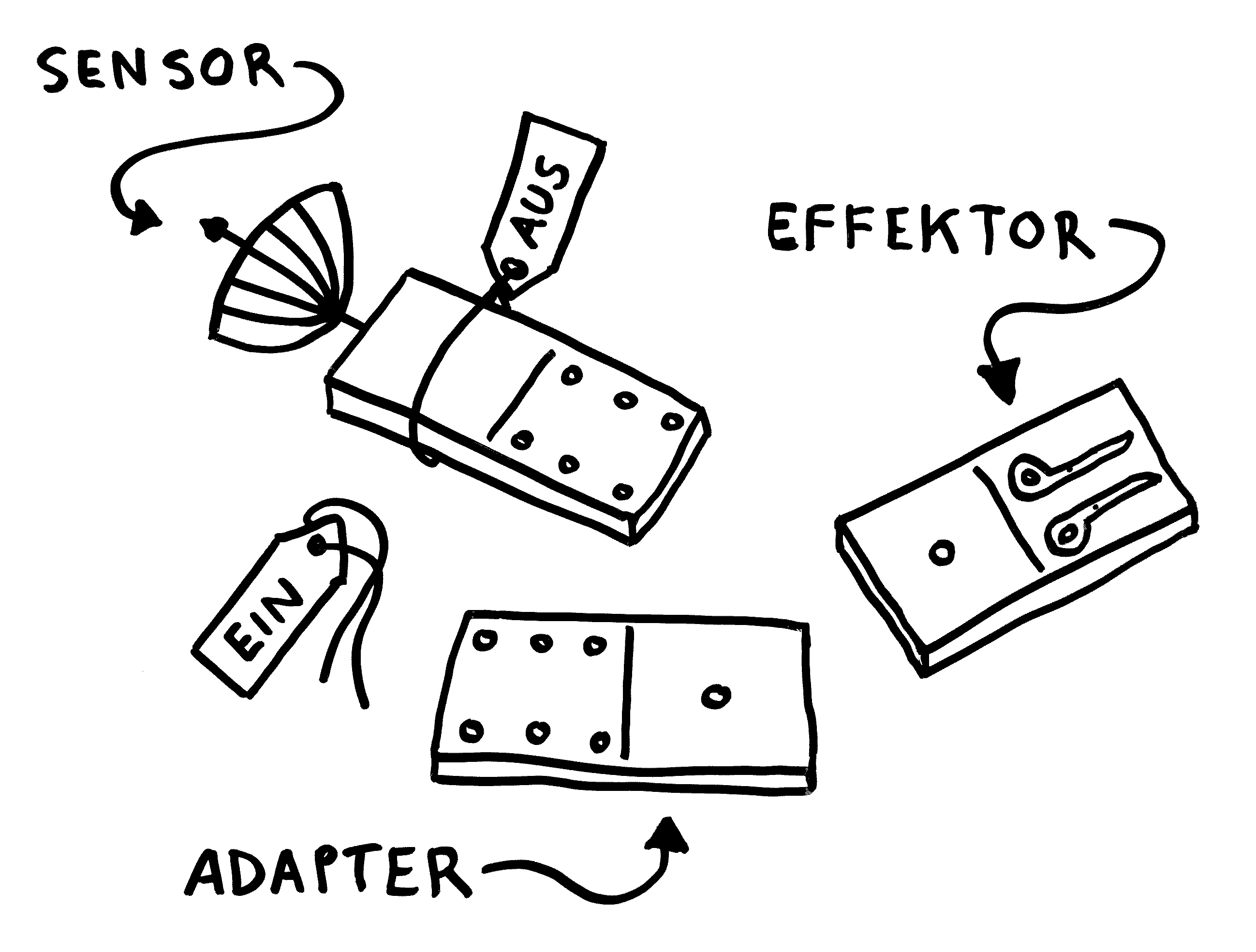
Oben: Ein NLRP3-Inflammasom besteht aus drei Baustein-Typen. Das namensgebende Protein NLRP3 enthält den Sensor, der das Inflammasom aktiviert. Das Adapterprotein ASC enthält zwei Domänen, die auch in den anderen beiden Proteinen vorkommen und sich gerne mit ihresgleichen zusammenlagern. Der Enzymvorläufer Pro-Caspase 1 schließlich ist der Effektor. Solange sie einzeln im Zytoplasma der Zelle herumliegen, sind die Bausteine inaktiv – der Sensor, weil er durch ein Protein-Anhängsel inhibiert wird, der Adapter, weil ihm zwei für die Aktivität nötige Anhängsel fehlen, und der Effektor, weil er in dieser Gestalt nicht als Enzym arbeiten kann.
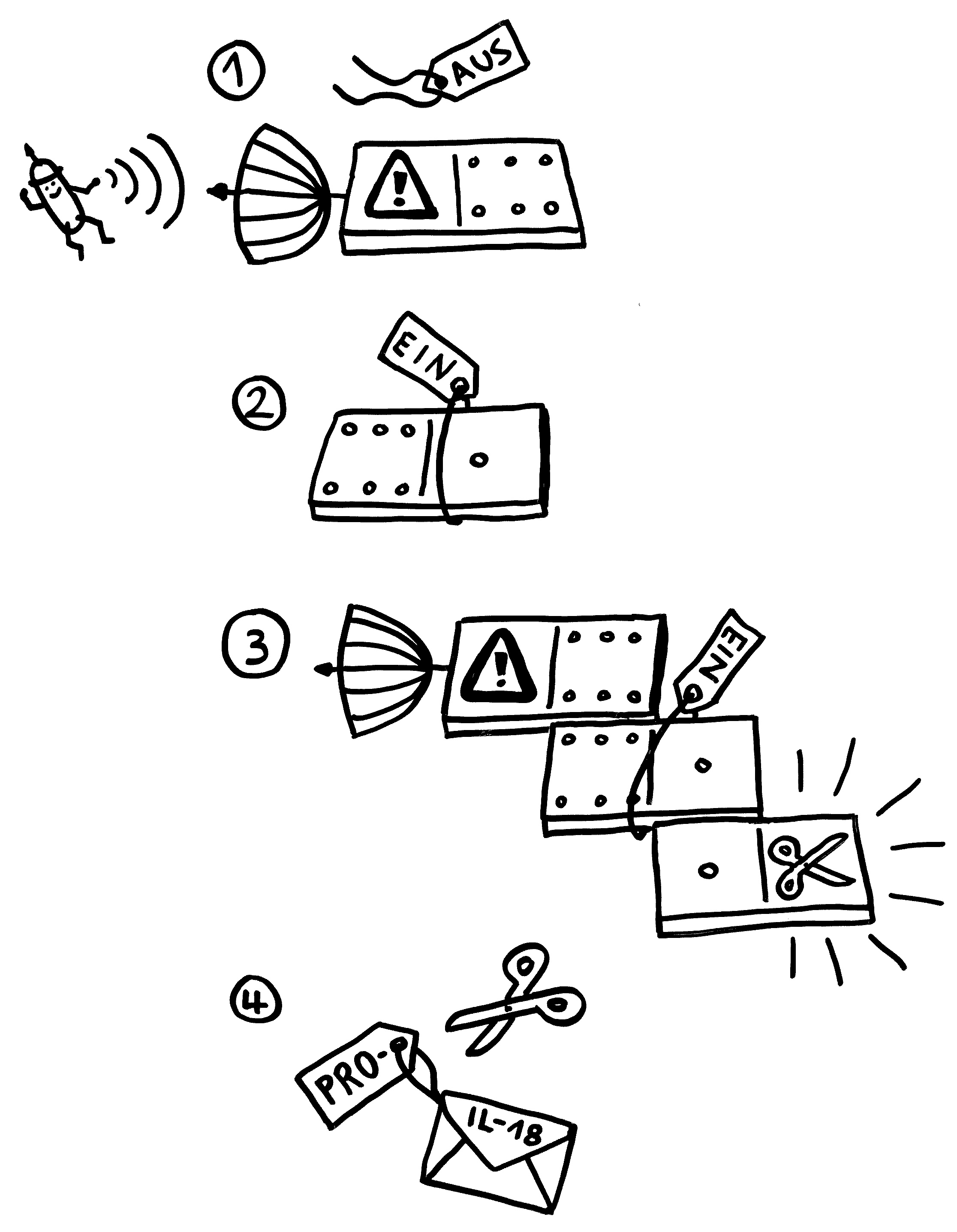
Unten: Das ändert sich, sobald der Sensor einen Reiz empfängt, etwa Alarmsignal, das für Bakterien typisch ist:
1. Der Sensor-Baustein verliert das Label, das ihn inaktiv hält.
2. Dem Adapter werden dagegen die Label angehängt, die ihn aktivieren.
3. Über die in beiden Bausteinen vorkommende PYD-Domäne lagert sich der Sensor mit dem Adapter zusammen. Diesem wiederum lagert sich über die beiden gemeinsame CARD-Domäne der Effektor an. Dadurch ändert sich die Gestalt des Effektors so, dass er seine Enzymfunktion ausüben kann: Aus Pro-Caspase 1 ist Caspase 1 geworden.
4. Dieses Enzym schneidet die Vorformen entzündungsfördernder Botenstoffe zurecht: Aus Pro-IL-18 wird IL-18, aus Pro-IL1β wird IL-1β.
Sie dürfen diese Zeichnung gerne in Folien etc. übernehmen, sofern Sie die Quelle angeben: Dr. Andrea Kamphuis, https://autoimmunbuch.de
