Im vorigen Beitrag fehlten Zeichnungen, die ich hier nachliefere:
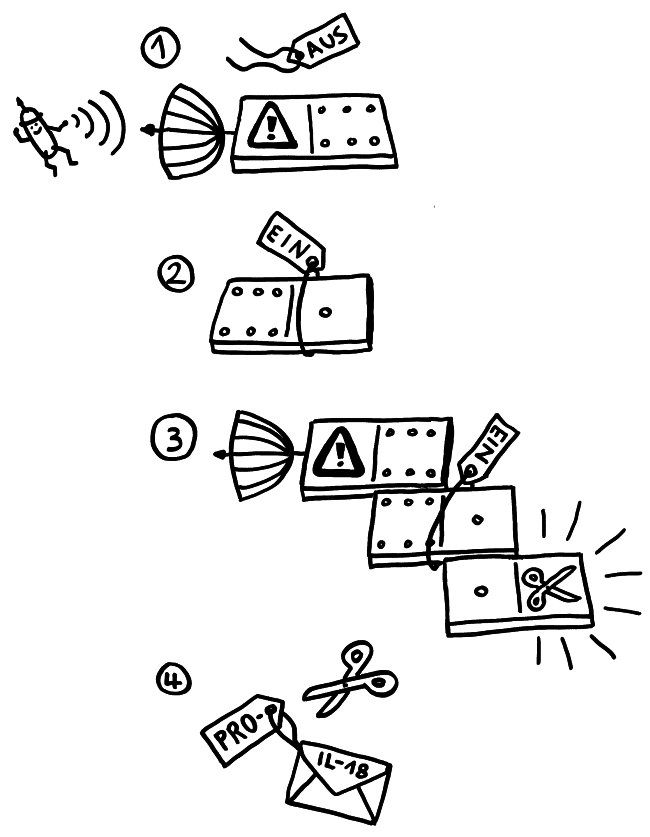
In Zellen, die per Pyroptose kontrolliert absterben, bilden sich Proteinkomplexe, die nicht nur zum Zelltod beitragen, sondern auch zur Ausschüttung entzündungsfördernder Botenstoffe führen. Der am besten untersuchte Komplex ist das NLRP3-Inflammasom. Es besteht aus drei Bausteinen: einem Sensor (eben NLRP3), einem Adapter (ASC) und einem Effektor (Pro-Caspase-1).
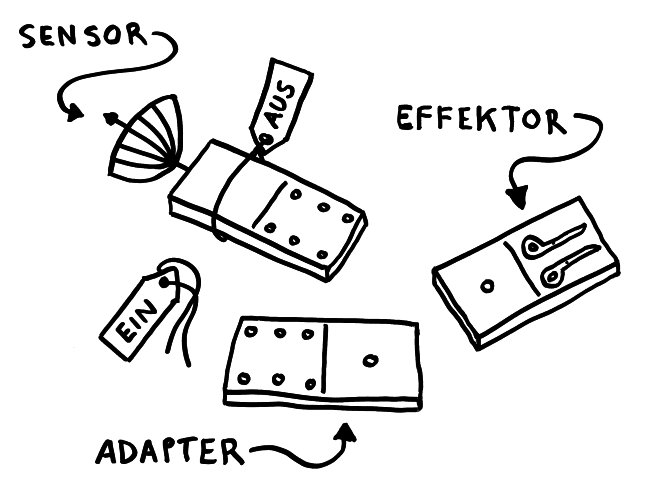 Solange sie einzeln im Zytoplasma der Zelle herumliegen, sind die Bausteine inaktiv – der Sensor, weil er durch ein Protein-Anhängsel inhibiert wird, der Adapter, weil ihm zwei für die Aktivität nötige Anhängsel fehlen, und der Effektor, weil er in dieser Gestalt nicht als Enzym arbeiten kann. Das ändert sich, sobald der Sensor einen Reiz empfängt, etwa ein Bakterien-typisches Alarmsignal:
Solange sie einzeln im Zytoplasma der Zelle herumliegen, sind die Bausteine inaktiv – der Sensor, weil er durch ein Protein-Anhängsel inhibiert wird, der Adapter, weil ihm zwei für die Aktivität nötige Anhängsel fehlen, und der Effektor, weil er in dieser Gestalt nicht als Enzym arbeiten kann. Das ändert sich, sobald der Sensor einen Reiz empfängt, etwa ein Bakterien-typisches Alarmsignal:
1. Der Sensor-Baustein verliert das Label, das ihn inaktiv hält. 2. Dem Adapter werden dagegen die Label angehängt, die ihn aktivieren. 3. Über die in beiden Bausteinen vorkommende PYD-Domäne lagert sich der Sensor mit dem Adapter zusammen. Diesem wiederum lagert sich über die beiden gemeinsame CARD-Domäne der Effektor an. Dadurch ändert sich die Gestalt des Effektors so, dass er seine Enzymfunktion ausüben kann: Aus Pro-Caspase-1 ist Caspase-1 geworden. 4. Dieses Enzym schneidet die Vorformen der entzündungsfördernden Botenstoffe zurecht: Aus Pro-IL-18 wird IL-18, aus Pro-IL1β wird IL-1β.
3D-Domino mit veränderten Anlegeregeln
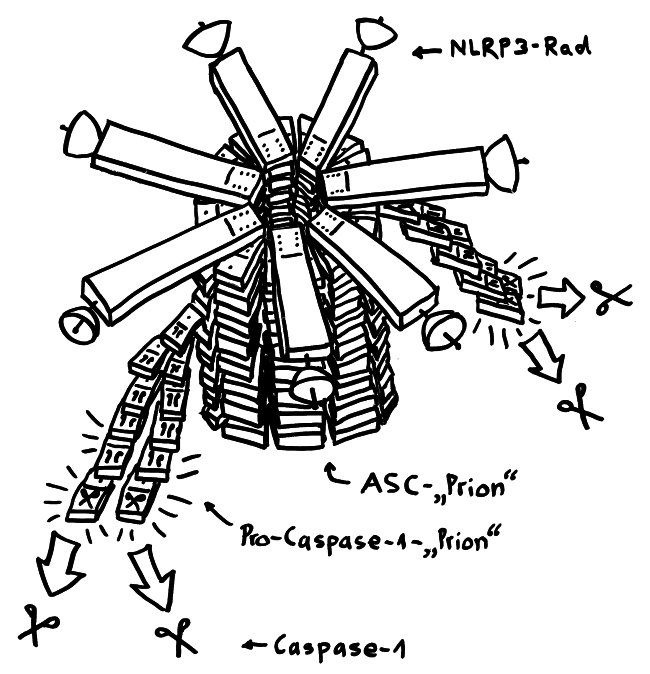
Tatsächlich sind NLRP3-Inflammasomen aber komplizierter aufgebaut als drei zusammengelegte Dominosteine: Jeder Baustein kommt mehrfach vor. Ich folge hier der Darstellung von H. Guo et al. (2015):
Demnach lagern sich mehrere NLRP3-, also Sensor-Einheiten wie die Speichen eines Rads zusammen, sodass ihre PYD-Domänen sich berühren.
Dann docken zahlreiche ASC-, also Adapter-Einheiten mit ihren PYD-Domänen erst an die Innenseite des Rads und dann an ihre Nachbarn an, sodass sie eine Art Radachse bilden: einen länglichen Proteinkristall, den Guo et al. als „Prionen-artig“ bezeichnen.
Schließlich docken zahlreiche Pro-Caspase-1-, also Effektor-Einheiten zunächst an diese Achse und dann aneinander an. Sie bilden wiederum Prionen-artige, fädige Proteinkristalle, die seitlich von der Achse wegwachsen. Durch die enge Nachbarschaft zu ihresgleichen formen sie sich ein wenig um, sodass ihre Enzymfunktion aktiviert wird. Voilà: Caspase-1.