Winter SE, Bäumler AJ. Why related bacterial species bloom simultaneously in the gut: principles underlying the ‚Like will to like‘ concept. Cellular Microbiology 2014, 16(2). 179-184
Im gesunden Dickdarm dominieren obligate anaerobe Bakterien aus den Stämmen Bacteroidetes (Klasse Bacteroidia) und Firmicutes (Klasse Clostridia); Arten aus den Stämmen Proteobacteria und Actinobacteria sind meist selten. Homöostase -> idealer Nährstoffaufschluss und Infektionsresistenz. Dysbiose: Clostridien gehen zurück, fakultative anaerobe Proteobacteria breiten sich aus.
Aber wie wird das Gleichgewicht aufrecht erhalten, bzw. wie kommt es zur Dysbiose? Und wieso werden dabei ganze Stämme regelrecht ausgetauscht, statt dass nur einzelne arten häufiger bzw. seltener werden? Lozupone et al. (2012) haben das mit Rasenpflege verglichen: Bei schweren Zwischenfällen wird die nackte Erde freigelegt, und statt Gras können sich Unkräuter ausbreiten. Aber diese Metapher sagt noch nichts über die Mechanismen.
Beobachtung bei Mäusen: Tiere, die viele Kommensalen der Art Escherichia coli beherbergen, sind besonders anfällig für Infektionen mit Salmonella enterica und Campylobacter jejeuni, die zum selben Stamm (Proteobacteria) gehören. -> Similis-simili-gaudet-Hypothese. Vielleicht lokale Umweltbedingung, die alle Arten eines Stammes fördert?
Normale Labormäuse gehören zu einem von zwei Enterotypen: entweder hohe Diversität der Darmflora und Dominanz von Clostridien und Bacteroidia – oder geringere Diversität, weniger Clostridien und (relativ) mehr Proteobacteria, oft verbunden mit schwacher Entzündung. Bei Menschen ist die Existenz bzw. Omnipräsenz und Bedeutung von Enterotypen allerdings noch umstritten.
Mausmodelle für Colitis: Entzündungsreaktion auf chemischen Trigger oder genetische Disposition erhöht Häufigkeit fakultativer Anaerobier, v. a. aus der Familie Enterobaceriaceae (Stamm Proteobacteria). Auch bei Infektion mit dem Einzeller Toxoplasma gondii breiten sich Enterobaceriaceae in der Darmflora unkontrolliert aus. Einige pathogene Enterobacteriae lösen mit Virulenzfaktoren ihrerseits Entzündung aus, um sich gegenüber anderen Bakterien einen Wachstumsvorteil zu verschaffen.
Menschen: Bei Morbus Crohn, Antibiotika-Behandlung, HIV-Enteropathie (chronische Diarrhö) und anderen Erkrankungen des Dickdarms ebenfalls Proteobacteria-Blüte im Verbund mit Clostridien-Rückgang. Aber sind es dieselben Selektionskräfte, die die Proteobacteria fördern und den Clostridien zu schaffen machen? Wahrscheinlich nicht.
Proteobacteria profitieren von einem Mechanismus, bei dem reaktive Sauerstoff- und Stickstoff-Species entstehen. Diese antimikrobiellen Substanzen diffundieren vom Epithel weg ins Lumen und wandeln sich dabei in Elektronenakzeptoren wie Tetrathionat oder Nitrat um. Pathogene S. enterica und kommensale E. coli können diese Elektronenakzeptoren für ihre anaerobe Respiration und damit für ein starkes Wachstum im Dickdarm nutzen.
Fitnessvorteil für Proteobacteria: Die fakulativen Anaerobier können durch die anaerobe Respiration nichtfermentierbare Substrate oder Fermentationsendprodukte als Kohlenstoffquellen nutzen und vermeiden so die Konkurrenz um fermentierbare Nährstoffe, auf die die obligaten Anaeroben (Bacteroidias und Clostridia) angewiesen sind.
Rückgang der Clostridien: wahrscheinlich durch eine andere, noch unbekannte Selektionskraft, denn Clostridien haben keine terminalen Oxidoreduktasen und können daher auf die Elektronenakzeptoren, die bei der Entzündung entstehen, nichts reagieren. Es muss ein Faktor sein, der nicht auf alle Clostridien nachteilig wirkt: Clostridium difficile und einige andere Arten aus der Familie der Lachnospiraceae vermehren sich nämlich bei Darmentzündungen, statt zu verschwinden.
Clostridien produzieren bei der Fermentation kurzkettige Fettsäuren, die entzündungshemmend auf das Immunsystem einwirken, indem sie die Rezeptoren regulatorischer T-Zellen (Tregs) stimulieren. Daher kann es sein, dass ein Rückgang der Clostridien (zum Beispiel durch Antibiotika) der erste Schritt zur Dysbiose ist: Wenn sie fehlen, wird eine einmal gestartete Entzündung nicht rechtzeitig gestoppt, und die Entzündungsprodukte fördern dann die Proteobacteria.
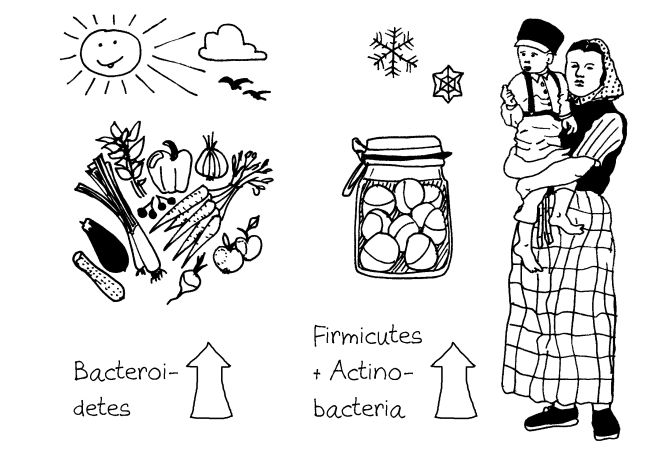 Die Autoren haben die Darmflora von 60 Mitgliedern mehrerer Hutterer-Gemeinschaften in den USA analysiert. Die Hutterer essen überwiegend selbst angebaute bzw. konservierte Lebensmittel, die gemeinschaftlich zubereitet werden. Die nach wie vor umstritteten drei Enterotypen*, in die die Menschheit zerfallen soll, fanden Emily Davenport und ihre Mitarbeiter nicht. Stattdessen variiert die Zusammensetzung des Mikrobioms mit den Jahreszeiten: Im Sommer, wenn die Menschen viel Frisches essen, sind Bacteroidetes signifikant stärker vertreten als im Winter, wenn viel Eingemachtes auf den Tisch kommt. Im Winter nehmen dafür die Firmicutes und die Actinobacteria zu.
Die Autoren haben die Darmflora von 60 Mitgliedern mehrerer Hutterer-Gemeinschaften in den USA analysiert. Die Hutterer essen überwiegend selbst angebaute bzw. konservierte Lebensmittel, die gemeinschaftlich zubereitet werden. Die nach wie vor umstritteten drei Enterotypen*, in die die Menschheit zerfallen soll, fanden Emily Davenport und ihre Mitarbeiter nicht. Stattdessen variiert die Zusammensetzung des Mikrobioms mit den Jahreszeiten: Im Sommer, wenn die Menschen viel Frisches essen, sind Bacteroidetes signifikant stärker vertreten als im Winter, wenn viel Eingemachtes auf den Tisch kommt. Im Winter nehmen dafür die Firmicutes und die Actinobacteria zu.