Ich habe meine Fazialislähmung zum Anlass genommen, für das Buch zu skizzieren, wie eine Immunneuropathie abläuft. Zu den Immunneuropathien zählen Autoimmunerkrankungen wie Multiple Sklerose, das Guillain-Barré-Syndrom, chronisch inflammatorische demyelinisierende Polyneuropathie (CIDP) oder vaskulitische Neuropathie. Bei einigen ist das periphere, bei anderen das zentrale Nervensystem betroffen. Oft beschränkt sich die Störung (wie bei der Fazialislähmung) auf einen einzelnen Nerv.
Am Anfang steht vermutlich immer die Reaktivierung eines latenten Virus (z. B. Herpes) oder eine oftmals unbemerkte, da symptomfreie (sogenannte stumme oder maskierte) Infektion, hier durch ein maskiertes Bakterium dargestellt. Eine in der Blutbahn oder im Gewebe patrouillierende Immunzelle – hier eine dendritische Zelle (DC) – entdeckt den Eindringling:
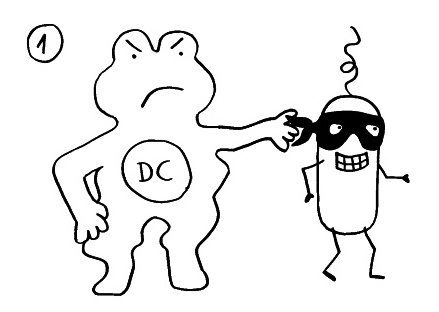 Die dendritische Zelle nimmt Teile des Erregers auf und verarbeitet sie zu einem präsentablen Antigen weiter. Sie verwandelt sich in eine antigenpräsentierende Zelle (APC), die einer T-Helferzelle das Antigen auf ihrem MHC-Klasse-II-Rezeptor (hier: Tablett) präsentiert. Damit es nicht zu Fehlalarmen kommt, gibt es einen Sicherheitsmechanismus: T-Helferzellen reagieren nur dann auf ein Antigen, wenn ihnen gleichzeitig auf einem anderen Rezeptor ein sogenanntes kostimulierendes Signal präsentiert wird, das anzeigt, dass wirklich eine Infektion oder eine andere Gefahr vorliegt, die bekämpft werden muss (hier: Kerze). Auf der Oberfläche der T-Zelle gibt es für beide Signale spezifische Rezeptoren (hier: Augen/Blickkontakt):
Die dendritische Zelle nimmt Teile des Erregers auf und verarbeitet sie zu einem präsentablen Antigen weiter. Sie verwandelt sich in eine antigenpräsentierende Zelle (APC), die einer T-Helferzelle das Antigen auf ihrem MHC-Klasse-II-Rezeptor (hier: Tablett) präsentiert. Damit es nicht zu Fehlalarmen kommt, gibt es einen Sicherheitsmechanismus: T-Helferzellen reagieren nur dann auf ein Antigen, wenn ihnen gleichzeitig auf einem anderen Rezeptor ein sogenanntes kostimulierendes Signal präsentiert wird, das anzeigt, dass wirklich eine Infektion oder eine andere Gefahr vorliegt, die bekämpft werden muss (hier: Kerze). Auf der Oberfläche der T-Zelle gibt es für beide Signale spezifische Rezeptoren (hier: Augen/Blickkontakt):
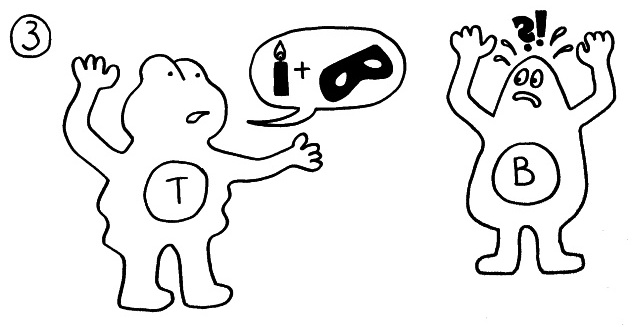
 Die T-Helferzellen reichen die Information über das Vorliegen eines Gefahr (Kerze) und über die genaue Art der Gefahrenquelle, also das Antigen (Augenbinde des Bakteriums), über Rezeptoren und Signalstoffe (Sprechblase) an B-Zellen weiter und regen diese so zur Produktion spezifischer Antikörper an:
Die T-Helferzellen reichen die Information über das Vorliegen eines Gefahr (Kerze) und über die genaue Art der Gefahrenquelle, also das Antigen (Augenbinde des Bakteriums), über Rezeptoren und Signalstoffe (Sprechblase) an B-Zellen weiter und regen diese so zur Produktion spezifischer Antikörper an:
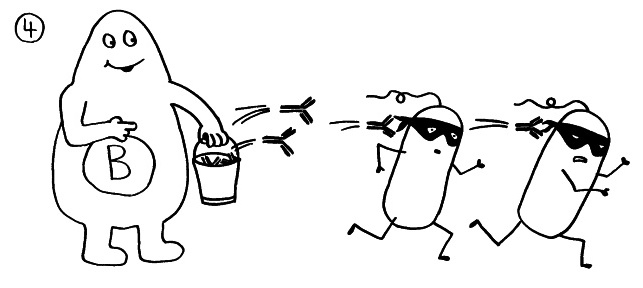
 Die B-Zellen schütten massenhaft Antikörper aus (Eimer), die spezifisch an „ihr“ Antigen binden und die Gefahrenquellen so zum Teil direkt schachmatt setzen, zum Teil zur anschließenden Zerstörung und Entsorgung markieren:
Die B-Zellen schütten massenhaft Antikörper aus (Eimer), die spezifisch an „ihr“ Antigen binden und die Gefahrenquellen so zum Teil direkt schachmatt setzen, zum Teil zur anschließenden Zerstörung und Entsorgung markieren:
 Diese normale Immunreaktion spielt sich in der Blutbahn, im Lymphgewebe und lokal im infizierten Gewebe ab. Aber manchmal läuft etwas schief: Aktivierte T-Zellen können die Blut-Nerven-Schranke durchdringen und von der Blutbahn (im nächsten Bild links) in einen Nerv (rechts) überwechseln. Das sollte eigentlich nicht passieren, da Nerven zu den sogenannten immunprivilegierten Orten im Körper gehören: Da Entzündungsreaktionen hier viel Schaden anrichten können, sind diese Orte für die meisten Immunzellen tabu.
Diese normale Immunreaktion spielt sich in der Blutbahn, im Lymphgewebe und lokal im infizierten Gewebe ab. Aber manchmal läuft etwas schief: Aktivierte T-Zellen können die Blut-Nerven-Schranke durchdringen und von der Blutbahn (im nächsten Bild links) in einen Nerv (rechts) überwechseln. Das sollte eigentlich nicht passieren, da Nerven zu den sogenannten immunprivilegierten Orten im Körper gehören: Da Entzündungsreaktionen hier viel Schaden anrichten können, sind diese Orte für die meisten Immunzellen tabu.
Manchmal ist das Endothel, also die Auskleidung der Blutbahn, aber undicht. Und wenn das Antigen, auf das die T-Zellen reagieren, dummerweise einem Bestandtzeil der eigenen Nerven ähnelt (molekulare Mimikry), werden die T-Zellen im Nerv reaktiviert, weil sie hier ständig auf das vermeintliche Gefahrensignal treffen. Oft reagieren die T-Zellen fälschlich auf chemische Bestandteile der Myelinscheiden (hier: schwarze Rechtecke):
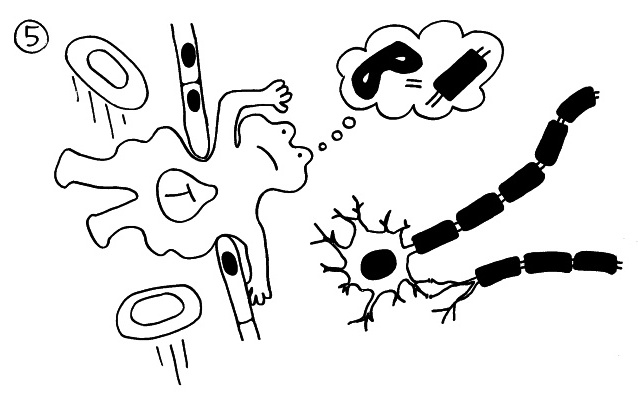 Myelinscheiden sind fettreiche Membranen der sogenannten Schwann-Zellen, die um die Axone gewickelt sind und eine Isolationsschicht bilden. Sie sind für die Weiterleitung von Nervenimpulsen notwendig. Hier sieht man links einen Längsschnitt durch ein Axon und seine Myelinscheide (und links davon den Körper und den Kern der Nervenzelle) und rechts einen Querschnitt durch das Axon. Die Zellkerne der Schwann-Zellen befinden sich in der äußeren Windung der Myelinscheiden:
Myelinscheiden sind fettreiche Membranen der sogenannten Schwann-Zellen, die um die Axone gewickelt sind und eine Isolationsschicht bilden. Sie sind für die Weiterleitung von Nervenimpulsen notwendig. Hier sieht man links einen Längsschnitt durch ein Axon und seine Myelinscheide (und links davon den Körper und den Kern der Nervenzelle) und rechts einen Querschnitt durch das Axon. Die Zellkerne der Schwann-Zellen befinden sich in der äußeren Windung der Myelinscheiden:
 Die reaktivierten, nun leider autoreaktiven T-Zellen stiften andere im Nervengewebe vorhandene oder ebenfalls von außen zugewanderte Immunzellen zu Angriffen auf die Myelinscheiden an. Hier ist rechts ein Makrophage (MΦ) dargestellt. Diese Fresszellen gehören zur zellulären Immunabwehr, dem zweiten Arm des Immunsystems neben der humoralen Abwehr durch B-Zellen und ihre Antikörper. Sie können Fremdkörper oder erkrankte Zellen verschlingen und durch Verdauungssäfte in ihren Vesikeln (den Bläschen im Zellinneren) unschädlich machen:
Die reaktivierten, nun leider autoreaktiven T-Zellen stiften andere im Nervengewebe vorhandene oder ebenfalls von außen zugewanderte Immunzellen zu Angriffen auf die Myelinscheiden an. Hier ist rechts ein Makrophage (MΦ) dargestellt. Diese Fresszellen gehören zur zellulären Immunabwehr, dem zweiten Arm des Immunsystems neben der humoralen Abwehr durch B-Zellen und ihre Antikörper. Sie können Fremdkörper oder erkrankte Zellen verschlingen und durch Verdauungssäfte in ihren Vesikeln (den Bläschen im Zellinneren) unschädlich machen:
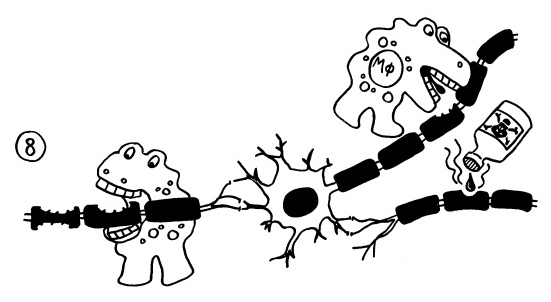
 Die aktivierten Makrophagen attackieren die Myelinscheiden und legen so die Axone der Nervenzellen bloß. Auch chemische Substanzen wie Stickstoffmonoxid oder reaktive Sauerstoffspecies („Sauerstoffradikale“), die von verschiedenen aktivierten Immunzellen ausgeschieden werden, können die Myelinscheiden zerstören. Etwa drei Tage nach Beginn einer solchen Attacke ist der Abbau der Isolationsschicht so weit vorangeschritten, dass Nervenimpulse nicht mehr korrekt weitergeleitet werden und man beispielsweise eine Lähmung bemerkt:
Die aktivierten Makrophagen attackieren die Myelinscheiden und legen so die Axone der Nervenzellen bloß. Auch chemische Substanzen wie Stickstoffmonoxid oder reaktive Sauerstoffspecies („Sauerstoffradikale“), die von verschiedenen aktivierten Immunzellen ausgeschieden werden, können die Myelinscheiden zerstören. Etwa drei Tage nach Beginn einer solchen Attacke ist der Abbau der Isolationsschicht so weit vorangeschritten, dass Nervenimpulse nicht mehr korrekt weitergeleitet werden und man beispielsweise eine Lähmung bemerkt:
 An einigen Immunneuropathien sind offenbar auch B-Zellen beteiligt. In diesen Fällen geben die autoreaktiven T-Zellen ihre Falschinformation über die Gefahr (Sprechblase) an diejenigen B-Zellen weiter, die auf genau dieses Autoantigen reagieren und dann Antikörper dagegen herstellen:
An einigen Immunneuropathien sind offenbar auch B-Zellen beteiligt. In diesen Fällen geben die autoreaktiven T-Zellen ihre Falschinformation über die Gefahr (Sprechblase) an diejenigen B-Zellen weiter, die auf genau dieses Autoantigen reagieren und dann Antikörper dagegen herstellen:
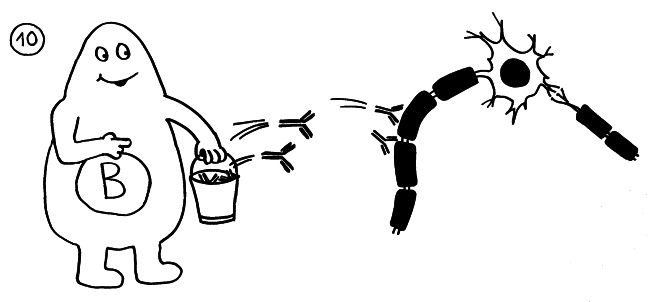
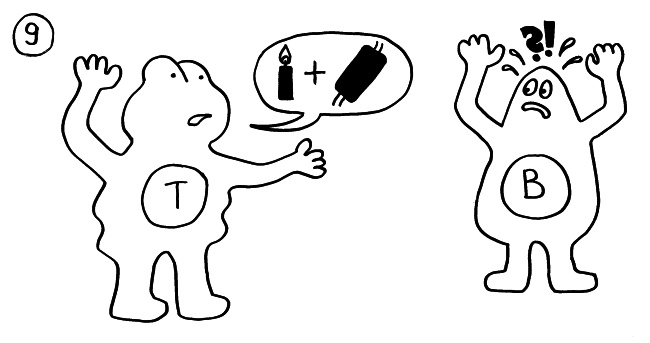 Dann attackieren Autoantikörper die Myelinscheiden und markieren sie so für den Abbau:
Dann attackieren Autoantikörper die Myelinscheiden und markieren sie so für den Abbau:
 Wird eine Autoimmunattacke auf die Myelinscheiden eines Nervs rechtzeitig gestoppt (entweder durch Medikamente oder durch die Selbstregulation des Immunsystems), so können die überlebenden Schwann-Zellen die Myelinscheiden anschließend wieder aufbauen. Das dauert erheblich länger als der Abbau, aber irgendwann sind die Nervenzellen wieder imstande, Nervenimpulse weiterzuleiten.
Wird eine Autoimmunattacke auf die Myelinscheiden eines Nervs rechtzeitig gestoppt (entweder durch Medikamente oder durch die Selbstregulation des Immunsystems), so können die überlebenden Schwann-Zellen die Myelinscheiden anschließend wieder aufbauen. Das dauert erheblich länger als der Abbau, aber irgendwann sind die Nervenzellen wieder imstande, Nervenimpulse weiterzuleiten.
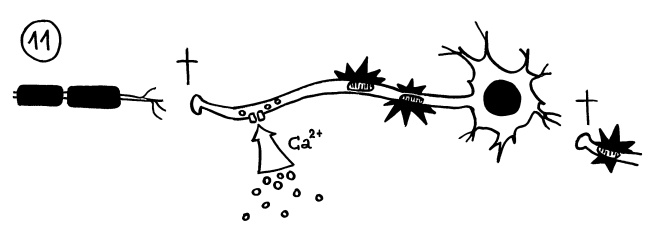
Schlimmer sieht es aus, wenn auch die bloßgelegten Axone geschädigt werden. Das passiert, wenn Ionenkanäle in ihren Membranen durch die Immunreaktion ihre Schleusen öffnen und zum Beispiel massenhaft Kalziumionen ins Nerveninnere eindringen (Bildmitte unten). Auch die Mitochondrien in den Axonen (Organelle, die für die Energieversorgung zuständig sind) können anschwellen und funktionieren dann nicht mehr richtig (hier: schwarze Sterne). Dann sterben die Enden der Axone ab, sodass der Kontakt zu den anderen Nervenzellen abbricht (hier: Kreuze):
 Außerdem können in den Nerven – genau wie in anderen Organen, die von Autoimmunstörungen betroffen sind – sogenannte Lymphfollikel entstehen. Im Inneren dieser Strukturen, den Keimzentren, durchlaufen die autoreaktiven B-Zellen eine rasante Mini-Evolution und Massenvermehrung: Aus frühen B-Zellen, die nur schwach auf „ihr“ Autoantigen reagieren, werden im Zuge der sogenannten Affinitätsreifung durch Mutation und Selektion B-Zellen, deren Antikörper immer genauer zum Antigen passen (hier: schmächtige -> muskulöse B-Zellen). Außer antikörperproduzierenden B-Zellen, Plasmazellen genannt, entstehen bei diesem Prozess auch Gedächtniszellen, die lange überleben und dafür sorgen, dass die adaptive Immunabwehr bei der nächsten Konfrontation mit derselben Gefahrenquelle schneller in Schwung kommt (hier: Greis mit Chronik).
Außerdem können in den Nerven – genau wie in anderen Organen, die von Autoimmunstörungen betroffen sind – sogenannte Lymphfollikel entstehen. Im Inneren dieser Strukturen, den Keimzentren, durchlaufen die autoreaktiven B-Zellen eine rasante Mini-Evolution und Massenvermehrung: Aus frühen B-Zellen, die nur schwach auf „ihr“ Autoantigen reagieren, werden im Zuge der sogenannten Affinitätsreifung durch Mutation und Selektion B-Zellen, deren Antikörper immer genauer zum Antigen passen (hier: schmächtige -> muskulöse B-Zellen). Außer antikörperproduzierenden B-Zellen, Plasmazellen genannt, entstehen bei diesem Prozess auch Gedächtniszellen, die lange überleben und dafür sorgen, dass die adaptive Immunabwehr bei der nächsten Konfrontation mit derselben Gefahrenquelle schneller in Schwung kommt (hier: Greis mit Chronik).
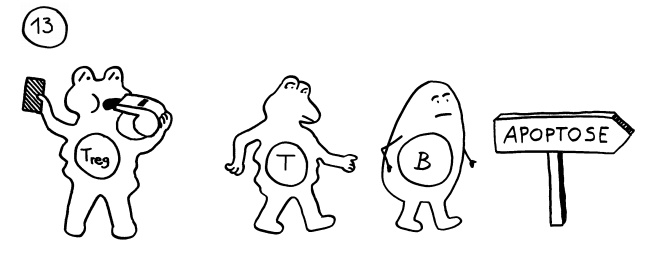
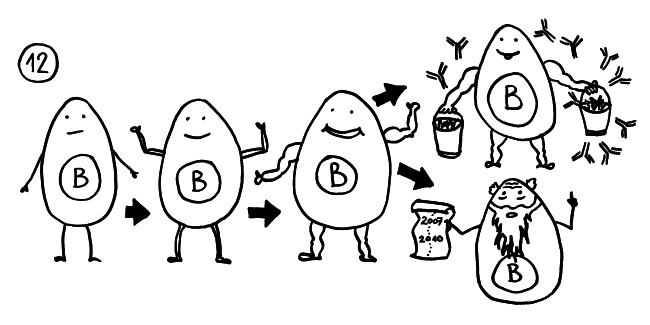 Die Affinitätsreifung und Gedächtniszellenbildung in Keimzentren, die das Immunsystem im Normalfall besonders schlagkräftig macht, kann bei Autoimmunerkrankungen zu einer Verschlimmerung und Chronifizierung führen. Das gilt insbesondere dann, wenn die Selbstregulation des Immunsystems nicht mehr richtig funktioniert – wenn es also nicht genug aktive regulatorische T-Zellen oder entzündungshemmende Botenstoffe wie IL-10 gibt. Geht dagegen alles gut, so schicken die regulatorischen T-Zellen oder Tregs die übrigen aktivierten T-Zellen und B-Zellen rechtzeitig vom Platz: Sie werden abgebaut, und die Immunreaktion ist beendet.
Die Affinitätsreifung und Gedächtniszellenbildung in Keimzentren, die das Immunsystem im Normalfall besonders schlagkräftig macht, kann bei Autoimmunerkrankungen zu einer Verschlimmerung und Chronifizierung führen. Das gilt insbesondere dann, wenn die Selbstregulation des Immunsystems nicht mehr richtig funktioniert – wenn es also nicht genug aktive regulatorische T-Zellen oder entzündungshemmende Botenstoffe wie IL-10 gibt. Geht dagegen alles gut, so schicken die regulatorischen T-Zellen oder Tregs die übrigen aktivierten T-Zellen und B-Zellen rechtzeitig vom Platz: Sie werden abgebaut, und die Immunreaktion ist beendet.

Ich spreche nicht Ihre Deutschkenntnisse
Ich liebte den Comic über CRISPR
Ich möchte in Englisch zu lesen. gibt es eine Option?
offtopic Ich bin mit google translate
Hi Pablo/Paul,
up to now there is no translation of my CRISPR comic (or any other texts in this blogs). If I find some time during the next days, I’ll work on an abridged ‚quick and dirty‘ translation.
Regards
Andrea