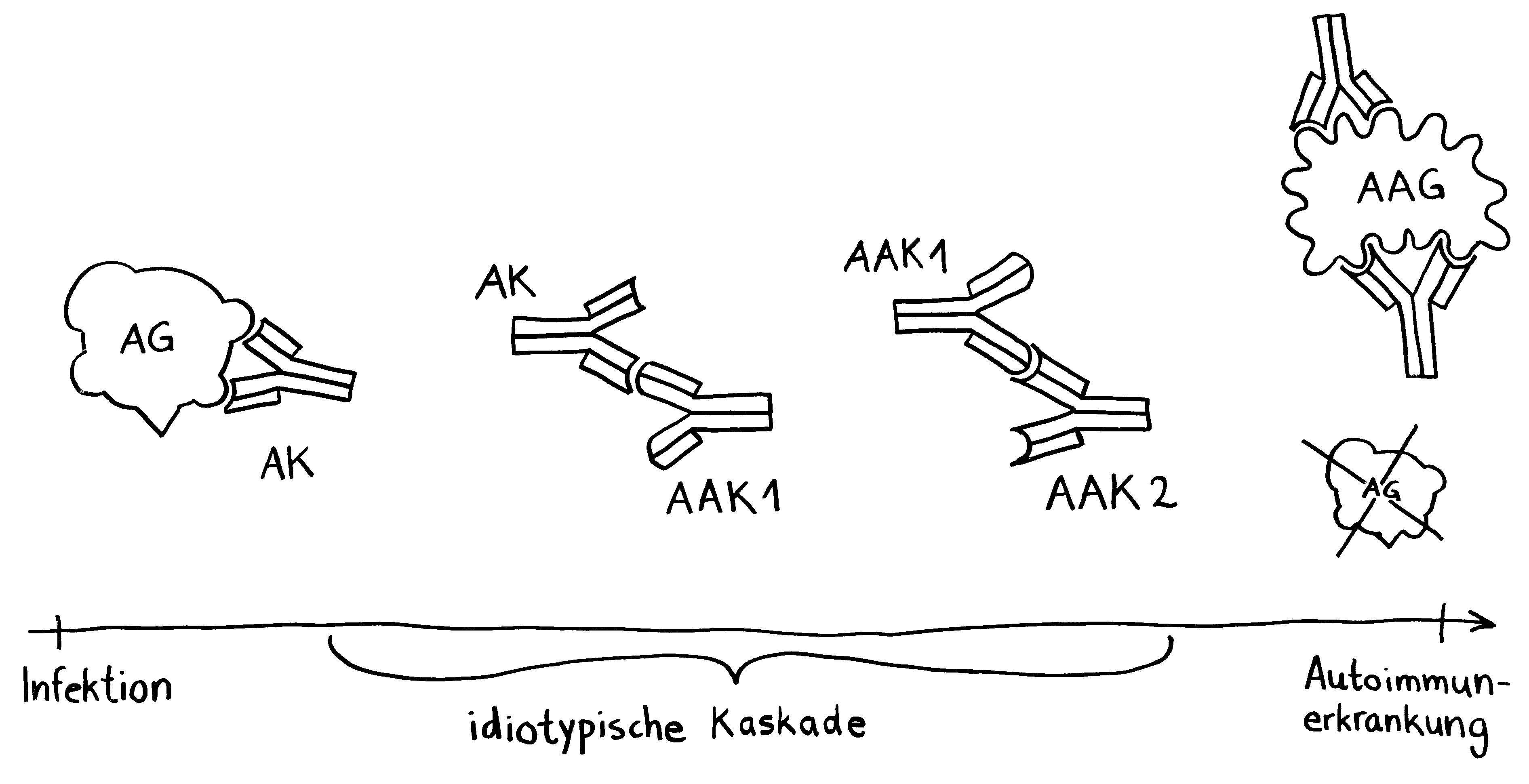
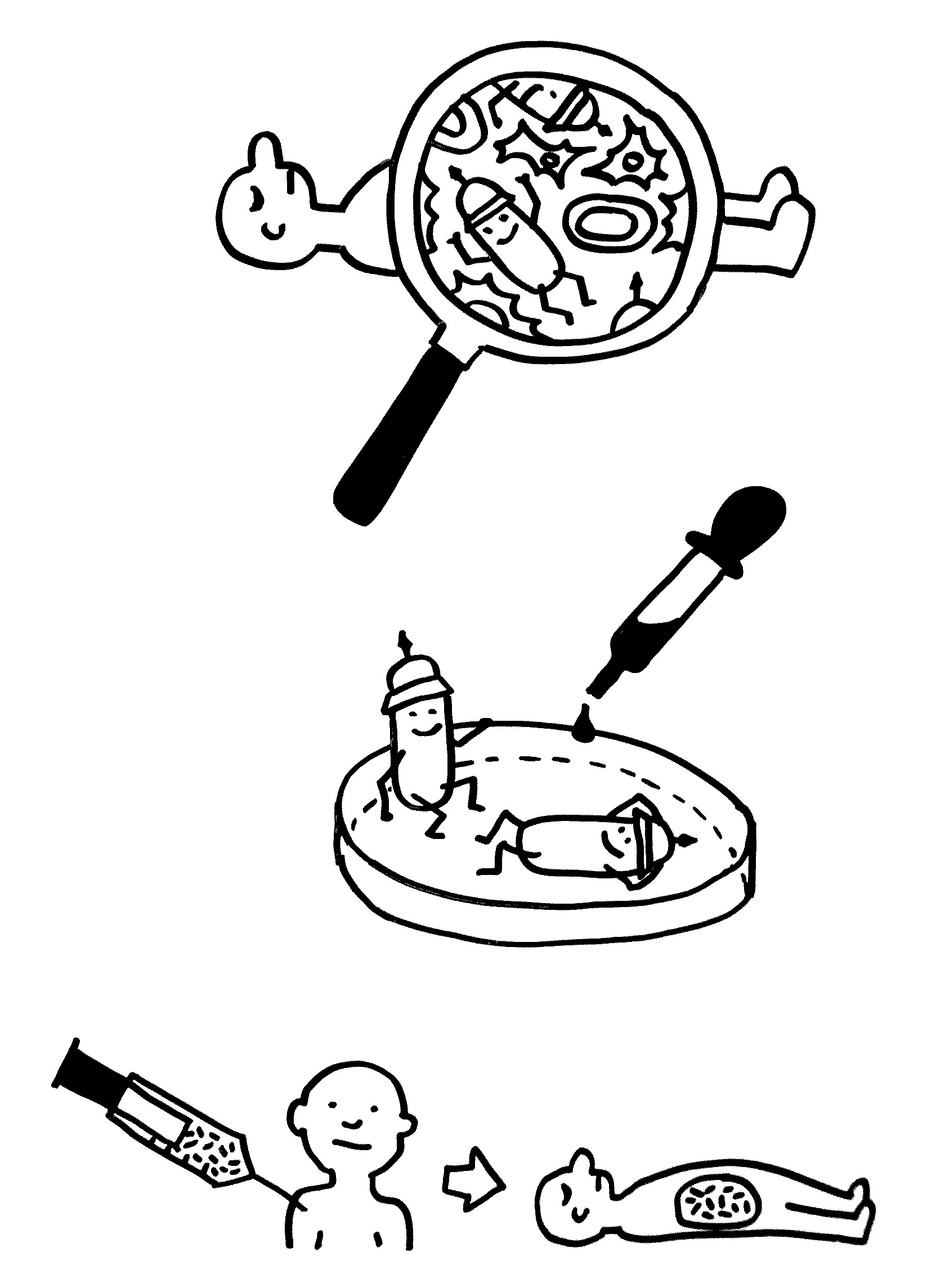
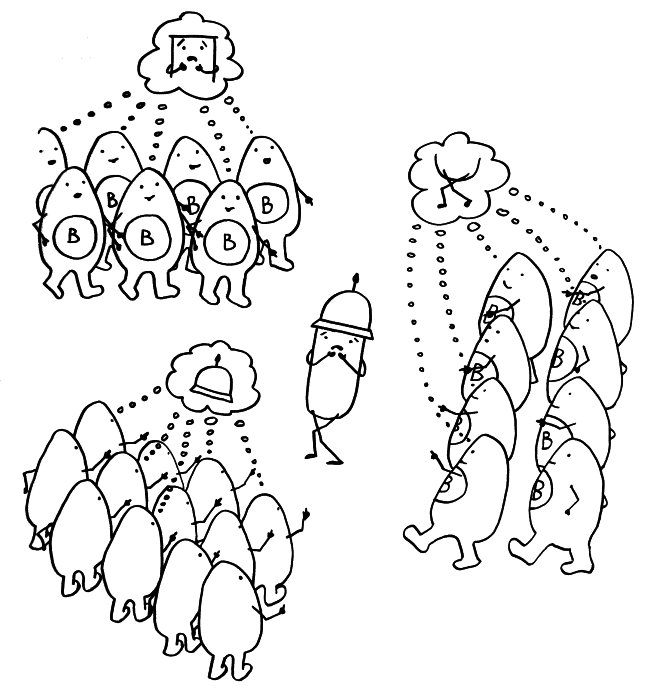
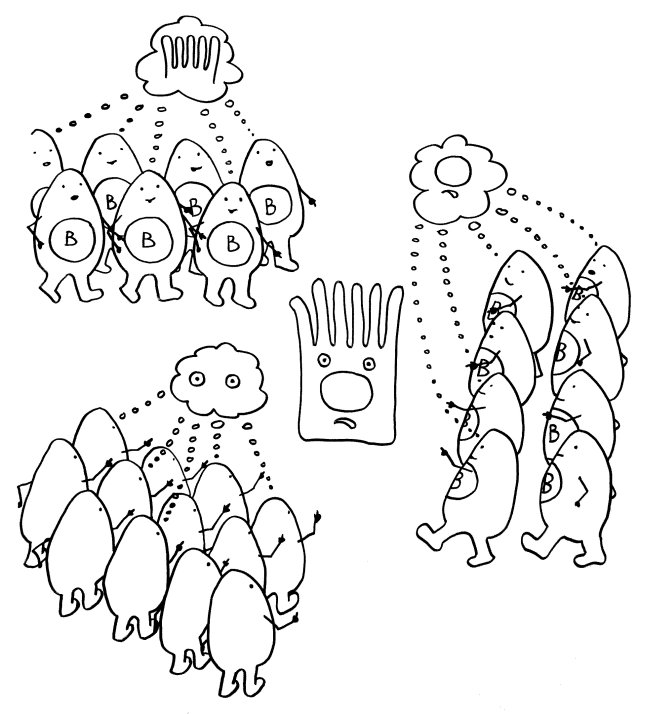
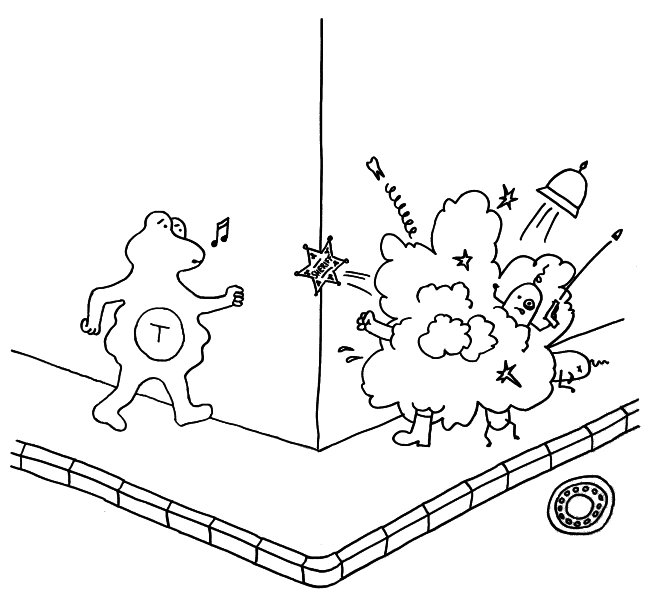
Idiotypische Dysregulation ist eine mögliche Erklärung für die lange Zeitspanne zwischen dem ersten Anlass und dem Ausbruch einer Autoimmunerkrankung: Antikörper (AK) binden an ein Antigen (AG), das zum Beispiel von einer Infektion herrührt. Sie werden ihrerseits Antigene für Autoantikörper (AAK1). Später entstehen andere Autoantikörper (AAK2), die wiederum an die Antigen-Erkennungsstellen der ersten Autoantikörper binden, und so weiter. Jede zweite Generation hat eine ähnliche Antigen-Spezifität wie die Antikörper gegen das ursprüngliche Antigen, das längst aus dem Körper verschwunden ist. Durch eine Kreuzreaktion erkennen die neuen Autoantikörper aber auch ein Autoantigen (AAG).
Sie dürfen diese Zeichnung gerne in Folien etc. übernehmen, sofern Sie die Quelle angeben: Dr. Andrea Kamphuis, https://autoimmunbuch.de