Achtung, lang – aber am Ende ist man wirklich schlauer!
Ein schwieriges Thema
Viele Menschen mit Autoimmunerkrankungen leiden unter Schmerzen, die ihre Lebensqualität erheblich mindern und schwer zu bekämpfen sind. Ich bin von starken Schmerzen in den letzten Jahren zum Glück weitgehend verschont geblieben und hatte – wohl auch deshalb – in meinem Buch kein Kapitel über die Zusammenhänge zwischen Schmerz und Autoimmunstörungen vorgesehen. Schließlich ist mein Thema ohnehin schon furchtbar vielschichtig, auch wenn man die Wechselwirkungen zwischen dem (gesunden oder entgleisten) Immunsystem und dem (intakten oder beschädigten) Nervensystem ausklammert.
Aber dann erreichte mich eine ziemlich verzweifelte Anfrage von jemandem, der gerade höllische Schmerzen durchlitt und einen Zusammenhang mit einer Autoimmunerkrankung vermutete. Zwar konnte ich ihm leider nicht helfen; ich gebe grundsätzlich keine Diagnose- oder Therapieempfehlungen ab, da das meine Kompetenzen weit überschreiten würde. Aber mein Interesse war geweckt, und ungefähr zur selben Zeit wies mich ein Freund auf eine gute neue Übersichtsarbeit zu Schmerz bei Autoimmunerkrankungen hin. Und so habe ich mich doch in dieses Feld gestürzt, viel dazu gelesen, mit der fremden Fachterminologie gekämpft und einiges gelernt.
Was ist Schmerz?
Intuitiv weiß jeder, was mit Schmerz gemeint ist, aber es hilft ungemein, sich die genaue Definition anzusehen. Die Internationale Gesellschaft zur Erforschung des Schmerzes (IASP) spricht von einem „unangenehmen, heftigen Sinnes- und Gefühlserlebnis, das mit tatsächlichen oder potenziellen Gewebeschäden einhergeht“. Schmerz ist also kein unmittelbarer Sinnesreiz, sondern das Ergebnis einer aufwändigen Signalverarbeitung in der Peripherie (also etwa am Ort der auslösenden Verletzung), im Rückenmark und im Gehirn. An dieser Signalverarbeitung beteiligen sich neben den Nervenzellen oder Neuronen auch die sogenannten Gliazellen (ein Sammelbegriff für alle Zellen im zentralen Nervensystem, die keine Neuronen sind) und, wie sich inzwischen gezeigt hat, etliche Zellen des Immunsystems.
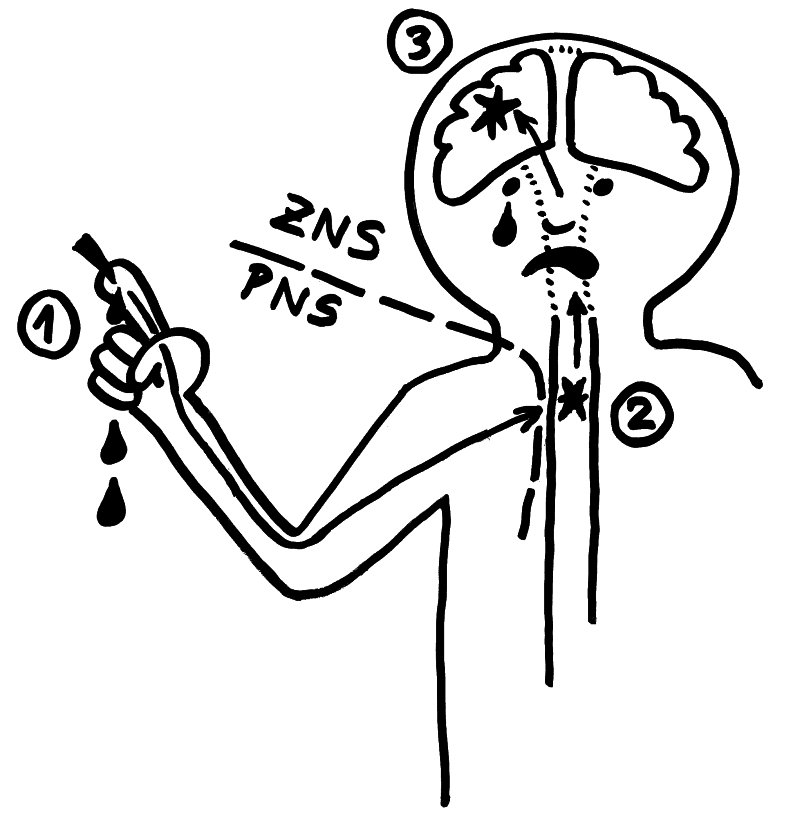
An der Schmerzentstehung sind die Nervenendigungen im peripheren Nervensystem (1), das Hinterhorn des Rückenmarks (2) und das Gehirn (3) beteiligt. Das Rückenmark zählt zum zentralen Nervensystem.
Etwas enger gefasst ist ein dem Schmerz verwandter Begriff, die Nozizeption. Noxen (vom lateinischen nocere = schaden) sind potenziell schädliche Reizauslöser physikalischer, chemischer, mikrobieller oder auch psychosozialer Natur, also etwa Hitze, ätzende Stoffe oder Krankheitserreger. Deren rein sinnesphysiologische, also ohne Beteiligung von Bewusstsein oder Gefühlen erfolgende Wahrnehmung (Perzeption) im zentralen Nervensystem (ZNS) heißt Nozizeption.
Die Alarmsignale, die im ZNS ankommen, gehen von spezialisierten freien Nervenendigungen in der Peripherie aus, also zum Beispiel in der Haut eines Fingers, in den sich gerade ein Dorn gebohrt hat. Diese für Schmerzreize empfindlichen Nervenendigungen, die Nozizeptoren, registrieren die Gewebeschädigung und senden dann elektrische Signale aus.
Wie funktionieren noch gleich Nerven?
Um das Folgende verständlich zu machen, muss ich noch schnell unser Schulwissen über Nervenzellen und ihre Funktionsweise auffrischen. Neuronen bestehen aus drei Komponenten:
- den Dendriten, also Zellfortsätzen, die an ihren Enden Reize wahrnehmen oder Signale anderer Neuronen empfangen,
- dem Zellkörper, in dem der dicke Zellkern sitzt, und
- dem Neuriten, einem Kabel, an dessen Ende das Signal auf die nächste Nervenzelle übertragen wird. In den meisten Fällen – immer dann, wenn er von speziellen Gliazellen namens Schwann-Zellen umhüllt ist – wird er Axon genannt.
Nervenzellen, die Signale aus der Peripherie in Richtung des zentralen Nervensystems leiten, heißen afferente („hineinführende“) Neuronen. Die ersten Neuronen in so einer Signalkette sind die primären afferenten Neuronen. Zu ihnen gehören alle Sinnesnervenzellen, die in der Peripherie einen Reiz wahrnehmen – darunter die Nozizeptoren. Ihnen stehen die efferenten („hinausführenden“) Neuronen gegenüber, die Befehle aus dem zentralen Nervensysteme in die Peripherie zurückschicken, also etwa „Zurückzucken!“ oder „Wundheilung starten!“. Im Folgenden geht es nur um afferente Nervenbahnen.
Die Signale oder Aktionspotenziale werden innerhalb der Neuronen elektrisch weitergeleitet. Die Details sind hier nicht wichtig; nur so viel: Die Konzentration bestimmter Ionen, also positiv oder negativ geladener Atome oder kleiner Moleküle, ist innerhalb und außerhalb der Zellmembran unterschiedlich; die Membran ist „polarisiert“. Wenn sich bestimmte Kanäle in der Membran öffnen, weil sie ein Signal empfangen haben, rauschen Ionen hindurch und verringern das Konzentrations- und Ladungsgefälle: Die Membran wird örtlich „depolarisiert“. Dadurch schließen sich die Kanäle wieder, und kleine Ionenpumpen bauen das Gefälle langsam wieder auf: Die Membran wird „repolarisiert“.
Die elektrische Signalleitung ist eine Welle kurzfristiger örtlicher Membran-Depolarisierungen, die erst den Dendriten und dann den Neuriten durchläuft, bis das Signal oder Aktionspotenzial am sogenannten Synapsenendknöpfchen angelangt ist, einer Verdickung, in deren Nähe das Ende eines Dendriten der nächsten Nervenzelle liegt. Zwischen ihnen klafft der synaptische Spalt, den das elektrische Signal nicht überwinden kann, weil es hier ja keine Membranverbindung gibt. Das ankommende Signal sorgt aber für die Verschmelzung kleiner Membranbläschen, sogenannter Vesikel, mit der Zellmembran. Dadurch werden die darin gespeicherten Botenstoffe freigesetzt, sogenannte Neurotransmitter. Je nach Spezialisierung der Nervenzelle sind dies unterschiedliche Substanzen; zu den bekanntesten gehört Glutamat, ein Aminosäure-Salz, das wir auch aus der Gastronomie kennen. Die Botenstoffe binden an Rezeptoren am Ende des Dendriten jenseits des Spalts.
Bei einer sogenannten erregenden Synapse löst diese Bindung in der nächsten Nervenzelle ein Aktionspotenzial aus, das dann wieder elektrisch weitergeleitet wird, und so weiter. Bei einer inhibitorischen Synapse hemmt dagegen das neu ankommende Signal die Weiterleitung. Mehrere Signale, die von unterschiedlichen Neuronen stammen, werden in der Empfängerzelle miteinander verrechnet. So kann zum Beispiel ein angenehmer Reiz wie Streicheln oder eine Empfindung wie Lust einen leichten Schmerzreiz kompensieren.
Schnelle und langsame Signalweiterleitung
Wie schnell die Aktionspotenziale ein Neuron durchwandern, hängt davon ab, ob ihr Neurit ummantelt, also myelinisiert ist. Nackte Nervenzellen leiten Signale erheblich langsamer weiter als solche, die eine Kabelhülle aus sogenannten Schwann-Zellen haben: die Myelinscheide. Die Myelinscheide war hier im Blog schon öfter Thema, weil sie es ist, die bei Multipler Sklerose und einigen anderen Autoimmunstörungen vom eigenen Immunsystem attackiert wird, bis der Nerv bloßliegt und ebenfalls zerstört wird. Hier ist nur wichtig, dass diese Kabelhülle in gewissen Abständen ringförmige Lücken aufweist, nämlich an den Grenzen zwischen zwei Schwann-Zellen.
An diesen sogenannten Ranvier-Schnürringen liegt die Membran des Axons frei und kann rasch de- und repolarisiert werden. Das Aktionspotenzial kann rasant von einem Schnürring zum nächsten überspringen, wodurch es viel schneller am synaptischen Spalt ankommt (sogenannte saltatorische – also sprunghafte – Erregungsleitung). Die unterschiedliche Signalgeschwindigkeit von Neuronen mit und ohne Myelinscheide spielt bei der Schmerzentstehung eine entscheidende Rolle; ich komme darauf zurück.
Arten des Schmerzes
Die oben zitierte Schmerz-Definition deutet es schon an: Diese unangenehme Empfindung nützt uns, indem sie uns sehr schnell auf Gefahren hinweist, sodass wir reagieren und so Schäden vermeiden oder minimieren können. Diese Art des Schmerzes heißt nozizeptiver Schmerz: Er wird von körperfremden Noxen ausgelöst – oder aber von einer lokalen Entzündung, also der ersten, unspezifischen Reaktion des Immunsystems zum Beispiel auf eingedrungene Krankheitserreger. Bei einer Entzündung schwillt nämlich das Gewebe stark an, sodass es einen Druckschmerz auf die Nozizeptoren ausübt, und es erwärmt sich, sodass sich auch in hitzeempfindlichen Nozizeptoren Aktionspotenziale aufbauen. Schmerz (lateinisch dolor) ist ja selbst eines der fünf klassischen Entzündungszeichen.
Dem steht der neuropathische Schmerz gegenüber. Er weist nicht auf einen akut drohenden Schaden hin und hat auch sonst keine biologische Funktion, sondern entsteht durch eine krankhafte elektrochemische Signalgebung von Sinnesnerven, die (etwa durch einen tiefen Schnitt, eine Infektion oder eine Autoimmunerkrankung) beschädigt oder degeneriert sind und nun anlasslos oder über Gebühr wild feuern. An solchen meist chronischen, medikamentös nur schwer zu behandelnden Fehlalarmen ist auch das Hinterhorn im Rückenmark beteiligt, das bei einem Dauerbeschuss mit Schmerzsignalen aus der Peripherie selbst überempfindlich wird und zu viele oder zu starke Signale ans Gehirn weiterschickt.
Schmerz wird auch anhand seiner Dauer eingeteilt. Der akute Schmerz warnt vor akuten Gefahren. Er ist selbstlimitierend: Man reagiert auf ihn, zieht zum Beispiel die Hand aus der Flamme, entfernt einen Dorn aus dem Finger oder lässt sich einen Zahn ziehen, dessen Wurzel sich entzündet hat. Sobald der Anlass behoben und die Wundheilung eingeleitet wurde, lässt der Schmerz nach.
Von chronischem Schmerz spricht man ab einer Dauer von drei Monaten. Hat sich zum Beispiel ein Organ oder ein Gewebe in der Peripherie chronisch entzündet und schafft das Immunsystem es (etwa bei einer Autoimmunerkrankung) nicht, die Ursache abzustellen, sinkt die Erregungsschwelle der Nerven. Dazu im übernächsten Abschnitt mehr.
Das klassische Modell der Schmerzentstehung
Verfolgen wir den Weg des Schmerzsignals einmal vom Ort seiner Entstehung bis ins Gehirn. Bei einer Verletzung scheiden die unmittelbar betroffenen Zellen Substanzen aus, die als Alarmsignale dienen – etwa Protonen, Kaliumionen, ATP, Acetylcholin, Serotonin, Prostaglandine oder Leukotriene. Dann tritt das Immunsystem in Aktion – zuerst die Mastzellen, die sich ohnehin ständig als Wächter im Gewebe aufhalten: Sie scheiden Histamine aus. Diese Substanzen sind die eigentlich noxischen Stimuli; sie werden von den fein verzweigten Enden der Nozizeptoren wahrgenommen. Daraufhin werden die Nozizeptoren aktiv: Die Membran in der Nähe ihrer Rezeptoren depolarisiert sich, und dieses elektrische Signal wandert aus der Peripherie in Richtung des zentralen Nervensystems.
Nervenzellen sind von ganz unterschiedlicher Gestalt und Ausdehnung. Die primären afferenten Neuronen, die Schmerz wahrnehmen, haben sehr lange Dendriten, die zum Beispiel von der Fingerspitze bis in den Wirbelkanal im Inneren der Wirbelsäule reichen. Dort liegen in Nervenknoten, den sogenannten Spinal- oder Hinterwurzelganglien, die Zellkörper aller Neuronen, die Sinnesreize aus der Peripherie an das zentrale Nervensystem melden sollen. Jenseits der Zellkörper reichen ihre Neuriten bis in das sogenannte Hinterhorn an der Rückenseite des Rückenmarks. Hier, in den äußeren Schichten des Hinterhorns, geben die primären afferenten Neuronen den Staffelstab an die nächsten Glieder in der Kette weiter: an die Projektneuronen, die das Signal verarbeiten und dann im Rückenmark aufwärts in Richtung Gehirn weiterleiten.
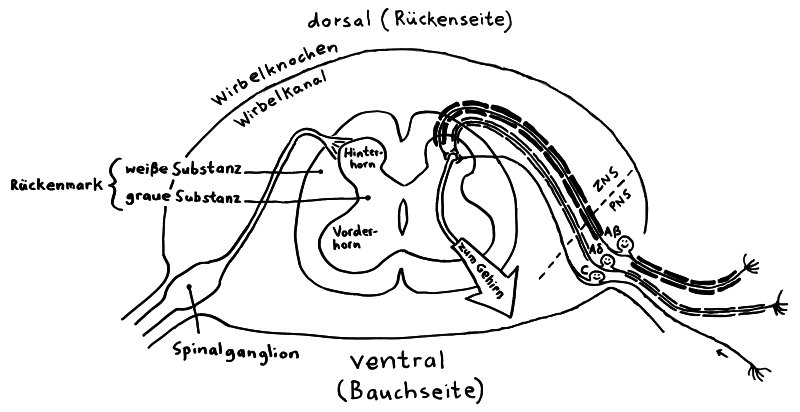
Querschnitt durch den Wirbelkanal eines Rückenwirbels. Im Hinterhorn werden Berührungs- und Schmerzsignale von den primären afferenten Neuronen an Projektneuronen übergeben, die sie verrechnen und ans Gehirn weiterschicken.
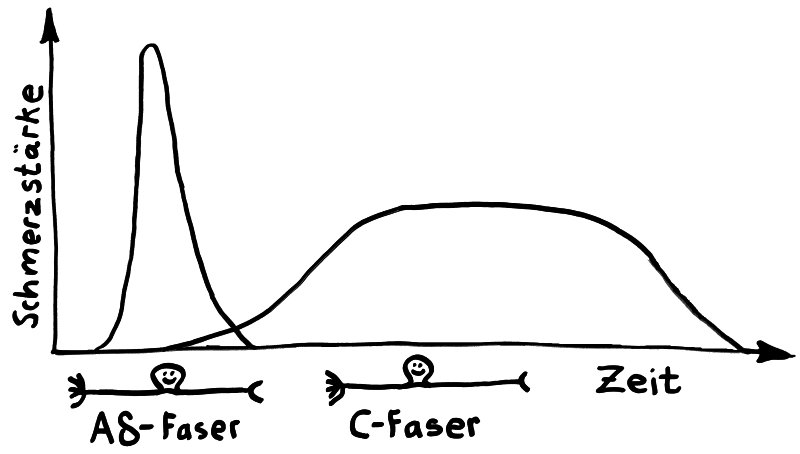
Sehen wir uns die Übergabe des Staffelstabs von den Neuriten der primären afferenten Neuronen zu den Dendriten der Projektneuronen im Rückenmark noch einmal einmal genauer an: Das Hinterhorn besteht aus sechs Schichten, von außen nach innen Lamina I bis Lamina VI genannt. Nicht schmerzhafte Berührungsreize werden von myelinisierten Neuronen (sogenannten A-β-Fasern) wahrgenommen und gelangen daher sehr schnell ins Hinterhorn, wo sie in den tieferen Schichten an die nächsten Neuronen übergeben werden. Schmerzsignale werden dagegen teils in den nicht myelinisierten, langsamen C-Fasern und teils in den schwach myelinisierten, mittelschnellen A-δ-Fasern transportiert, die ihre Synapsenendknöpfchen überwiegend in den äußeren Schichten haben.
Dort schütten sie ihre Neurotransmitter aus, vor allem das für Nozizeptoren typische Glutamat, das in den Empfänger-Dendriten ein Aktionspotenzial auslöst. Da die Signale aus den A-δ-Fasern schneller im Hinterhorn ankommen als die gleichzeitig gestarteten Signale aus den C-Fasern, gibt es erst einen kurzen, scharfen primären Schmerz und danach einen länger anhaltenden, brennenden sekundären Schmerz.
Wenn nicht hemmende Neurotransmitter aus anderen Synapsenendknöpfchen (zum Beispiel Endorphine) dominieren, steigt das Schmerzsignal dann vom Hinterhorn über Projektneuronen bis in die höheren Zentren im Gehirn auf. Im sogenannten somatosensorischen Kortex, also dem Hirnrindenbereich, der für Körperempfindungen zuständig ist, werden die sensorischen Signale mit emotional-kognitiven Signale zu einer bewussten Schmerzwahrnehmung zusammengeführt. Beispielsweise blickt man auf die Fingerspitze, von der das Schmerzsignal stammt, nimmt dann bewusst wahr, dass dort ein Dorn steckt, und erschrickt.
Das klassische Modell der Chronifizierung
Bei der Chronifizierung von Schmerz kommt es zunächst zur peripheren Sensibilisierung: Durch Gewebshormone wie Prostaglandine und Leukotriene, die am Ort der Verletzung vor allem von Immunzellen ausgeschieden werden, sinkt in den Nozizeptoren die Aktivierungsschwelle, sodass schädliche Reize stärker wahrgenommen als sonst (Hyperalgesie). Auch die primären afferenten Neuronen tragen ihren Teil bei: Sie stellen selbst Substanzen her, die sie entgegen der Bewegungsrichtung elektrischer Signale vom Zellkörper zurück zu den Spitzen der Dendriten transportieren und dort ausschütten, sobald die Membran durch einen Schmerzreiz depolarisiert wird. Diese sogenannten Neuropeptide verstärken die örtliche Entzündungsreaktion: Sie stellen die Blutgefäße weit, veranlassen Mastzellen zur Ausschüttung von mehr Histaminen und so weiter. Das wiederum macht die Nozizeptoren empfindlicher. Schon harmlose Reize wie sanfte Berührungen können in einer solchen Situation Schmerz auslösen, weil die eben erwähnten A-β-Nervenfasern, die für solche taktilen Reize zuständig sind, sich nun in Nozizeptoren verwandeln (Allodynie).
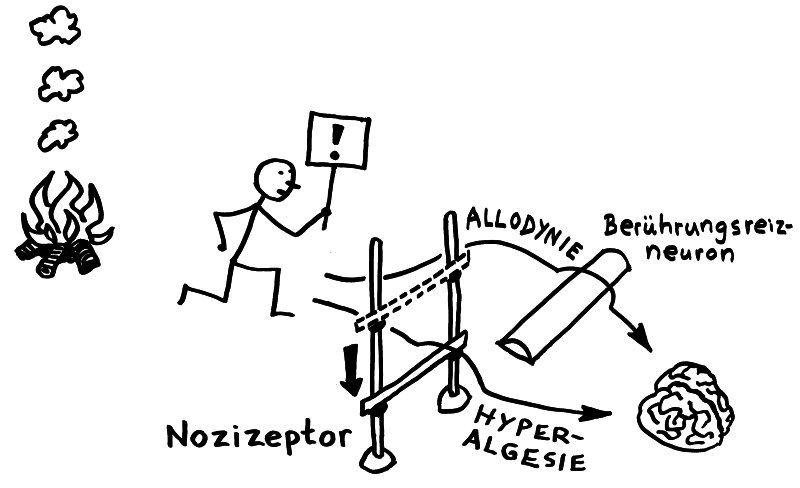
Bei Hyperalgesie wird die Erregungsschwelle eines Nozizeptors abgesenkt, bei Allodynie verwandeln sich andere primäre afferente Neuronen in zusätzliche Nozizeptoren.
Nach einer Weile tritt eine zentrale Sensibilisierung hinzu: Auch die Neuronen im Rückenmark verändern sich durch den Dauerbeschuss mit Schmerzsignalen aus der Peripherie, vor allem durch wiederholte Glutamat-Salven aus den C-Fasern. Sie verändern ihre Gen-Expression, machen sich so noch empfänglicher für die erregenden Neurotransmitter, und senden folglich stärkere Schmerzsignale ans Gehirn weiter. Auf die Dauer entsteht das gefürchtete „Schmerzgedächtnis“. Hier hat die sogenannte Neuroplastizität, also die Fähigkeit unseres Nervensystems, häufig benötigte Signalwege auszubauen und ungenutzte abzubauen, unerwünschte Folgen, die oft nicht mehr rückgängig zu machen sind.
Immunsystem an Schmerz beteiligt
In diesem klassischen Modell spielen Immunzellen kaum eine Rolle – abgesehen vom Anfang der Kette, in der Peripherie, wo sie durch die Entzündungsreaktion die Wahrnehmung von Noxen verstärken. In den letzten Jahren hat sich das Bild aber gewandelt: Verschiedene Forscherteams haben ihren Versuchstieren – vor allem Mäusen – Verletzungen an peripheren Nerven zugefügt und untersucht, wie man die chronischen Schmerzen, die die Tiere daraufhin entwickeln, blockieren kann. Dabei entdeckten sie, dass neben den Neuronen selbst und den Schwann-Zellen aus ihren Myelinscheiden eine Menge anderer Zellen an diesen Vorgängen mitwirken – darunter Makrophagen und ihre funktionellen Pendants im Nervensystem, die Mikrogliazellen, aber auch T-Zellen und vermutlich sogar B-Zellen, die Antikörper produzieren.
Um aufeinander einzuwirken, müssen Nervenzellen, Gliazellen und die Zellen des Immunsystems gewissermaßen dieselbe Sprache sprechen – oder zumindest einen gemeinsamen Wortschatz beherrschen. Und genau so ist es: Rezeptoren an der Oberfläche des einen Zelltyps wurden auch auf Zellen des jeweils anderen Typs entdeckt.
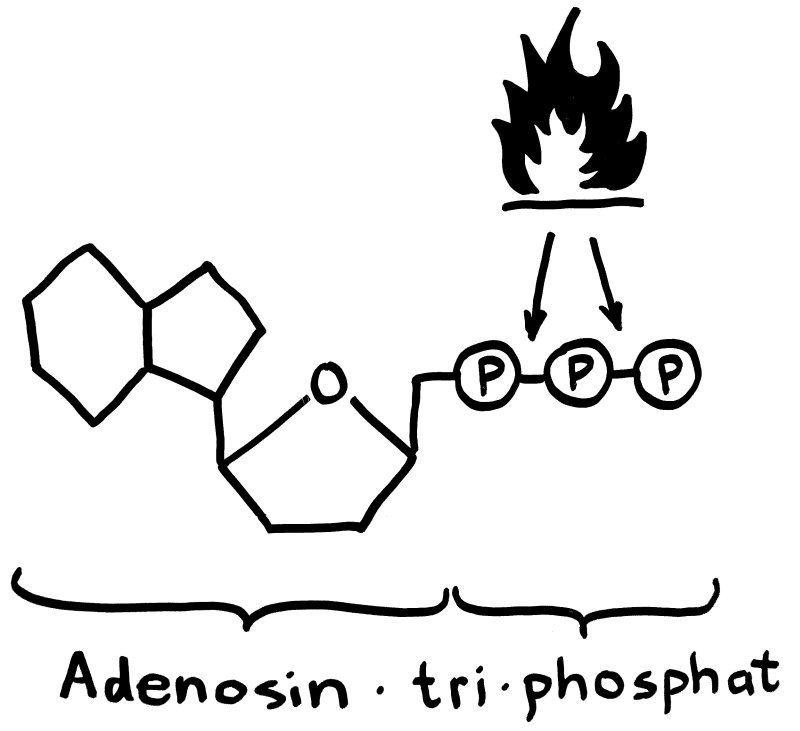
Eine Schlüsselrolle nehmen die sogenannten purinergen Rezeptoren ein: Rezeptoren in der Zellmembran, die Purine wahrnehmen können. Zu diesen organischen Verbindungen zählt Adenosintriphosphat, kurz ATP. Von ATP war hier im Blog schon oft die Rede, denn es ist das Energiespeicher-Molekül unserer Zellen. Die Energie steckt vor allem in den Bindungen, mit denen die drei Phosphatgruppen aneinander gekoppelt sind. Braucht die Zelle gerade viel Energie, etwa zur Vermehrung oder zur Fortbewegung, zwackt es Phosphatgruppen ab; übrig bleibt Adenosindiphosphat ( ADP) oder Adenosinmonophosphat (AMP). Hat sie Energie gewonnen, etwa aus der Nahrung oder dem Abbau nicht mehr benötigter Zellbestandteile, speichert sie diese durch den Aufbau von ATP aus ADP oder AMP.
Aufgrund seines energetischen Werts hat ATP außerhalb von Zellen eigentlich nichts verloren – so, wie Benzin tunlichst im Tank bleiben und nicht auf die Straße fließen sollte. Riecht es irgendwo stark nach Benzin, sind wir alarmiert. Insofern ist ATP gerade wegen seines Werts ein besonders gutes Alarmsignal, das die Zellen ringsum zum Beispiel über die Beschädigung eines Neurons oder seiner Myelinscheide informieren kann. Wahrgenommen wird dieses Signal eben über die purinergen Rezeptoren, von denen es eine ganze Reihe gibt; ihre Namen fangen mit P2X und P2Y an.
Im zentralen Nervensystem tragen vor allem die Mikrogliazellen diese Rezeptoren. Das sind Makrophagen-ähnliche Immunzellen, die kurioserweise nicht im Knochenmark entstehen wie alle anderen Immunzellen: Ihre Vorläufer wandern vielmehr während der Embryonalentwicklung aus dem Dottersack des Embryos in das entstehende ZNS ein. Etwa fünf bis zehn Prozent aller Zellen im ausgewachsenen ZNS sind Mikrogliazellen.
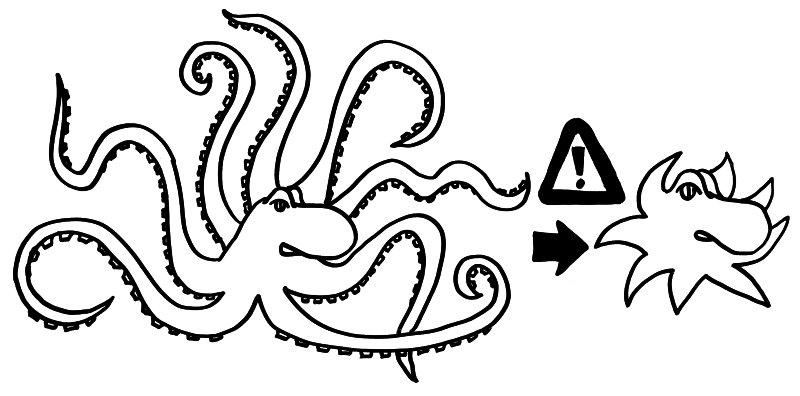
Bei der Aktivierung ziehen Mikrogliazellen ihre langen Fortsätze ein, und der Zellkörper wird größer.
Im Ruhezustand haben sie zahlreiche lange, verzweigte und bewegliche Fortsätze, mit denen sie permanent die Neuronen in ihrer Umgebung abtasten. Stellen sie dabei einen Defekt fest, so werden sie aktiviert: Sie ziehen ihre Fortsätze ein, bis nur noch kurze, dicke Stummel übrig bleiben, der Zellkörper vergrößert sich, sie erhöhen die Zahl ihrer purinergen und sonstigen Rezeptoren, um Alarmsignale wie das extrazelluläre ATP noch besser wahrnehmen zu können, sie vermehren sich durch Teilung und sie produzieren alle möglichen Substanzen, mit denen sie andere Zellen über das Problem informieren. Unter anderem locken sie mit Chemokinen weitere Mikrogliazellen an den Ort des Geschehens. Etwa zwei Tage nach einer peripheren Nervenverletzung erreicht ihre Aktivierung ihren Höhepunkt.
Bei bestimmten Mäusen – darauf komme ich zurück! – kann man eine Chronifizierung des Schmerzes nach einer peripheren Nervenverletzung verhindern, indem man die purinergen Rezeptoren auf den Mikrogliazellen ausschaltet. Tragen die aktivierten Mikrogliazellen dagegen purinerge Rezeptoren auf ihrer Oberfläche, so registrieren sie das extrazelluläre ATP, das die beschädigten Nerven freigesetzt haben, und schütten daraufhin ihrerseits Alarmstoffe wie BDNF (brain-derived neurotropic factor) aus. BDNF und die übrigen löslichen Botenstoffe binden dann an die entsprechenden Rezeptoren der Nozizeptoren und Projektneuronen im Hinterhorn, lösen in ihnen eine Depolarisierung der Membran aus und sorgen so dafür, dass mehr Schmerzsignale in Richtung Gehirn weitergeschickt werden (Hyperalgesie, s. o.). Außerdem „überreden“ ATP-stimulierte Mikrogliazellen andere afferente Neuronen, die normalerweise keinen Schmerz, sondern normale Berührungsreize wahrnehmen, zu Nozizeptoren zu werden (Allodynie, s. o. ).
Neben Mikrogliazellen wandern auch Makrophagen und T-Zellen in die Spinalganglien, also die rückenmarksnahen Nervenknoten ein, in denen die Zellkörper der beschädigten Neuronen liegen. Deren Beschädigung und Entzündung führt nämlich zu einer Verhaltensänderung der Schwann-Zellen: Sie wickeln sich von dem Neuron ab, das sie bisher umhüllten. Das nun ungeschützte Neuron reagiert jetzt überempfindlich auf Schmerzsignale, wie ein bloßliegender Zahnhals, und scheidet dabei allerlei Botenstoffe aus, die nicht nur auf benachbarte Nervenzellen einwirken, sondern – wegen des eben angesprochenen gemeinsamen Vokabulars – auch Immunzellen anlocken und aktivieren.
T-Zellen sind, um richtig aktiv zu werden, auf die Präsentation von Antigenen durch andere Immunzellen angewiesen – normalerweise durch dendritische Zellen oder Makrophagen, die beispielsweise eine fremde Zelle verschlungen haben. Aber auch aktivierte Mikrogliazellen exprimieren MHC-Klasse-II-Komplexe, also „Antigenpräsentierteller“, sowie die nötigen Kostimulatoren, sodass T-Zellen an sie andocken und mit ihnen kommunizieren können.
Teufelskreis
Die Anhäufung und Aktivierung von Mikrogliazellen und weiteren Immunzellen führt also zu einer Flut von Boten- und Alarmstoffen im Spinalganglion und im Hinterhorn. Das macht die Nervenzellen in ihrer Nähe noch leichter erregbar und verstärkt so die Schmerzwahrnehmung – und das leider auch bei chronischen Schmerzen, die durch eine Nervenbeschädigung oder eine Autoimmunerkrankung ausgelöst wurden. Und so kommt ein echter Teufelskreis in Gang: Die verstärkte und verlängerte Schmerzwahrnehmung führt im Zuge der oben erläuterten Sensibilisierung dazu, dass das Gehirn über die Hypothalamus-Hypophysen-Nebennierenrinden-Achse und über die Hypothalamus-Hypophysen-Gonaden-Achse die vermehrte Ausschüttung von Hormonen anordnet. Diese wiederum stimulieren in der Peripherie das Immunsystem noch weiter, sodass es mehr entzündungsfördernde Substanzen wie Zytokine ausschüttet und stärker auf Lockreize wie Chemokine reagiert – und so weiter, auch wenn der ursprüngliche Anlass für den ersten Schmerz längst Geschichte ist.
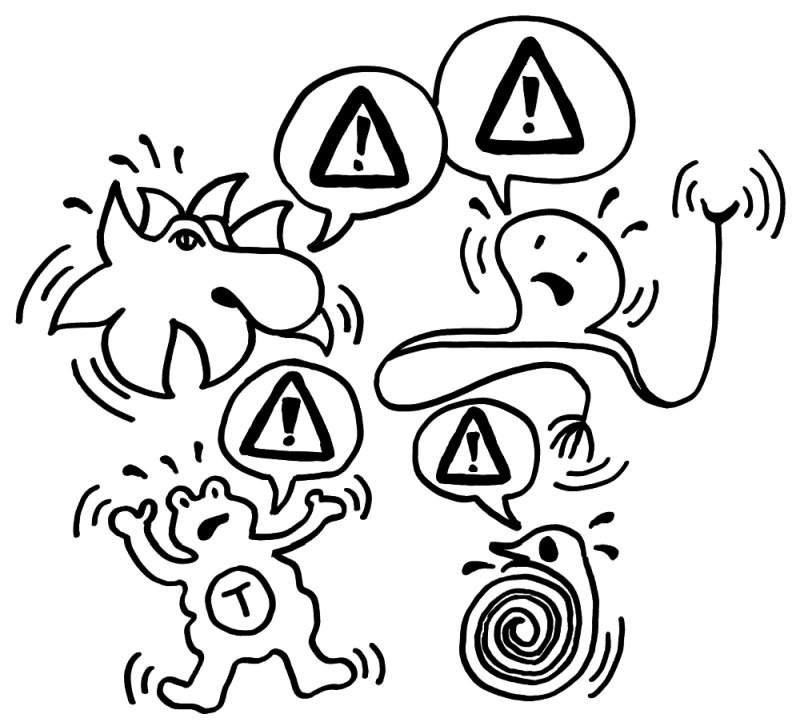
Bei chronischem Schmerz versetzen Mikrogliazellen, Neuronen, eingewanderte T-Zellen und spiralig um die Neuronen gewickelte Schwann-Zellen einander immer wieder in einen Alarmzustand, auch wenn sich der Anlass längst erledigt hat.
Autoimmunerkrankungen und chronischer Schmerz
Sehr viele Autoimmunerkrankungen gehen mit chronischen oder neuropathischen Schmerzen einher. Dass überall derselbe Mechanismus dahinter steckt, ist angesichts der Vielzahl der betroffenen Organe und der unterschiedlichen Verläufe unwahrscheinlich. In den allermeisten Fällen dürften aber Mikrogliazellen, T-Zellen und/oder Autoantikörper an den hartnäckigen Beschwerden beteiligt sein.
Um einige Beispiele zu nennen: Bei Multipler Sklerose (MS) klagen etwa 50 bis 80 Prozent der Betroffenen über chronische Schmerzen. Der Mechanismus ist noch nicht richtig aufgeklärt, aber bei Ratten mit EAE, einem Tiermodell für MS, stellen die Mikrogliazellen im Rückenmark und im Sehnerv mehr von den oben vorgestgellten purinerge Rezeptoren her als bei gesunden Tieren.
Auch das Guillain-Barré-Syndrom geht häufig mit neuropathischem Schmerz einher. Während bei MS Nerven im Gehirn ihre Myelinschicht verlieren, sind es hier periphere Nerven, die allmählich ihre Hülle aus Schwann-Zellen einbüßen. Im Rattenmodell der Erkrankung ist wiederum die Zahl der purinergen Rezeptoren in den Mikrogliazellen im Hinterhorn erhöht, was zu einer Allodynie führt, also dazu, dass die Tiere Berührungen als schmerzhaft empfinden. Außerdem hat man in Tierversuchen eine Einwanderung von T-Zellen und antigenpräsentierenden Zellen in den Ischiasnerv bemerkt, die ebenfalls mit Schmerzverhalten korreliert.
Eine ungewöhnliche Autoimmunerkrankung ist das komplexe regionale Schmerzsyndrom (CRPS), bei dem man Autoantikörper des Typs IgG nachgeweisen hat: Es tritt nach einer – oftmals unauffälligen – Verletzung an einem Arm oder Bein auf und ist mit extremen Schmerzen verbunden, die bei etwa 15 Prozent der Betroffenen chronisch werden, dabei aber auf die jeweilige Gliedmaße beschränkt bleiben. Der Arm oder das Bein schwillt an und wird rot, aber man kann keine Gewebezerstörung feststellen, wie sie sonst mit einer chronischen Entzündung einhergeht. Das Autoantigen, auf das das Immunsystem hier reagiert, ist unbekannt. Die Dauer des Schmerzes lässt jedenfalls auf eine zentrale Sensibilisierung der Nerven schließen.
Bei den Autoimmunerkrankungen der Schilddrüse, Hashimoto-Thyreoiditis und Morbus Basedow, ist umstritten, ob Fibromyalgie bzw. chronische Schmerzen in mehreren Körperregionen (chronic widespread pain, CWP) unter den Patienten tatsächlich deutlich weiter verbreitet sind als in der Allgemeinbevölkerung. Etliche Betroffene haben außerdem mindestens eine weitere Autoimmunerkrankung, die unter Umständen für den Schmerz verantwortlich ist. Auffällig ist, dass die Schmerzen durch die Schilddrüsenhormonbehandlung nicht verschwinden. Vielleicht werden sie also durch Autoantikörper verursacht, die womöglich nicht nur an Strukturen in der Schilddrüse binden, sondern im Zuge einer Kreuzreaktion auch an Nervenzellen oder Gliazellen – und so die Nerven überempfindlich machen.
Auch Autoantikörper gegen Komponenten des spannungsabhängigen Kaliumkanal-Komplexes (VGKCC) der Neuronen, der an der elektrischen Signalleitung im Nervensystem beteiligt ist, stehen im Verdacht, an den Schmerzen bei Autoimmunerkrankungen mitzuwirken. Die Kanal-Komplexe sitzen in der Nähe der oben erwähnten Janvier’schen Schnürringe, also der Lücken in der Myelinscheide einer Nervenzelle, und dämpfen normalerweise die neuronale Erregbarkeit. Die Autoantikörper binden an die Proteine, die die Komplexe an ihrer Position neben den Schnürringen verankern sollen, und führen zu einem Ausfall dieser Hemmwirkung. So feuern die Neuronen zu oft und lösen damit einen neuropathischen Schmerz aus.
Bei rheumatoider Arthritis treten zahlreiche unterschiedliche Autoantikörper auf. Injiziert man Mäusen einen davon, ACPA, so zeigen sie ein mehrere Wochen anhaltendes Schmerzverhalten, ohne dass eine Entzündung nachzuweisen wäre. Daher kommt der Schmerz wohl unmittelbar durch die Bindung des Autoantikörpers an eine Struktur des Nervensystems zustande. Allerdings muss noch irgendein weiterer Schmerzauslöser hinzukommen, denn diese Autoantikörper treten beim Menschen bis zu 10 Jahre vor den ersten klinischen Symptomen und Schmerzen auf.
Wieder einmal: Auf das Geschlecht kommt es an
Gegen all die chronischen Schmerzen, die mit Autoimmunerkrankungen einhergehen, wirken herkömmliche schmerzstillende Mitteln kaum. Daher ist das Interesse vor allem an den Mikrogliazellen groß: Man hofft auf Wirkstoffe, die gezielt in diesen Zellen die Expression der purinergen Rezeptoren oder die Ausschüttung von BDNF blockieren, die durch die ATP-Bindung an diese Rezeptoren ausgelöst wird. So könnte man womöglich die zentrale Sensibilisierung und damit die Chronifizierung der Schmerzen verhindern.
Doch die Sache hat einen gewaltigen Haken: Im Tierversuch klappt das nur mit männlichen Mäusen. In den Mikrogliazellen der Weibchen wird die Zahl der purinergen Rezeptoren nach einer peripheren Nervenverletzung erst gar nicht hochreguliert; drum gibt es auch nichts zu blockieren.
Auch beim Menschen spielen Mikrogliazellen im männlichen und weiblichen Nervensystem unterschiedliche Rollen. So weisen Jungen viel mehr von diesen Zellen auf als Mädchen, und sie sind bei ihnen bereits von Anfang an aktiviert. Bis zur Pubertät werden sie bei den Jungen weniger und bei den Mädchen mehr. Und während die Mikrogliazellen im männlichen Nervensystem immer inaktiver werden, werden viele von ihnen bei Frauen erst im Alter so richtig aktiv.
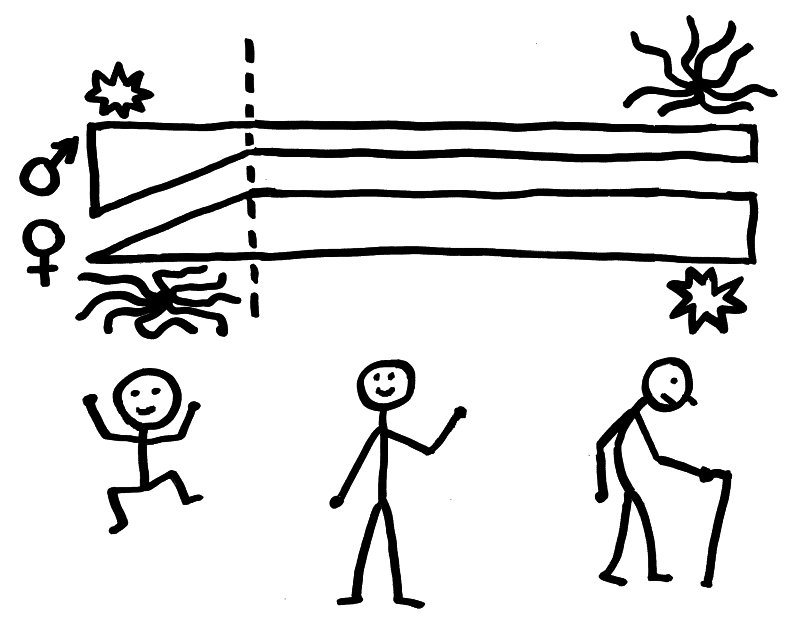
Bei Männern sinkt die Zahl der Mikrogliazellen bis zur Pubertät, bei Frauen steigt sie. Und während sie bei Männern allmählich deaktiviert werden (lange Kraken-Arme), steigt der Aktivierungsgrad bei Frauen mit dem Alter (kurze Ärmchen).
Dennoch leiden sogar mehr weibliche Säugetiere unter chronischen Schmerzen als männliche – und auch Frauen haben häufiger chronische Schmerzen als Männer. Offenbar spielen im weiblichen Organismus reaktionsfreudige T-Zellen eine stärkere Rolle bei der Schmerzentstehung und -chronifizierung. Vor allem ins Nervensystem einwandernde T-Helferzellen vom Typ 1 (Th1) und 17 (Th17) erhöhen im Tierversuch die Schmerzempfindlichkeit von Weibchen.
Geschlechtsspezifische Schmerzmechanismen, vor allem die Unterschiede bei den Mikrogliazellen, sind in engeren Fachkreisen seit den 1990er-Jahren bekannt. Dennoch wurde die überwältigende Mehrheit aller präklinischen Studien zur Schmerzbekämpfung an Versuchstieren nur eines Geschlechts durchgeführt, und zwar in den meisten Fällen nur an Männchen. Ähnlich ist es in vielen anderen biologischen und medizinischen Fachrichtungen: Noch 2009 wurden etwa 80 Prozent aller untersuchten Studien in 10 Fachgebieten ausschließlich an Männchen durchgeführt.
Männliche Mäuse und Ratten sind etwas größer und daher etwa bei Injektionen und Präparationen leichter zu handhaben. Außerdem galt der weibliche Zyklus als Störfaktor. Die Rangkämpfe und die Hierarchien der Männchen in ihren Gemeinschaftskäfigen wurden dagegen nicht als störend empfunden, obwohl sie zum Beispiel zu gewaltigen Unterschieden im Hormonhaushalt zwischen dominanten und unterlegenen Männchen führen können.
Seit Januar 2016 ist die präklinische Forschungsförderung durch die National Institutes of Health (NIH) in den USA an den Nachweis geknüpft, dass man eine Einbeziehung beider Geschlechter zumindest in Erwägung gezogen hat. In Kanada gelten ähnliche Regeln: Man braucht verdammt gute Gründe, um sich auf ein Geschlecht zu beschränken. Zumindest in der Immunsystem- und Schmerzforschung ist eine solche Einseitigkeit kaum noch zu rechtfertigen.
Literatur:
K. A. Mifflin, B. J. Kerr (2017): Pain in Autoimmune Disorders
M. Tsuda, K. Inoue (2016): Neuron–microglia interaction by purinergic signaling in neuropathic pain following neurodegeneration
V. Verma et al. (2014): Nociception and role of immune system in pain (PDF)

Hallo,
ich (w) bin zufällig gerade auf diesen Blog gestoßen und total begeistert und fasziniert!
Gern würde ich mich über ATP und Nervenschmerzen weiter austauschen.
Ich habe seit drei Jahren schlimme Parästhesien, Faszikulationen sowie gelegentliche Lähmungen und Taubheiten und Schmerzen. (Begann im Alter von 49 Jahren, als es wechseljahrstechnisch besonders turbulent bei mir wurde.) Letztes Jahr wurde ich umfassend neurologisch untersucht – man fand nichts! Außer einem Schilddrüsenknoten, der angeblich harmlos ist.
Angeblich alles psycho.
Mit diesem diffusem Erklärungsversuch werde ich mich nie abgeben. Also habe ich privat weiter geforscht und lese permanent bei Google Scholar. Da Krankheiten ja fast immer etwas mit dem Immunsystem und Zellen zu tun zu haben scheinen, habe ich meinen Immunstatus überprüfen lassen. Auch den zellulären: Und nun wird´s – glaube ich – echt spannend. Denn hier zeigen sich massive Verschiebungen, auch wenn das große Blutbild unauffällig ist. (Von wegen: Mäuse haben Schmerzen, aber keine Entzündungszeichen!)Ich habe zwar einerseits massiv zu viele Suppressorzellen (CD25+), andererseits viel zu wenig regulatorische CD8+/CD28- T Zellen. Und massiv zu viele zytotoxische CD8+/CD28+ T Zellen. Dennoch ist der gesamt CD8+ T Zellbereich ebenfalls massiv erniedrigt. (Alle anderen geprüften Zellen altersgemäß ok.)
So.
Da Sie über Mäuseversuche berichteten: Ich habe ziemlich schnell die Mäuseversuche gefunden, in denen angeblich bewiesen wurde, dass Mäuse ohne CD8+ T Zellen und CD8+/CD28- T Zellen „Mäuse-MS“ bekommen. In einem anderen Versuch bewies man, dass bei „Mäuse-Darmkolitis“ eine Zugabe von CD8+/CD28- Zellen die Krankheit milderte. (Ich hatte zwei Jahre vor meinem „Nervenfeuer“ eine Darmentzündung unbekannter Ursache mit einem CRP Wert von deutlich über 100.)
Und bei der „Mäuse-Myasthenia Gravis“ fand man heraus, dass sich die Krankheit nur dann besserte, wenn beide suppressorische Zellgruppen, also CD4/CD25+ sowie die CD8+/CD28- T Zellen ausreichend vorhanden sind. Und da kommt dann irgendwie auch ATP ins Spiel…Und das war der Teil, den ich bis zum Lesen Ihres Blogs noch nicht ganz verstanden hatte;)
So. Ich habe KEINE Autoimmunerkrankung. Aber ich habe ja vielleicht doch etwas, was mal nicht psychisch bedingt ist, auch, wenn Ärzte jetzt keinerlei Entzündungszeichen finden. (Menschen mit Autoimmunkrankheiten haben angeblich immer zu wenig CD4+/CD25+ regulative Zellen, die mit Krebs zu viele.) Irgendwie so – ich bin leider keine Genetikerin, alle Angaben ohne Gewähr 😉
Inzwischen hat man wohl herausgefunden, dass die regulativen Zellen beim Menschen noch etwas komplexer sind als bei den Mäusen. Aber als Ansatz finde ich das erst einmal spannend, denn auch die CD8+ Zellgruppen scheinen für die Autoimmunerkrankungen von Bedeutung zu sein. Ich habe meinen Zellstatus noch einmal überprüfen lassen – wieder dasselbe Ergebnis! Und ich werde das noch einmal bei einem anderen Labor machen lassen, die weitere CD8+ Subgruppen prüfen können. Mich interessiert auch nur und ausschließlich die Evidenz!
Was meinen Sie?