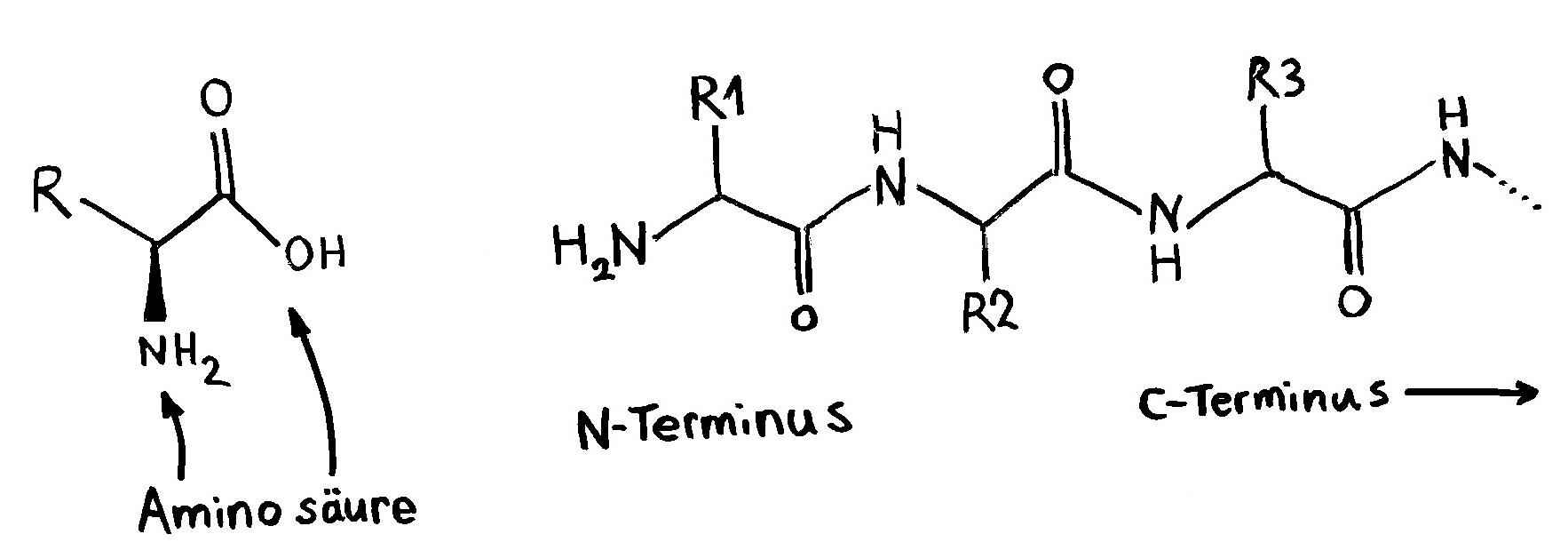
Eine etwas weniger schematische Darstellung der Bindung eines T-Zell-Rezeptors an ein Antigen-Peptid und ein MHC-Molekül. Wir blicken aus der Perspektive der T-Zelle auf die Bindungsfläche (das »Präsentationstablett «) des MHC-Moleküls. Die Kontur des präsentierten Peptids ist gepunktet. Vom T-Zell-Rezeptor sind lediglich die sechs Schlaufen zu sehen, mit denen er an den Komplex andockt. Die äußeren vier Schlaufen erkennen vor allem Teile des MHC-Moleküls, die mittleren beiden auch Teile des präsentierten Antigens.
Die Antigenspezifität eines T-Zell-Rezeptors wird vor allem durch die Aminosäuresequenz dieser Schlaufen (α3 und β3) festgelegt. Von den Genen, in denen diese T-Zell-Rezeptorschlaufen codiert sind, gibt es zahlreiche Varianten – wenn auch nicht ganz so viele wie von den Genen, die die Bindungsfläche der MHC-Klasse-II-Moleküle codieren.
Sie dürfen diese Zeichnung gerne in Folien etc. übernehmen, sofern Sie die Quelle angeben: Dr. Andrea Kamphuis, https://autoimmunbuch.de