Die im Titel angerissene Frage ist natürlich nicht neu. Immunmetabolismus ist ein relativ junges Feld, aber schon vor über 10 Jahren gab es spannende Veröffentlichungen, in denen beispielsweise der Stoffwechsel von aktivierten T-Zellen mit dem von Krebszellen verglichen wurde, weil beide Zelltypen sich schnell und stark teilen, dafür vor allem organische Verbindungen als Baustoffe benötigen und daher die Glykolyse gegenüber anderen, energetisch effizienteren Stoffwechselwegen bevorzugen.
Bereits 2016 habe ich hier einen Artikel über die Stoffwechselprobleme von T-Zellen bei Autoimmunstörungen veröffentlicht, und 2014 habe ich Skizzen fürs Autoimmunbuch vorgestellt, die sich ebenfalls um den Energiebedarf von T-Zellen drehen. Seither wurden viele weitere Immunzelltypen, Autoimmunerkrankungen usw. unter die Lupe genommen. Außerdem traten Signal- oder Botenstoffe als dritte im Immunsystem wichtige Kategorie von Stoffwechselprodukten neben die Energieträger (ATP) und Baustoffe. Das klang im vorigen Artikel über entzündungshemmende Glucocorticoide und Itaconat schon an. Daher wird es Zeit für einen Rundumschlag.
Drei Stoffwechselwege spielen in unseren Zellen, auch in unseren Immunzellen, eine zentrale Rolle: die Glykolyse, der Zitratzyklus und die oxidative Phosphorylierung. Die folgenden drei Karikaturen zeigen sehr stark vereinfacht, was dabei geschieht:
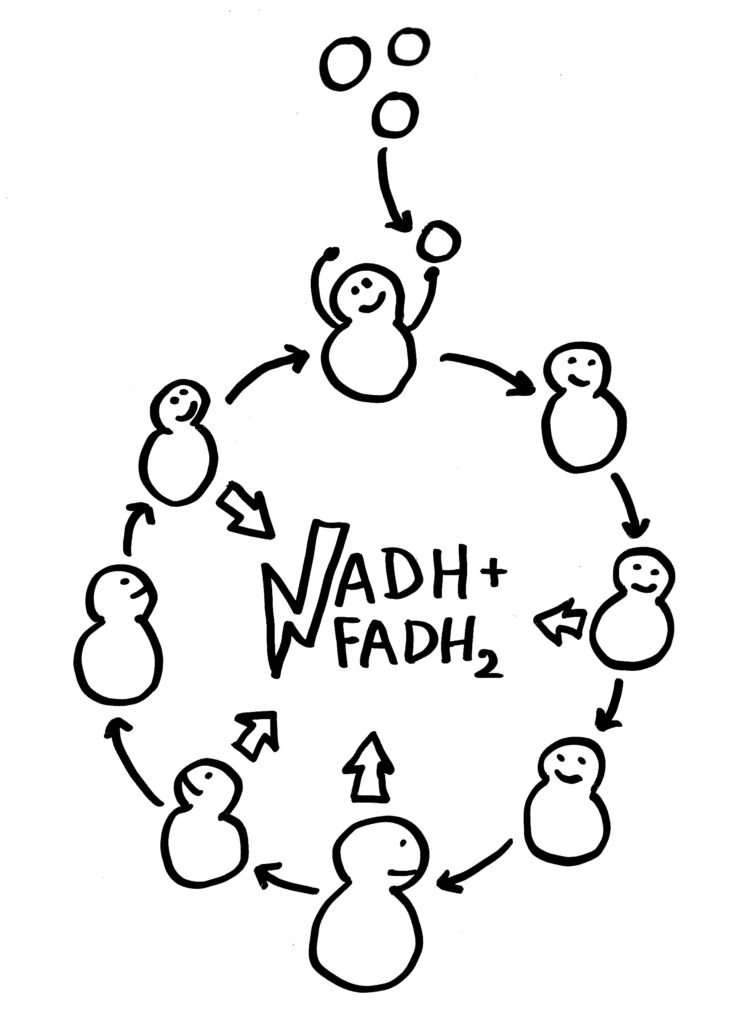
In der Glykolyse wird der Zucker Glucose zerlegt; daher der Name. Dieser evolutionär sehr alte Prozess, der im Zytosol abläuft, besteht tatsächlich aus 10 Teilschritten und erfordert zahlreiche Enzyme. Unter bestimmten Bedingungen kann er größtenteils auch rückwärts, also anabolisch (aufbauend) ablaufen. Im katabolischen (abbauenden) Normalfall ergibt ein Glucosemolekül mit seinen 6 Kohlenstoffatomen zwei Pyruvatmoleküle mit je drei Kohlenstoffatomen. Außerdem entstehen ein wenig ATP und NADH:
Aus dem Pyruvat kann die Zelle entweder alle möglichen Baustoffe machen, die sie für ihr Wachstum und ihre Teilung benötigt. Oder sie wandelt es in Acetyl-CoA um und führt dieses dem Zitratzyklus zu, der im Inneren der Mitochondrien abläuft. Dort werden die Acetyl-Gruppen – wiederum über zahlreiche Zwischenschritte mit je eigenen Enzymen – letztlich zu Kohlendioxid und Wasser zerlegt. Dabei entsteht ein wenig GTP, ein mit dem ATP verwandter Energieträger. Aber vor allem werden die energiereichen Elektronen aus den organischen Kohlenstoffverbindungen – zusammen mit Protonen – auf die Coenzyme Nicotinamid-Adenin-Dinukleotid (kurz: NAD+) und Flavin-Adenin-Dinukleotid (kurz: FAD) übertragen, sodass NADH und FADH2 entstehen:
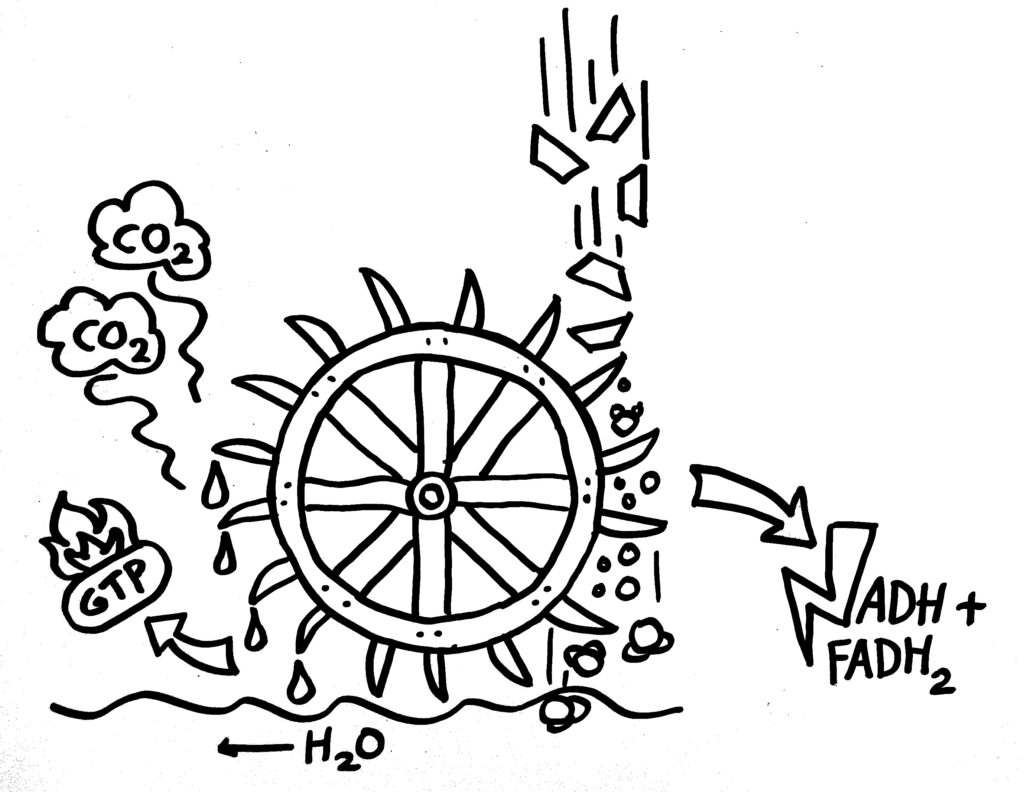 Die beiden Coenzyme werden also reduziert und können die so in ihren zwischengespeicherte bzw. verwertbar gemachte Energie aus der Glucose nun weitertragen zum dritten großen Stoffwechselweg: der oxidativen Phosphorylierung (kurz: OxPhos), die in der stark vergrößerten und daher aufgefalteten inneren Mitochindrien-Membran abläuft. (Da Mitochondrien von einem membranumhüllten Bakterium abstammen, das in eine ebenfalls membranumhüllte Archaeen-Zelle eingedrungen ist, haben sie zwei Membranen.)
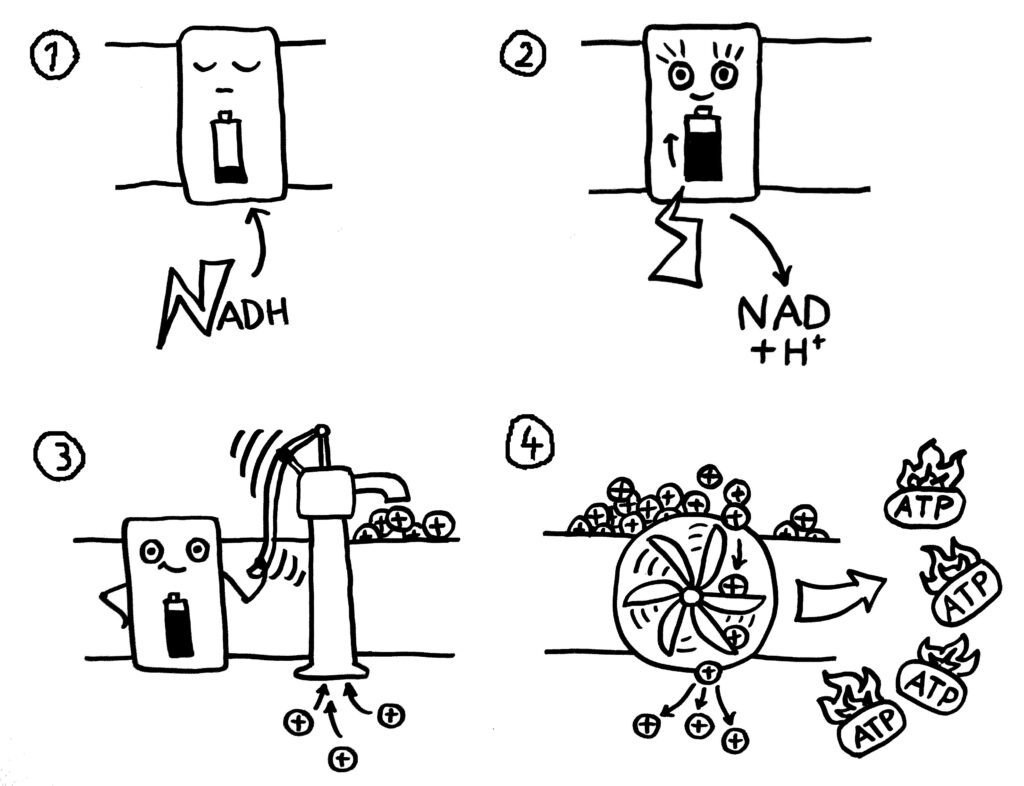
Die beiden Coenzyme werden also reduziert und können die so in ihren zwischengespeicherte bzw. verwertbar gemachte Energie aus der Glucose nun weitertragen zum dritten großen Stoffwechselweg: der oxidativen Phosphorylierung (kurz: OxPhos), die in der stark vergrößerten und daher aufgefalteten inneren Mitochindrien-Membran abläuft. (Da Mitochondrien von einem membranumhüllten Bakterium abstammen, das in eine ebenfalls membranumhüllte Archaeen-Zelle eingedrungen ist, haben sie zwei Membranen.)
Von den sechs Atmungskette-Proteinkomplexen, die in die Membran eingebettet sind, ist in dieser Karikatur nur einer angedeutet, der für alle stehen soll. Zu Beginn (1) ist der Komplex inaktiv und nicht zur Arbeit in der Lage. Wenn eines der reduzierten Coenzyme (hier NADH) an ihn bindet, erwacht er und übernimmt die energiereichen Elektronen (2). Dadurch sind die Komplexe nun imstande, Protonen von der Innenseite in den Raum zwischen innerer und äußerer Mitochondrien-Membran zu pumpen, sodass ein starker Protonen-, also pH-Gradient aufgebaut wird (3). Dieser Gradient treibt eine ATP-Synthase an, ein Enzym in der inneren Membran, durch das die Protonen wieder nach innen zurückströmen. Diese Energie ermöglicht es dem Enzym, aus ADP und Phosphat in großem Stil ATP zu produzieren (4).
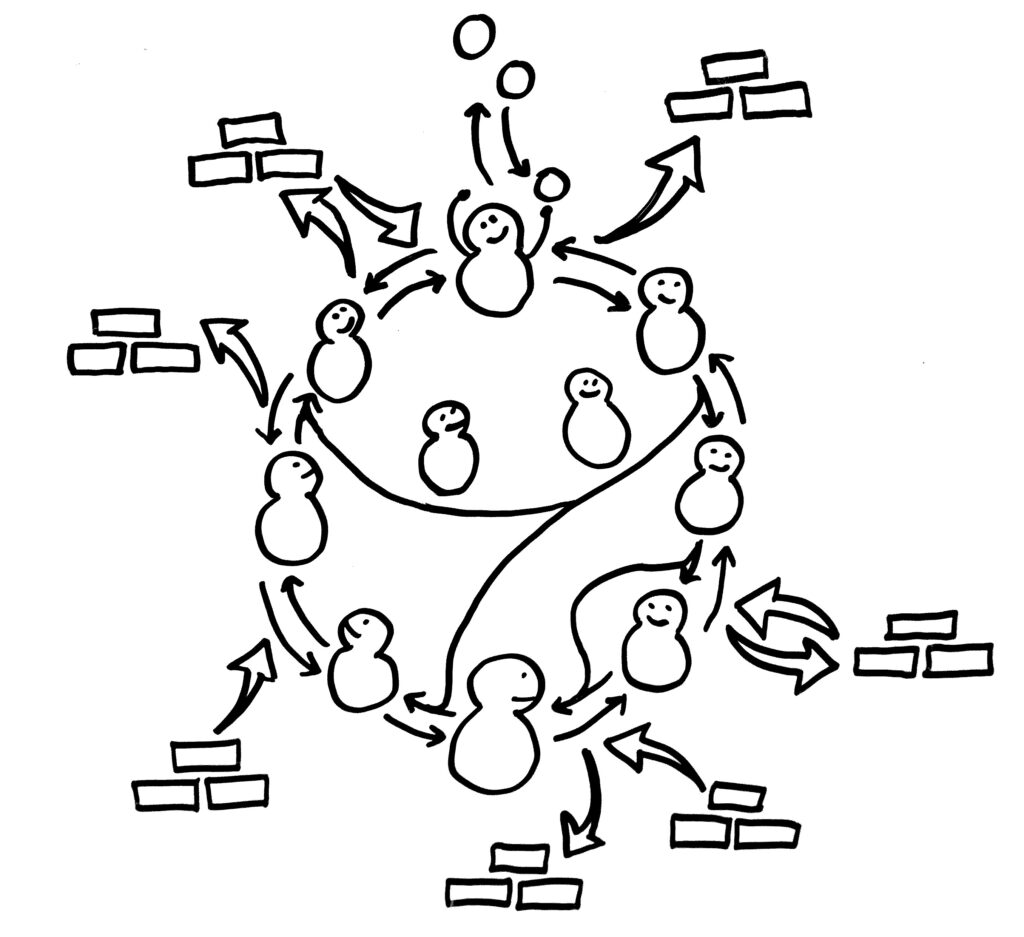
 Sehen wir uns den zweiten dieser drei Stoffwechselwege, den Zitratzyklus, noch einmal näher an. Er besteht aus acht spezifischen Enzymen, deren Produkte jeweils die Ausgangsstoffe für den nächsten Schritt im Zyklus sind. Hinein kommt energiereiches Acetyl-CoA, heraus kommen energiearme Abfallprodukte (CO2 und H2O, hier nicht gezeigt) sowie reduzierte Coenzyme (NADH und FADH2), deren Elektronen vor Energie strotzen:
Sehen wir uns den zweiten dieser drei Stoffwechselwege, den Zitratzyklus, noch einmal näher an. Er besteht aus acht spezifischen Enzymen, deren Produkte jeweils die Ausgangsstoffe für den nächsten Schritt im Zyklus sind. Hinein kommt energiereiches Acetyl-CoA, heraus kommen energiearme Abfallprodukte (CO2 und H2O, hier nicht gezeigt) sowie reduzierte Coenzyme (NADH und FADH2), deren Elektronen vor Energie strotzen:
Ach, wäre es doch nur so einfach, wie wir es in der Schule auswendig gelernt haben! Aber: Genau wie die Glykolyse kann der Zitratzyklus unter bestimmten Bedingungen rückwärts laufen. Und bei Bedarf werden Zwischenprodukte aus ihm abgezweigt, aus denen die Zelle Baustoffe machen kann. Und da der Zyklus zum Erliegen käme, wenn immer nur etwas abgezweigt würde, werden zum Ausgleich andere Stoffe in ihn hineingeschleust. Und es gibt Abkürzungen und Umwege, an denen weitere Enzyme beteiligt sind:
 (Übrigens: Auch wenn ich uns hier die Namen aller Enzyme, Zwischen- und Nebenprodukte sowie der Wegvarianten erspare, so ist dieser Cartoon doch ziemlich genau, was die Zahl und Anordnung der Enyzme, Abkürzungen usw. betrifft.)
(Übrigens: Auch wenn ich uns hier die Namen aller Enzyme, Zwischen- und Nebenprodukte sowie der Wegvarianten erspare, so ist dieser Cartoon doch ziemlich genau, was die Zahl und Anordnung der Enyzme, Abkürzungen usw. betrifft.)
Dass Glykolyse und Zitratzyklus auch rückwärts laufen können, wenn es erforderlich ist und Umgebungsbedingungen stimmen, deutet darauf hin, dass diese Stoffwechselwege evolutionär sehr alt sind. Vermutlich liefen sie in ähnlicher Form schon in den Vorfahren der eukaryotischen Zelle und des Mitochondriums ab, also in den Archaeen und Alphaproteobakterien, die auf diese Weise (also rückwärts) aus einfachen Molekülen aus ihrer Umwelt organische Substanzen aufbauen konnten. Der dritte Stoffwechselweg, die oxidative Phosphorylierung, ist evolutionär viel jünger, denn das funktioniert nur mit Sauerstoff als finalem Elektronenakzeptor. Es gab aber einfachere, weniger effiziente Vorformen, in denen ein anderes Oxidationsmittel wie Nitrat, Sulfat, Eisen oder Kohlendioxid am Ende die Elektronen aufgenommen hat.
Bei einer Entzündung reduzieren unsere Makrophagen und viele andere Immunzellen – wie die eingangs erwähnten T-Zellen – den Durchsatz des Zitratzyklus und erhöhen dafür den Durchsatz der Glykolyse. Denn sie müssen sich nun rasch vermehren und proinflammatorische Wirkstoffe produzieren. Dafür brauchen sie viele Baustoffe, die aus dem Endprodukt der Glykolyse, dem Pyruvat, aufgebaut werden können. Dass sie auf diese Weise weniger ATP gewinnen, nehmen sie in Kauf.
Ganz zum Erliegen kommt der Zitratzyklus in proinflammatorischen Makrophagen aber nicht: Ein wenig Acetyl-CoA fließt in ihn hinein, und in den Mitochondrien werden weiterhin energiereiche Elektronen in NADH und FADH2 zwischengespeichert. Zugleich wird aber etwas von dem Zitratzyklus-Zwischenprodukt Aconitat aus dem Reaktionskreislauf abgezweigt und von einem neu produzierten Enzym in den Botenstoff Itaconat umgewandelt, der hier als Schildkröte dargestellt ist. Ein weiteres Zwischenprodukt, Succinat (der Hase), heizt unterdessen die Entzündungsreaktion ordentlich an:
 Sobald die akute Gefahr (etwa ein Krankheitserreger) niedergerungen ist, wechseln die Makrophagen in einen antiinflammatorischen, also entzündungshemmenden Modus. Nun wird die Glykolyse herunter- und der Zitratzyklus hochgefahren. Da das Pyruvat nicht mehr als Ausgangssubstanz für alle möglichen Bau- und proinflammatorischen Wirkstoffe benötigt wird, kann es in den Zitzratzyklus einfließen. Entsprechend viel Itaconat entsteht nun. Dieser Signalstoff hemmt Entzündungen auf mehreren Wegen, von denen ich hier nur einen skizziert habe: Es blockiert das Enzym, das Succinat normalerweise in das nächste Zwischenprodukt des Zyklus umwandelt („Stop!“). Der Zitratzyklus wird an dieser Stelle zwar nicht komplett auseinandergerissen, aber doch gestört:
Sobald die akute Gefahr (etwa ein Krankheitserreger) niedergerungen ist, wechseln die Makrophagen in einen antiinflammatorischen, also entzündungshemmenden Modus. Nun wird die Glykolyse herunter- und der Zitratzyklus hochgefahren. Da das Pyruvat nicht mehr als Ausgangssubstanz für alle möglichen Bau- und proinflammatorischen Wirkstoffe benötigt wird, kann es in den Zitzratzyklus einfließen. Entsprechend viel Itaconat entsteht nun. Dieser Signalstoff hemmt Entzündungen auf mehreren Wegen, von denen ich hier nur einen skizziert habe: Es blockiert das Enzym, das Succinat normalerweise in das nächste Zwischenprodukt des Zyklus umwandelt („Stop!“). Der Zitratzyklus wird an dieser Stelle zwar nicht komplett auseinandergerissen, aber doch gestört:
 Wie funktioniert diese Enzymblockade, und was bewirkt sie? Enzyme haben eine spezifische Andockstelle, an die ihr Substrat binden muss, damit es umgewandelt werden kann. Das Enzym Succinat-Dehydrogenase (kurz SDH) hat eine faszinierende, einzigartige Doppelfunktion: Anders als die übrigen Enyzme des Zitratzyklus hält es sich nicht im Inneren der Mitochondrien auf, sondern ist in die innere Mitochondrienmembran eingebettet.
Wie funktioniert diese Enzymblockade, und was bewirkt sie? Enzyme haben eine spezifische Andockstelle, an die ihr Substrat binden muss, damit es umgewandelt werden kann. Das Enzym Succinat-Dehydrogenase (kurz SDH) hat eine faszinierende, einzigartige Doppelfunktion: Anders als die übrigen Enyzme des Zitratzyklus hält es sich nicht im Inneren der Mitochondrien auf, sondern ist in die innere Mitochondrienmembran eingebettet.
Normalerweise oxidiert es Succinat zu Fumarat, dem nächsten Zwischenprodukt des Zyklus. Die energiereichen Elektronen, die dabei frei werden, transportiert es durch die Membran. Es ist also zugleich einer der Enzymkomplexe der oxidativen Phosphorylierung: Komplex II. Bei diesem Elektronentransport entstehen auch reaktive Sauerstoffspezies (kurz ROS; das O stammt aus dem englischen oxygen):
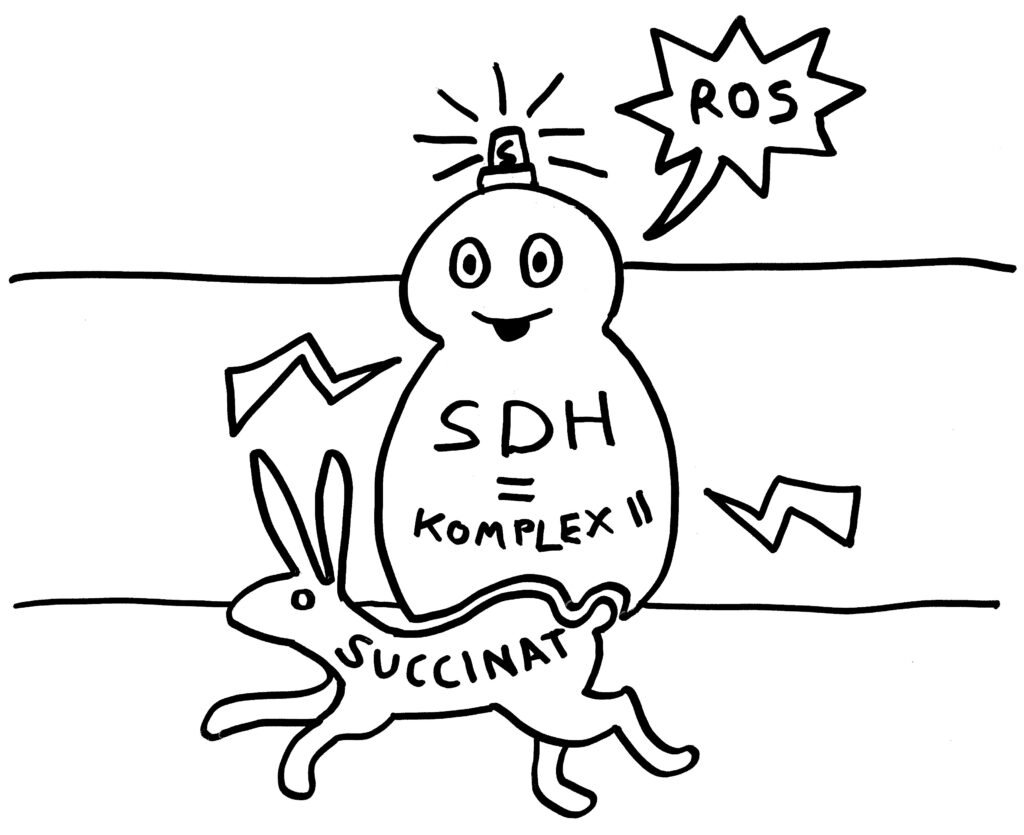 ROS im Übermaß können viel Schaden anrichten, vor allem, wenn sie aus beschädigten Mitochondrien oder Zellen austreten. In Maßen sind sie aber essenzielle Botenstoffe der Entzündungsreaktionen in den Immunzellen.
ROS im Übermaß können viel Schaden anrichten, vor allem, wenn sie aus beschädigten Mitochondrien oder Zellen austreten. In Maßen sind sie aber essenzielle Botenstoffe der Entzündungsreaktionen in den Immunzellen.
Itaconat hat eine eine ganz ähnliche Struktur wie Succinat. Im Normalbetrieb und zu Beginn einer Entzündungsreaktion gibt es fast kein Itaconat in den Makrophagen-Mitochondrien; die Succinat-Dehydrogenase kann normal arbeiten. Aber sobald das Mitochondrium genug Itaconat produziert hat, verdrängt dieses das Substrat Succinat von der SDH-Bindungsstelle. Das Enzym kann Itaconat aber nicht oxidieren, somit auch keine energiereichen Elektronen durch die Membran transportieren und keine ROS produzieren:
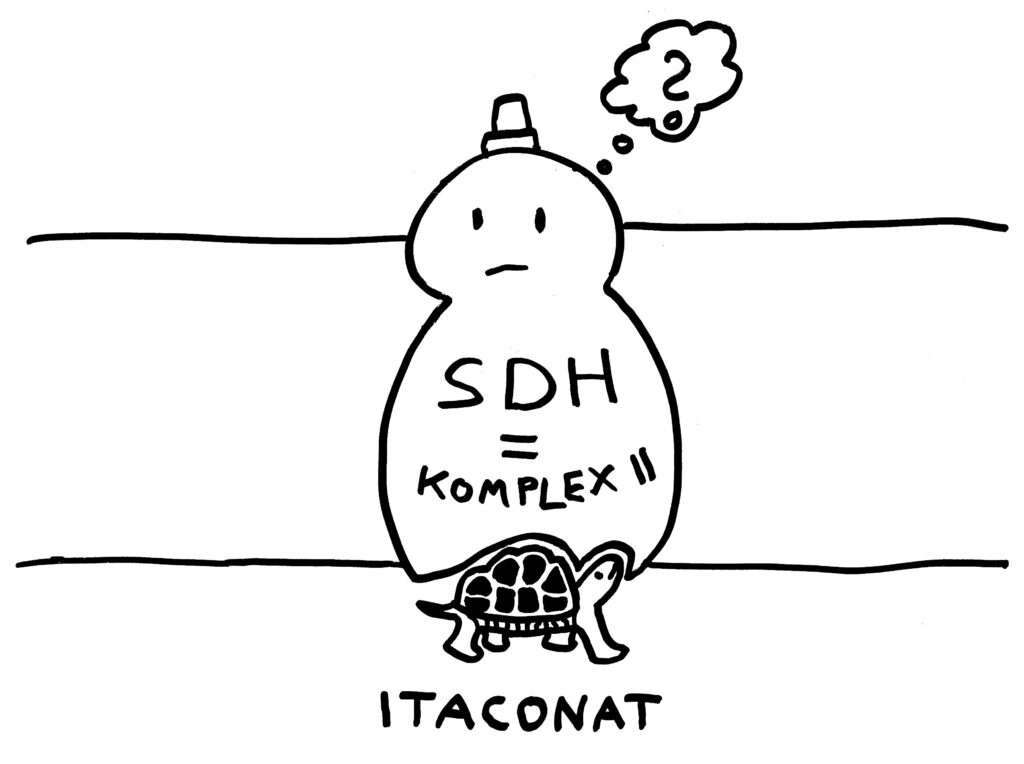 Ohne ROS wiederum kommen die Entzündungsreaktionen zum Erliegen. Die Makrophagen schalten allmählich von einem pro- zu einem antiinflammatorischen Programm um. Ab jetzt sind Reparaturen und Aufräumarbeiten abgesagt, um die Homöostase – den gesunden Gleichgewichtszustand – der Zellen, der Gewebe und des ganzen Organismus wieder herzustellen.
Ohne ROS wiederum kommen die Entzündungsreaktionen zum Erliegen. Die Makrophagen schalten allmählich von einem pro- zu einem antiinflammatorischen Programm um. Ab jetzt sind Reparaturen und Aufräumarbeiten abgesagt, um die Homöostase – den gesunden Gleichgewichtszustand – der Zellen, der Gewebe und des ganzen Organismus wieder herzustellen.
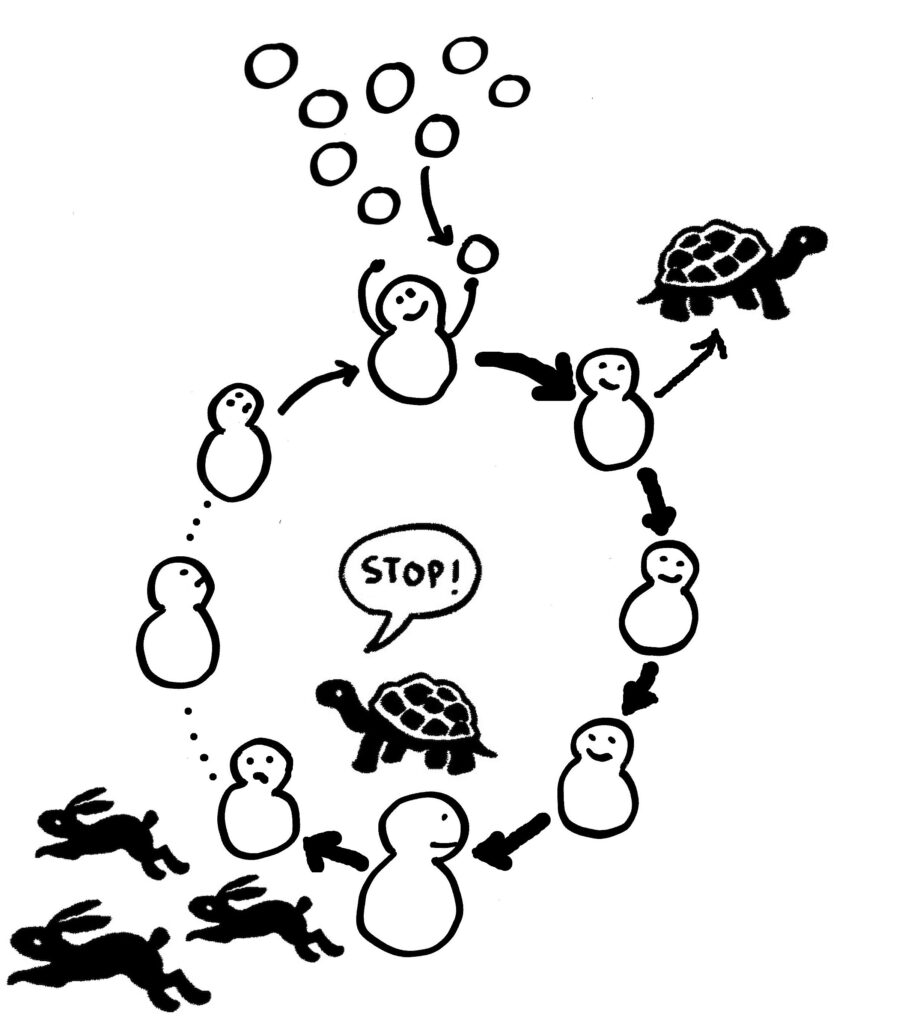
Dieses Prinzip der Selbstregulierung von Immunreaktionen ist weit verbreitet: Ein Anstoß von außen – etwa ein Signal, das auf eine Infektion hinweist – bringt zwei Prozesse in Gang, einen schnellen (Hase) und einen langsamen (Schildkröte). Auf dem schnellen Weg werden eine Zeit lang energische Abwehrmaßnahmen ergriffen, etwa entzündungsfördernde Substanzen produziert und ausgeschüttet. Mit einer gewissen Verzögerung (zum Beispiel, weil ein dafür nötiges Enzym erst hergestellt werden muss) sorgt der langsamere Prozess dafür, dass diese energische, aber auch gefährliche Reaktion rechtzeitig beendet wird. Und genau dieser zweite Schritt versagt bei bestimmten chronischen Entzündungen und Autoimmunerkrankungen.
Aber wie bereits im vorigen Artikel angemerkt: Skepsis ist angesagt gegenüber überstürzten Versuchen, chronische Entzündungen durch Stärkung des zweiten, langsameren Prozesses zu stoppen, etwa durch den Einsatz künstlicher Itaconat-Derivate. Denn diese Wirkstoffe würden nicht nur in überaktiven proinflammatorischen Makrophagen in den Mitochondrien-Stoffwechsel und weitere Prozesse wie die Gen-Ablesung im Zellkern eingreifen, sondern auch in anderen Immunzellen und sonstigen Zellen – und das kann richtig gefährlich werden. Außerdem entgleist der Immunzellstoffwechsel offenbar nicht bei jeder Autoimmunerkrankung auf dieselbe Weise. Daher gilt immer noch, was ich 2023 schrieb: Vorsicht mit der Mitochondrien-Manipulation.