Vor einigen Monaten habe ich hier Krebs aus evolutionsbiologischer Perspektive beleuchtet. Der ziemlich ausführlich geratene Artikel sollte ursprünglich nur eine Hinleitung zum heutigen Thema werden: zu den Schnittmengen von Autoimmunreaktionen und Krebserkrankungen. Höchste Zeit, den Bogen zu vollenden.
Paraneoplastische Autoimmunerkrankungen
Die systemische Sklerose ist eine Autoimmunerkrankung, bei der sich nicht nur die Haut verändert wie bei einer zirkumskripten Sklerodermie oder Morphea, sondern auch innere Organe angegriffen werden. Vor allem die Blutgefäße entzünden sich, und es kommt zu Bindegewebswucherungen (Fibrosen), die die Funktion der Organe beeinträchtigen und sehr schmerzhaft werden können. Einer Forschergruppe um Anthony Rosen aus Baltimore fiel vor einigen Jahren auf, dass relativ viele – insbesondere ältere – Menschen mit systemischer Sklerose kurz vor oder nach dieser Diagnose auch an Krebs erkranken, beispielsweise an Brustkrebs. Ähnliche Häufungen war früher bereits bei Dermatomyositis und anderen Autoimmunerkrankungen aus dem rheumatischen Formenkreis beobachtet worden, etwa bei Vaskulitiden, also Blutgefäß-Entzündungen, oder systemischem Lupus erythematodes. Autoimmunerkrankungen, die kurz vor, während oder nach Krebserkrankungen auftreten, bezeichnet man als paraneoplastisch (wörtlich „neben Neubildungen“, also gleichzeitig mit Tumoren).
Was kam zuerst?
Nun könnte eine bereits ausgebrochene Autoimmunerkrankung das Immunsystem so schwächen oder eine Therapie gegen diese Erkrankung so viele Mutationen auslösen, dass daraufhin die Krebsgefahr steigt. Das passt aber schlecht zu den Zeitverläufen und Begleitumständen, die Rosen und seine Kolleginnen bei den Patienten beobachtet haben. Daher stellten sie eine Gegenhypothese auf, bei der die Autoimmunreaktionen nicht Ursache, sondern Folge von Krebsvorstufen sind. Die „fremden“ Antigene, die die Autoimmunreaktionen und damit letztlich die systemische Sklerose auslösen, sollen also nicht von Krankheitserregern oder anderem körperfremden Material (etwa aus der Nahrung) stammen, sondern aus veränderten Körperzellen: aus Vorläufern von Tumorzellen.
Denn wie die Immunologin Polly Matzinger im Zuge ihrer danger theory immer wieder betont: Das Immunsystem dient bei weitem nicht nur der Bekämpfung von Bakterien, Viren und anderen äußeren Feinden, sondern der Abwehr von Gefahren aller Art – unter anderem Krebs. Wenn Immunzellen krankhaft veränderte Körperzellen erkennen, lösen sie Alarm aus. Das Immunsystem greift alle derartigen Zellen an, um ihre Ausbreitung zu verhindern oder den mutierten Zellklon sogar ganz zu vernichten, bevor daraus endgültig ein nicht mehr beherrschbarer Tumor entsteht.
Unreife gesunde Zellen auf der Fahndungsliste
Bei einigen Patienten mit Krebs und systemischer Sklerose ist das Gen POLR3A mutiert, in dem das Autoantigen RPC1 codiert ist. Dieses Protein ist ein Baustein einer RNA-Polymerase: eines Enzyms, das an der Ablesung von Genen, also an der Herstellung von RNA nach dem Vorbild eines DNA-Abschnitts beteiligt ist. Das Enzym kommt im ganzen Körper vor, insbesondere in unreifen Zellen, die vor allem bei der Wundheilung gehäuft auftreten – etwa in den Wänden von Blutgefäßen.
Die mutierte Form wird dagegen nur von Krebsvorläuferzellen hergestellt, und zwar in großen Mengen. Diese Kombination – ein ungewöhnliches Antigen, das außergewöhnlich stark exprimiert wird – ist es wohl, die das Immunsystem alarmiert: Zahlreiche patrouillierende Antigen-präsentierende Zellen, etwa dendritische Zellen oder Makrophagen, nehmen das Antigen auf und präsentieren es in großem Stil den T-Zellen. So werden die passenden T-Zellen aktiviert, sie vermehren sich und aktivieren ihrerseits B-Zellen, die dann Massen von Antikörpern gegen die Antigene herstellen.
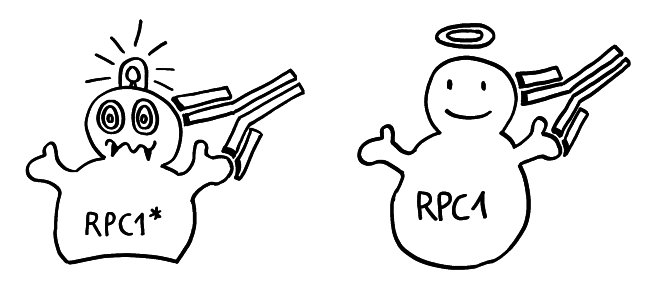
Kreuzreaktivität: Antikörper gegen ein mutiertes Protein binden u. U. auch an das unveränderte Protein. So kann aus einer Immun- eine Autoimmunreaktion werden.
Die Forscher stellten fest, dass solche Autoantikörper im Blut der Sklerodermie-Patienten nicht zwischen der mutierten und der normalen Version von RPC1 unterscheiden, sondern beide angreifen. Offenbar binden die Antikörper nicht an die mutierte Stelle des Enzymbausteins, sondern an eine andere Stelle, die bei beiden RPC1-Varianten identisch ist. Entstehen darüber hinaus auch langlebige autoreaktive Gedächtnis-T- oder -B-Zellen, laufen die Autoimmunattacken auf unreife gesunde Zellen auch dann weiter, wenn das Immunsystem die Krebsvorstufen erfolgreich beseitigt hat. So kommt es zur Schädigung von Blutgefäßen, Haut und inneren Organen.

Von der Krebsvorstufe zur Autoimmunerkrankung: 1 Eine Zelle wird zur Krebsvorläuferzelle (Transformation) und produziert sehr viel von einem für unreife Zellen typischen Protein. 2 Eine Mutation in einer solchen Zelle verändert das Protein. 3 Im Tumor kommen Zellen mit der Mutation und solche mit dem Wildtyp vor. 4 Aus den mutierten Zellen wird (z. B. wenn sie sterben) das veränderte Protein freigesetzt. 5 Antigen-präsentierende Zellen nehmen dieses Antigen auf und präsentieren es zusammen mit Kostimulationssignalen. 6 Das Antigen wird wegen seiner Fremdartigkeit als gefährlich eingestuft und aktiviert das Immunsystem. 7 Die aktivierten Effektorzellen bekämpfen den Tumor; dabei treten weitere Proteine aus – sowohl veränderte als auch unveränderte. 8 Auch das normale Protein wird nun als Antigen präsentiert. 9 Im Kontext der laufenden Immunreaktion wird auch das normale Autoantigen als gefährlich eingestuft; autoreaktive Effektorzellen werden aktiviert. 10 Fernab vom Tumor, zum Beispiel in Blutgefäßwänden, produzieren unreife Zellen dasselbe Antigen und werden damit zum Ziel der Abwehr. 11 Die Effektorzellen greifen die unreifen Zellen an und setzen so noch mehr der Autoantigene frei, auf die sie reagieren. 12 Dieser Teufelskreis läuft auch weiter, wenn der Tumor längst verschwunden ist: Die Autoimmunerkrankung hat sich etabliert.
Reizüberflutung
Woher aber kommen die ersten Effektorzellen, die hier (in Schritt 9) auf das normale körpereigene Antigen, etwa auf das Protein RPC1 reagieren? Eigentlich sollten solche autoreaktiven T- und B-Zellen bereits in unserer Kindheit im Thymus eliminiert werden, im Zuge der zentralen Toleranzinduktion. Aber kein System arbeitet fehlerfrei: Ein paar autoreaktive Effektorzellen gelangen doch in Umlauf. Normalerweise sind sie harmlos: Wenn „ihr“ Autoantigen in ihrer Umgebung nur vereinzelt vorkommt, bleibt der Reiz unterhalb ihrer Aktivierungsschwelle. Wird die Umgebung jedoch mit dem Autoantigen überschwemmt, etwa weil bei einer Entzündung oder bei der Tumorbekämpfung viele Zellen absterben und „auslaufen“, erwachen die wenigen autoreaktiven Immunzellen aus ihrem Schlummer, schlagen Alarm und vermehren sich.
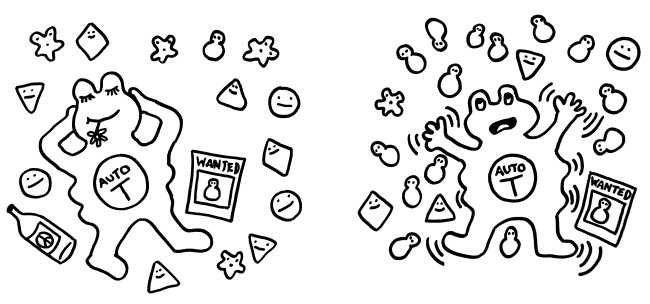
Vereinzelte autoreaktive Immunzellen bleiben friedlich, solange „ihr“ Autoantigen selten ist. Große Mengen dieses Antigens aktivieren sie dagegen.
Gelegentliche Pyrrhussiege
Patienten mit einer paraneoplastischen Autoimmunerkrankung, also zum Beispiel systemischer Sklerose und Brustkrebs, wären demnach Fälle, in denen das Immunsystem den Krebs nicht besiegen konnte. Oft sind die Tumoren dieser Patienten aber kleiner als die ähnlicher Betroffener ohne Autoimmunstörung; die Immunreaktion gegen die Tumor-Antigene hat also durchaus etwas bewirkt. Das Immunsystem von Patienten, die „nur“ unter ihrer Autoimmunerkrankung leiden, hat laut Rosen und seinem Team die Krebs-Vorstufen komplett beseitigt, bevor sie auffällig wurden.
Wie aber passen die vielen Patientinnen und Patienten ins Bild, die zwar Krebs, aber keine bekannte Autoimmunerkrankung haben? Auch bei ihnen könnte es laut Rosen und seinem Team in der Vergangenheit Immunreaktionen gegen mutierte Autoantigene in Krebsvorläuferzellen gegeben haben. Die Abwehrreaktionen hat einen Selektionsdruck auf die Zellklone ausgeübt und so die Zusammensetzung des entstehenden Tumors verändert. Bei diesem sogenannten Immun-Editing verschwinden Zellklone, die vom Immunsystem gut erkannt und effektiv bekämpft werden, während andere (Prä-)Tumorzellen, die nicht so leicht zu erkennen sind, der Abwehr entwischen und sich dann zu Krebs auswachsen.
Ist ein Klon mit mutierten Antigenen erst einmal eliminiert, flaut die Immunreaktion ab. Sofern noch keine Kreuzreaktionen mit der unmutierten Autoantigen-Variante aufgetreten sind, die im restlichen Körper vorkommt, kann das immunologische Gedächtnis die vorübergehende Autoimmunreaktion vergessen.
Beide Extremfälle kann man als Pyrrhussiege auffassen: Manchmal besiegt unser Immunsystem zwar den Krebs, bevor er gefährlich wird, bekämpft aber für den Rest des Lebens gesunde, unreife Zellen, weil es sie fälschlich für gefährlich hält. Und manchmal vernichtet unser Immunsystem zwar einen frühen mutierten Zellklon in einem entstehenden Tumor, schafft aber gerade dadurch anderen, noch gefährlicheren Zellklonen Platz. Dann erlischt zwar die Autoimmunreaktion, aber der Krebs wächst heran. Aber bei den allermeisten Menschen scheint das System ganz gut zu funktionieren: Ohne dass sie etwas davon ahnen, treten in ihnen Krebsvorstufen auf, die durch vorübergehende und damit ungefährliche Autoimmunreaktionen ausgemerzt oder so weit eingehegt werden, dass die Tumoren „okkult“ bleiben, also verborgen.
Cave!
Bei all diesen Überlegungen – auch in der „Begleitmusik“ zu den Publikationen des Rosen-Teams, etwa bei Science oder wiederholt bei The Scientist – darf eines nicht vergessen werden: Bisher wurden die Zusammenhänge zwischen systemischer Sklerose und Krebs nur an wenigen Menschen untersucht. Systemische Sklerose ist zum Glück selten, etwa gleichzeitig auftretender Krebs noch viel seltener. Einige der Schlussfolgerungen der Forscher beruhen auf einer guten Handvoll, andere Mutmaßungen sogar auf einem einzigen Fall. Ob dies wirklich die Keimzelle eines neuen Paradigmas zur Verursachungen systemischer Autoimmunerkrankungen ist: tja.
Klar ist, dass sehr viele Krebserkrankungen mit der Produktion von Autoantikörpern einhergehen. Ob diese Autoantikörper wirklich zur körpereigenen Krebsabwehr oder aber zur Gegenstrategie der Tumoren gehören oder doch eher Epiphänomene sind, die bestenfalls als frühe diagnostische Marker für bestimmte Krebstypen taugen, bleibt abzuwarten.
Literatur:
Christine G. Joseph et al. (2914): Association of the Autoimmune Disease Scleroderma with an Immunologic Response to Cancer (Open Access)
Ami A. Shah et al. (2015a): Cancer-induced autoimmunity in the rheumatic diseases (Open Access)
Ami A. Shah et al. (2015b): Examination of autoantibody status and clinical features that associate with cancer risk and cancer-associated scleroderma (Open Access)
Pauline Zaenker et al. (2016): Autoantibody production in cancer – The humoral immune response towards autologous antigens in cancer patients
