Vor gut zwei Jahren bin ich meinem Vorsatz untreu geworden und habe mich im Blog zu COVID-19 geäußert – weil die Schnittmenge dieses Themas zu meinem, der Biologie der Autoimmunerkrankungen, nicht mehr zu übersehen war.
Zeit für ein kurzes Update! Kurz, weil ich einfach auf eine gute Übersicht in The Scientist verweisen kann, die diese Woche erschienen ist. In ihrem Artikel stellt Natalia Mesa die wichtigsten Mechanismen vor, die zu anhaltenden Symptomen unterschiedlichster Natur noch lange nach der akuten Infektion mit Sars-CoV-2 führen könnten: chronische Entzündungen, durch die Konfrontation mit dem Virus ausgelöste Autoimmunreaktionen, persistierende, also irgendwo im Körper weiterbestehende Viren, Veränderungen im Endothel, also der Auskleidung der Blutgefäße, und schließlich Mikrothrombosen: kleine Klumpen im Blut.
Diese Erklärungsansätze schließen einander nicht aus. Beispielsweise gehen chronische Entzündungen (fehlgeleitete angeborene Abwehr) und Autoimmunreaktionen (fehlgeleitete erworbene Abwehr) oft miteinander einher, wobei die Richtung der Verursachung unklar bleiben kann. Es kann auch sein, dass Long COVID ein grob gezimmertes Dach ist, unter das die Medizin derzeit mehrere Teilpopulationen von Betroffenen setzt, bei denen unterschiedliche Mechanismen zugeschlagen haben. Die Zukunft wird es zeigen.
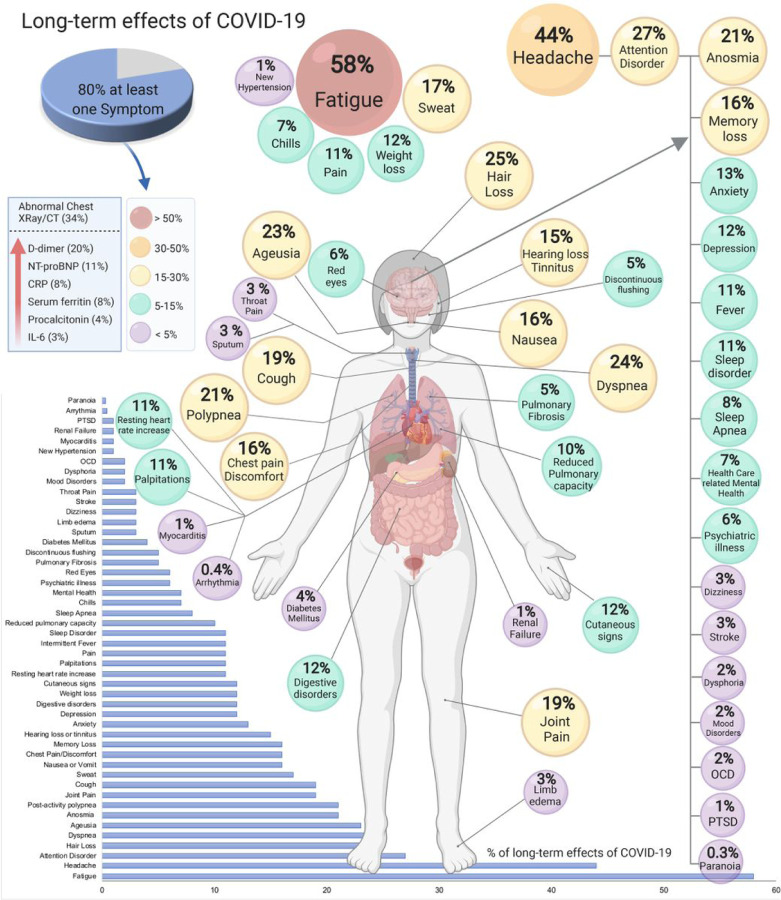
In einer noch nicht begutachteten Übersichtsarbeit über gut 50 typische Long-COVID-Symptome von Lopez-Leon et al. führt übrigens ein Symptom mit großem Abstand: Fatigue.
Wie neulich schon in Sachen Stammhirn- und Hypothalamus-Neuronen geschrieben, stellt sich die Frage, auf welchem Wege die SARS-Cov-2-Infektion bzw. die Immunreaktion darauf eine Veränderung im zentralen Nervensystem auslöst. Mesa nennt ein mögliches Bindeglied: Die zu den Immunzellen zählenden Mikrogliazellen, die unsere Nervenzellen beschützen sollen, könnten durch Botenstoffe in einen überaktiven Zustand versetzt werden, in dem sie den Nervenzellen Schaden zufügen.