 Notizen zu zwei Artikeln der Arbeitsgruppe um Ajit Varki (Menschwerdung, Coevolution mit Malaria-Erregern usw.), v. a.
Notizen zu zwei Artikeln der Arbeitsgruppe um Ajit Varki (Menschwerdung, Coevolution mit Malaria-Erregern usw.), v. a.
Tho Pham et al.: Evidence for a novel human-specific xeno-auto-antibody response against vascular endothelium. Blood 114(25), 2009, doi: 10.1182/blood-2009-05-220400
Varki 2012: Eine Sialinsäure, die vor allem in rotem Fleisch vorkommt und vom Menschen aufgrund einer Mutation nach der Abspaltung vom Schimpansen-Ast des Stammbaums nicht mehr hergestellt wird, wird bei Fleisch essenden Menschen ins Gewebe (genauer: in die Glycoproteine der Zellmembranen) eingebaut und ruft die Bildung von Xenoautoantikörpern („Fremd-Selbst-Antikörpern“) hervor, die Entzündungen verstärken können.
[Sialinsäuren = N– und O-Derivate der Neuraminsäure (Acylneuraminsäure), bilden oft die Endglieder der Zuckerreste der Glykoproteine auf allen Wirbeltier-Zellmembranen]
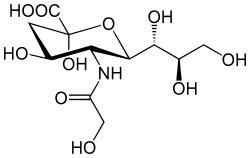
Pham et al 2009: Menschen können die bei Säugetieren weit verbreitete Sialinsäure N-Glycolylneuraminsäure (Neu5Gc, siehe Bild) nicht synthetisieren. Dennoch findet man bei Menschen oft (gelegentlich in hoher Konzentration) polyklonale Antikörper gegen Neu5Gc. Die Autoren haben Neu5Gc im menschlichen Endothel (Auskleidung der Blutgefäße) nachgewiesen; es stammt vermutlich aus rotem Fleisch. Hypothese: Die Kombination aus NeuGc5-Einbau und Bildung von Anti-NeuGc5-Antikörpern kann eine Endothelaktivierung induzieren. Experiment: Antikörperreiche Seren mit Kulturen von Endothelzellen, die Neu5Gc eingebaut hatten -> Antikörperbindung, Endothelaktivierung, Selektinexpression, erhöhte Zytokinausschüttung und Monozytenbindung. Das entzündungsfördernde Zytokin TNF-α erhöht selektiv die Anti-Neu5Gc-Antikörper-Aktivität. Dieser Mechanismus könnte zu Gefäßerkrankungen beim Menschen beitragen. Bei Atherosklerose (Arteriosklerose) kommt Neu5Gc sowohl im Endothel über den Plaques als auch in den Subendothelschichten vor; es könnte die Enzündungsreaktionen bei dieser Erkrankung also auf vielen Wegen beschleunigen.
Beim Vorfahren des Menschen wurde das Gen für die Hydroxylase CMAH, die die Vorläufersubstanz Neu5Ac in Neu5Gc umwandelt, vor 2-3 Millionen Jahren durch Mutation zum Pseudogen. In Schimpansen und den übrigen Säugern kommen dagegen beide Substanzen vor. Unsere Biochemie kann nicht zwischen Neu5Ac und Neu5Gc unterscheiden (Unterschied: nur ein Sauerstoffatom) und baut daher exogenes Neu5Gc aus der Nahrung in menschliche Zelloberflächen ein. Rotes Fleisch ist besonders Neu5Gc-reich und wird zugleich mit Entzündungsmarkern im Kreislauf in Verbindung gebracht, die auf Endothel-Dysfunktion hinweisen.
Obwohl biochemisch gleichwertig, wird Neu5Gc vom Immunsystem als fremd erkannt -> Produktion hochspezifischer Antikörper (IgG und IgM) gegen diverse Neu5Gc-Epitope, die man auf Endothelzellen findet.
Endothelaktivierung kommt bei vielen Krankheiten vor. Antikörpervermittelte Endothelschäden werden z. B. bei primärer Autoimmun-Vaskulitis, systemischen Autoimmunerkrankungen mit Gefäßeinbeziehung und sowohl frühen als auch späten Stadien der Atherosklerose beschrieben. Die Prävalenz von Anti-Endothelzell-Antikörpern (AECA) korreliert auch mit der Intensität von SLE (Lupus).
Die bislang identifizierten AECA-Epitope sind Proteine, die von Endothelzellen entweder konstitutiv exprimiert oder bei Endothelaktivierung oder Entzündung hochreguliert werden. Autoren vermuten, dass der Einbau von Neu5Gc aus der Nahrung in die Glykoproteine der Endothelzelloberfläche eine solche Immunreaktion auslöst. Das ist der erste bekannte Fall eines „Xenoautoantigens“, das Autoimmmunattacken ausklösen lann.
Viel Neu5Gc in Lamm, Schwein und Rind sowie Milchprodukten, wenig in Geflügel und Fisch, keines in pflanzlicher Kost.
Entzündung des Endothels -> sehr rasche Hochregulierung des Adhäsionsmoleküls P-Selektin, danach auch Präsentation von E-Selektin -> rolling adhesion von Leukozyten an den Gefäßwänden (nur in Gegenwart der AECA). Außerdem Hochregulierung von Zytokinen in den aktivierten Endothelzellen -> Monozyten angelockt -> Makrophagen; Entzündungsförderung durch IL-12 p70, Il-12 p40, IL-1α, IFNγ. Komplementbindung kann Endothel weiter schädigen.
Zirkulierende Blutzellen exprimieren kein Neu5Gc, auch nach massiver Einnahme nicht (Versuch mit Freiwilligen). Einige Neu5Gc-Epitope sind viel wirksamer als andere, außerdem individuelle Unterschiede im Ausmaß der Komplementablagerung (evtl. Hinweis auf verschiedene IgG-Unterklassen). Konjugation eines Protein-Antigens an einen Zucker kann Produktion von Antikörpern gegen das Protein selbst verstärken, ohne dass ein Adjuvans nötig wäre: Die entstehenden Immunkomplexe übernehmen die Rolle des Adjuvans. Daher könnten Antikörper, die an Neu5Gc auf Endothel-Proteinen binden, sogar eine sekundäre Immunreaktion gegen diese Protein-Antigene auslösen. [Das wäre epitope spreading, oder?]
Nachtrag: Hintergrundinformationen über die Evolution der Sialinsäure-Gene beim Menschen gibt es hier.

Hallo, ich habe mich die letzte Zeit vermehrt mit SIGLECs und Sialinsäuren beschäftigt, habe es allerdings nicht geschafft, alles zu verstehen und durchzusteigen. Die Forschungsergebnisse sind wirklich ein Hammer. Vielleicht können Sie mir ein bisschen weiterhelfen. Ich erwarte nicht auf alles eine Antwort, aber wenn Sie etwas parat haben, nur zu:
Das menschliche Immunsystem kann zwar Neu5GC registrieren (Antikörperbildung etc.), aber nicht wirksam bekämpfen/abwehren. Warum?
Soweit ich an anderer Stelle gelesen habe, binden Pathogene der Säugetiere (E. Coli etc.) an SIGLEC 5 und 12. Wenn wir rotes Fleisch und Milch verzehren, nehmen wir beide SIGLECs auf. Diese lässt das menschliche System ungehindert passieren (da er sie nicht als fremd erkennnt?), wodurch sich die Keime bei uns einnisten können und wir uns latent infizieren. Z.B. werden bei Alzheimer-Kranken Infektionsherde im Gehirn gefunden; dies wäre ein möglicher Infektionsweg.
Warum kann der Körper diese fremden SIGLECs nicht erkennen?
Warum hat der Mensch vor 2-3 Mio. Jahren SIGLECs verloren, obwohl sie ihm ein wichtiges Erkennungstool für die Immunabwehr sind? Warum verstecken sich unter anderen SIGLECs, die sowohl bei Menschen als auch anderen Säugetieren vorhanden sind, keine für den Menschen gefährlichen Keime?
Danke! Vielleicht könne Sie mir einige Hinweise geben.
Hallo Erik,
ich bitte die späte Antwort zu entschuldigen: Ich war auf Reisen. In den aktuellen Wissensstand zu den SIGLECs muss ich mich erst wieder einlesen; der Artikel ist ja anderthalb Jahre alt. Eines aber schon jetzt: Der Mensch hat im Lauf seiner Evolution mehrfach Immungene eingebüßt. Das hing z. T. mit einem Lebensraumwechsel zusammen (Savanne statt Wald -> geringerer Pathogendruck) und z. T. mit der Entstehung des Sprachvermögens: Viele Funktionen von Immungenen (Erkennung und Abwehr von Risiken ….) wurden durch die Sprache abgelöst.
Hallo Erik,
zur Frage, warum nützliche Siglecs verloren gehen, habe ich jetzt nach Lektüre einer neuen Arbeit von Padler-Karavani et al. (2013) eine Erklärung versucht: http://autoimmunbuch.de/?p=3662
Pingback: Anonym