Für ein Buchkapitel, das Laien an die Grundlagen der Regulierungsnetzwerke in Lebewesen und insbesondere im Immunsystem heranführen soll, sind am Wochenende einige Skizzen entstanden.
Lebewesen sind selbstregulierende Systeme. Im einfachsten Fall geht es darum, dass eine Größe wie die Temperatur oder die Konzentration einer chemischen Substanz an einem bestimmten Ort innerhalb eines bestimmten Spektrums liegen soll. Ist der Wert zu niedrig, wird nach das System hochreguliert; ist er zu hoch, wird heruntergeregelt – wie beim Heizen ohne Thermostat:
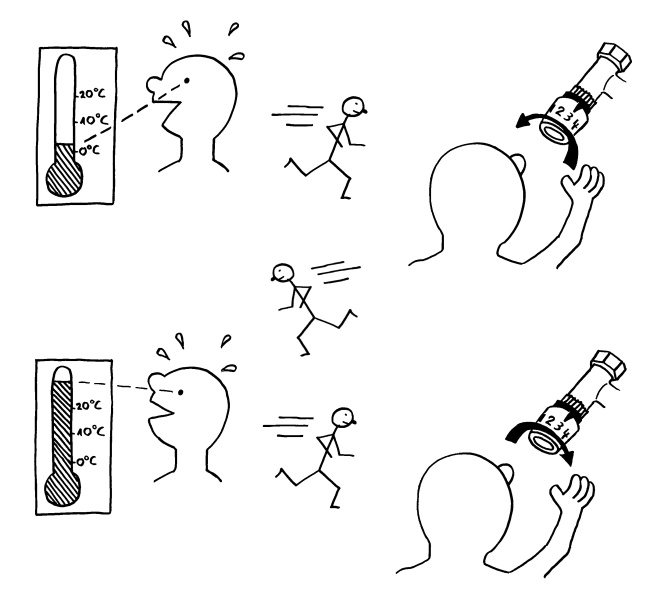 Genau wie das Einstellen der Heizung in Rennerei ausarten kann, kommt es auch in biologischen Regelsystemen wegen Zeitverzögerungen leicht zum Überschießen, sodass ständig nachgeregelt werden muss. Außerdem beeinflussen oft mehrere veränderliche Parameter die jeweilige Größe – so, wie die Temperatur an einem Ort unter anderem von der Sonneneinstrahlung, der Wohnbebauung, Wind und Schneefall abhängt:
Genau wie das Einstellen der Heizung in Rennerei ausarten kann, kommt es auch in biologischen Regelsystemen wegen Zeitverzögerungen leicht zum Überschießen, sodass ständig nachgeregelt werden muss. Außerdem beeinflussen oft mehrere veränderliche Parameter die jeweilige Größe – so, wie die Temperatur an einem Ort unter anderem von der Sonneneinstrahlung, der Wohnbebauung, Wind und Schneefall abhängt:
 Positive Einflüsse (Erhöhung, Aktivierung usw.) kann man mit einem Pluszeichen und negative Einflüsse (Verringerung, Hemmung usw.) mit einem Minuszeichen kennzeichnen. Oft verzichtet man auf Vorzeichen; dann steht ein normaler Pfeil für einen positiven Einfluss und ein in einem Querstrich endender Pfeil für einen negativen Einfluss – wie in dem Netzwerk links oben in der nächsten Zeichnung:
Positive Einflüsse (Erhöhung, Aktivierung usw.) kann man mit einem Pluszeichen und negative Einflüsse (Verringerung, Hemmung usw.) mit einem Minuszeichen kennzeichnen. Oft verzichtet man auf Vorzeichen; dann steht ein normaler Pfeil für einen positiven Einfluss und ein in einem Querstrich endender Pfeil für einen negativen Einfluss – wie in dem Netzwerk links oben in der nächsten Zeichnung:
Die Substanz A wird hier durch mehrere andere Substanzen beeinflusst, deren Anwesenheit sie aktiviert oder ihre Produktion ankurbelt. Da diese Substanzen umgekehrt auch durch die Substanz A beeinflusst werden und sich gegenseitig beeinflussen, sind die Folgen eines solchen Stoffwechsel- oder Signalnetzwerks aus einem abstrakten Diagramm nicht zu ersehen: Die Einflüsse sind unterschiedlich stark, werden unterschiedlich schnell wirksam und halten verschieden lang an. Die Folge kann zum Beispiel ein charakteristisches Schwanken der Substanzmenge sein (Kurve oben rechts). Dieses Auf und Ab kann wiederum als komplexes Signal auf andere Elemente in einem Organismus oder einer Zelle einwirken. Biologische Signale sind nur selten binär („an“ oder „aus“); meistens kommt es auf ihr genaues zeitliches und räumliches Muster an.
Zum Beispiel kann es sein, dass einige der Substanzen, die im Prinzip mit A wechselwirken können, gar nicht im selben Raum oder Kompartiment vorliegen. Die Skizze der Zelle (Mitte links) zeigt es: Wenn sich C, D und F außerhalb einer Zelle befinden, A von Kanälen in der Zellmembran auch in die Zelle eingeschleust werden kann und B und E nur im Zytoplasma bzw. – nach dem Transport durch eine Kernpore – im Zellkern vorkommen, zerfällt das Netzwerk in zwei Teile (Mitte rechts). B kann C also gar nicht aktivieren.
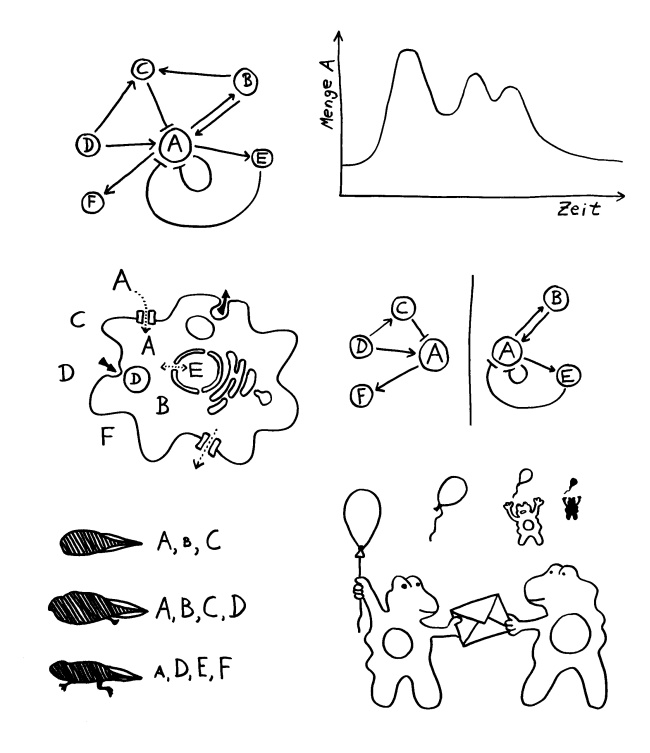 Substanz D kann zwar durch Phagozytose von der Zelle aufgenommen werden, ist dann aber von einer Vesikelmembran umgeben und daher von A, B und C isoliert. Obwohl D besonders tief im Zellinneren zu liegen scheint, ist es der Außenwelt im Grunde näher als B oder E. Das Innere von Vesikeln, die mit der Zellmembran oder miteinander verschmelzen können, sich aber niemals einfach ins Zytoplasma ergießen, ist gewissermaßen eine „Parallelgesellschaft“ innerhalb der Zelle.
Substanz D kann zwar durch Phagozytose von der Zelle aufgenommen werden, ist dann aber von einer Vesikelmembran umgeben und daher von A, B und C isoliert. Obwohl D besonders tief im Zellinneren zu liegen scheint, ist es der Außenwelt im Grunde näher als B oder E. Das Innere von Vesikeln, die mit der Zellmembran oder miteinander verschmelzen können, sich aber niemals einfach ins Zytoplasma ergießen, ist gewissermaßen eine „Parallelgesellschaft“ innerhalb der Zelle.
Noch komplizierter werden die biologischen Signal- und Regelnetzwerke durch ihre Veränderung im Lauf der Entwicklung eines Organismus: Wie anhand der drei Kaulquappenstadien symbolisiert, werden bestimmte Botenstoffe erst im Laufe der Entwicklung synthetisiert und verschwinden später, wenn sie ihre Aufgabe erfüllt haben, wieder von der Bildfläche, sodass das System (z. B. ein Hormonystem) mehrmals neue Gleichgewichtszustände aus aktivierenden und hemmenden Einflüssen annimmt.
Die Zellen unten rechts im vorigen Bild sollen zeigen, dass manche Botenstoffe oder Signale (Kuvert) nur auf kurze Distanz wirken, zum Beispiel weil sie aus lokalen elektrischen oder chemischen Gradienten an einer Zellmembran oder aus instabilen chemischen Verbindungen bestehen, die kurz nach ihrer Freisetzung zerfallen. Andere Signale (Luftballons) können größere Strecken zurücklegen, da sie langlebiger sind und keinen direkten Kontakt zwischen Sender und Empfänger erfordern. Jede Zelle, die zum Beispiel in der Blutbahn, im Lymphsystem oder im Gewebe auf ein solches Signal stößt und die passenden Rezeptoren hat (also den Ballon einfangen kann), kann auf eine solche Botschaft reagieren.
Das wird im nächsten Bild an zwei Botenstoffen des Immunsystems konkretisiert: In der obersten Zeile geht es um das kleine, instabile Molekül Stickstoffmonoxid (NO). Es hat eine geringe Reichweite, da es schnell zerfällt. Da es sehr klein ist, muss es nicht aktiv durch bestimmte Kanäle geschleust werden, um in eine Zelle hinein oder aus einer Zelle heraus zu kommen: Es diffundiert einfach durch die Zellmembran hindurch. Im Immunsystem spielt es eine große Rolle, weil es zum Beispiel Blutgefäße weitet und damit Entzündungsreaktionen beschleunigt: Es sorgt dafür, dass mehr Immunzellen in kürzerer Zeit an die Stelle im Körper gelangen, an der sie gebraucht werden. Produziert wird es unter anderem von bestimmten Bakterien, von denen man annimmt, dass sie bis zur Einführung von Seife auf unserer Haut weit verbreitet waren. Ihre Zurückdrängung durch die moderne Körperhygiene könnte das Gleichgewicht der Botenstoffe in unserer Haut nachhaltig und nicht unbedingt nur zum Besseren verändert haben.
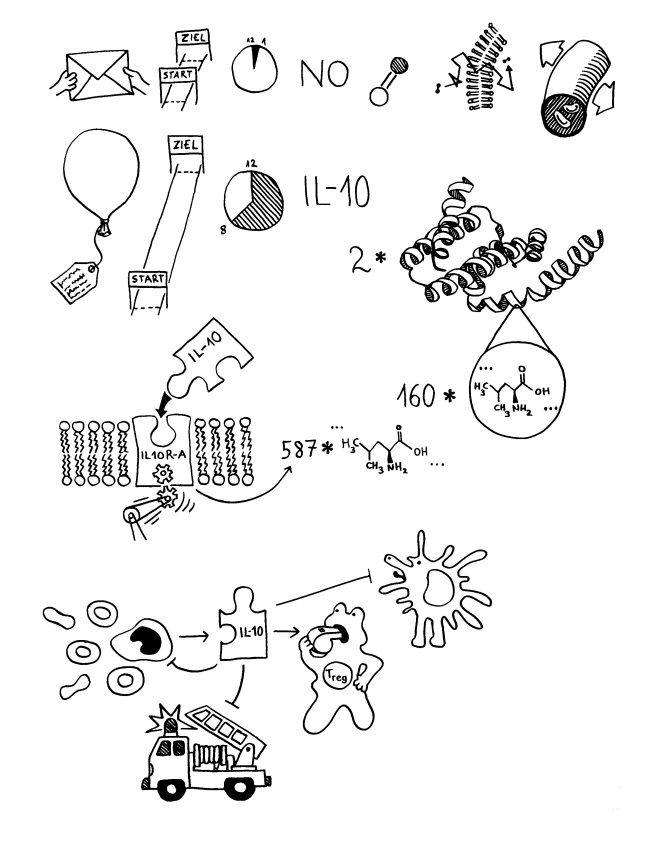 Im Rest der Grafik geht es um das Zytokin Interleukin 10 (IL-10). Zytokine sind Proteine, die im Immunsystem als Botenstoffe dienen. Sie sind langlebiger als NO und können daher größere Entfernungen zwischen Sender und Empfänger zurücklegen. Interleukin 10 besteht aus zwei identischen Proteineinheiten, die jeweils 160 Aminosäuren lang sind. (Eine Aminosäure besteht aus etwa 20 bis 30 Atomen und ist damit bereits viel größer als das aus zwei Atomen zusammengesetzte NO-Molekül.) Viele der Aminosäuren im IL-10 bilden stabile stabförmige Strukturen, sogenannte Alpha-Helices, die die dreidimensionale Gestalt des Proteins prägen.
Im Rest der Grafik geht es um das Zytokin Interleukin 10 (IL-10). Zytokine sind Proteine, die im Immunsystem als Botenstoffe dienen. Sie sind langlebiger als NO und können daher größere Entfernungen zwischen Sender und Empfänger zurücklegen. Interleukin 10 besteht aus zwei identischen Proteineinheiten, die jeweils 160 Aminosäuren lang sind. (Eine Aminosäure besteht aus etwa 20 bis 30 Atomen und ist damit bereits viel größer als das aus zwei Atomen zusammengesetzte NO-Molekül.) Viele der Aminosäuren im IL-10 bilden stabile stabförmige Strukturen, sogenannte Alpha-Helices, die die dreidimensionale Gestalt des Proteins prägen.
Mit dieser Gestalt passt das Protein dann nur auf spezifische Rezeptoren in den Zellmembranen bestimmter Zellen, was durch die beiden Puzzleteile versinnbildlicht wird. Ein Protein ist viel zu groß, um durch eine Membran hindurchzudiffundieren. Um in einer Zelle eine Reaktion auszulösen, muss es entweder von einem spezifischen Kanal in die Zelle eingeschleust werden oder – wie hier – an einen Rezeptor in der Zellmembran andocken, in dem sich daraufhin Teile räumlich etwas verlagern, sodass sie in der Zelle etwas auslösen: die Abspaltung oder das Andocken von Kofaktoren zum Beispiel. Die ausgelöste Reaktionskette im Zellinneren endet oft im Zellkern, wo bestimme Gene ein- oder ausgeschaltet werden.
IL-10 wird zum Beispiel von Monozyten produziert, den Vorläuferzellen der Makrophagen und Dendritischen Zellen, die bei einer Infektion oder Autoimmunerkrankung Antigene aufnehmen und sie anderen Zellen des Immunsystems präsentieren (antigenpräsentierende Zellen oder APCs). Der Botenstoff hemmt seinerseits die Reifung von Monozyten zu APCs und verkürzt die Lebensdauer von Monozyten: ein Beispiel für eine negative Rückkopplung, die zu heftige oder zu lang anhaltende Immunreaktionen verhindern soll. Auch über weitere Hemmwirkungen bewirkt IL-10, dass lokale Entzündungen (Feuerwehrauto) rechtzeitig beendet werden, sodass sie das körpereigene Gewebe nicht übermäßig schädigen.
Darüber hinaus scheint IL-10 die Reifung regulatorischer T-Zellen oder Tregs zu fördern, die dafür sorgen, dass auch die erworbene Immunantwort (B- und T-Zellen) rechtzeitig beim Abpfiff vom Platz geht. IL-10 trägt also erheblich zur Immunmodulation bei. Chronisch-entzündliche Darmerkrankungen wie Morbus Crohn oder Colitis ulcerosa sind durch einen Mangel an IL-10 und Tregs gekennzeichnet.
