Im letzten Beitrag habe ich die späteren Phasen der Thymozytenreifung, die teils an der Grenze zwischen Rinde und Mark, teils im Mark selbst ablaufen, weitgehend ausgespart. Dabei gibt es auch im Mark rätselhafte Strukturen, deren Funktion noch nicht geklärt ist: die sogenannten Hassall-Körperchen (Hassall’s corpuscles), die aus zahlreichen konzentrisch aneinandergelagerten Zellen oder Zellüberresten bestehen und in Mikroskopaufnahmen oft an Rosenblüten erinnern, weil sie den roten Farbstoff Eosin sehr gut annehmen.
Die Körperchen wurden erstmals 1846 von dem Arzt Arthur Hill Hassall beschrieben. Sie bestehen, wie man heute weiß, aus alten medullären Thymus-Epithelzellen (mTECs) und sind bereits in Embryonen nachweisbar. Ihre Zahl steigt bis zur Pubertät an und sinkt anschließend mit dem altersbedingten Abbau des funktionsfähigen Thymusgewebes wieder. Mäuse und Ratten haben relativ wenige und kleine Hassall-Körperchen, was die Erforschung dieser Gebilde erschwert.
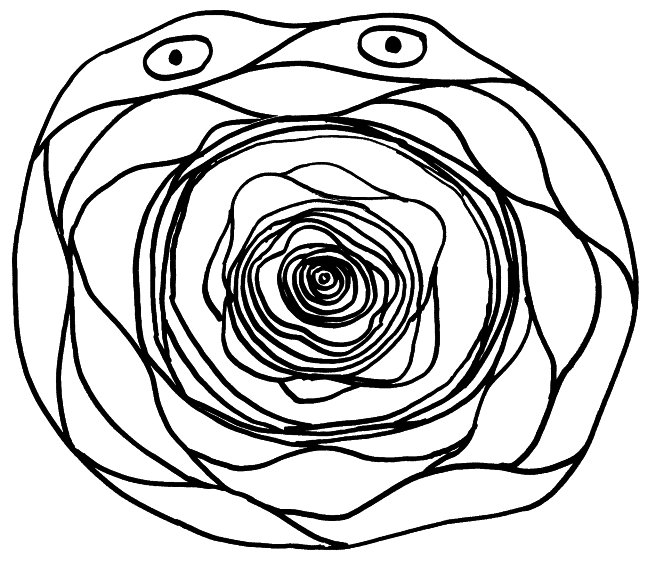
Wie die Bezeichnung „Thymus-Epithelzellen“ schon andeutet, haben mTECs viel mit den Epithelzellen in unserer Oberhaut, den Keratinozyten, gemeinsam: Beide können Keratin produzieren. Beide bilden Schichten aus, indem sie sich über sogenannte Desmosomen – scheibenförmige Kontaktflächen – mit benachbarten Zellen zusammenschweißen. Die Keratinozyten in unserer Oberhaut bilden flache Schichten, verhornen mit zunehmendem Alter und werden von jüngeren Zellen nach oben weggeschoben, bis sie abschilfern. Die alten mTECs in einem Hassall-Körperchen lagern sich dagegen in konzentrischen Schichten ab. Die Augen in der Zeichnung sollen andeuten, dass die Zellen in den äußeren Schichten noch Kerne haben und auch sonst intakt und lebendig sind. In den älteren, weiter innen abgelagerten Zellresten ist dagegen keine Struktur mehr zu erkennen.
Früher hielt man die Hassall-Körperchen für Müllhalden oder Friedhöfe für alte mTECs oder aussortierte Thymozyten. Schließlich gehen im Rahmen der sogenannten negativen Selektion sehr viele der scheinbar ziellos im Mark herumirrenden Thymozyten zugrunde, wenn ihre Rezeptoren zu stark auf irgendein Autoantigen ansprechen, das ihnen die medullären Thymus-Epithelzellen, die Makrophagen oder die dendritischen Zellen präsentieren:
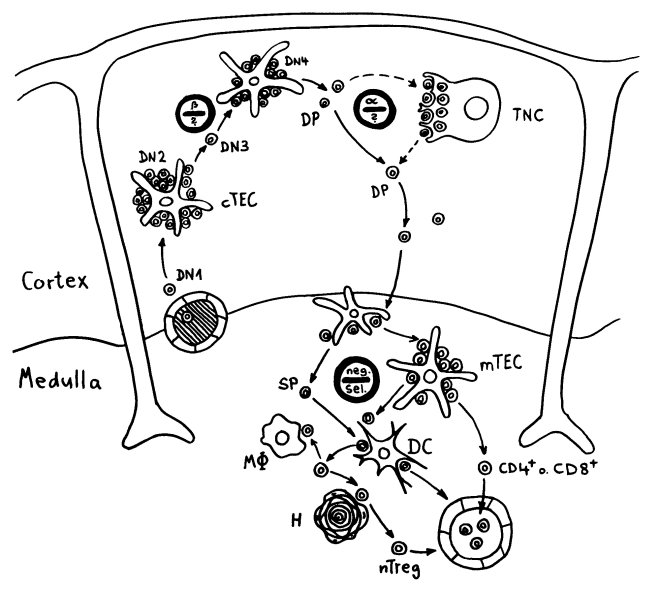
Unter den dendritischen Zellen sind sowohl solche, die im Thymus entstanden sind und ihn nie verlassen haben, als auch eine Teilpopulation, die über die Blutgefäße aus anderen Teilen des Körpers in den Thymus eingewandert ist und von dort Autoantigene zur Präsentation mitgebracht hat. Medulläre Thymus-Epithelzellen dagegen stellen mithilfe ihres besonderen Transkriptionsfaktors Aire für kurze Zeit alle möglichen Autoantigene her, die sonst nur in bestimmten Organen oder Gewebetypen produziert werden. Hier noch einmal eine ältere Zeichnung, die zwei Thymozyten zeigt, die eines dieser aus dem Hut gezauberten Autoantigene erkennen – und sich damit disqualifiziert haben:
Aber wieso sollten die Hassall-Körperchen etwas mit der Entsorgung der autoreaktiven und damit disqualifizierten Thymozyten zu tun haben? Die Beseitigung schädlicher Zellen und Zellreste übernehmen normalerweise Fresszellen wie Makrophagen.
Doch auch wenn die Hassall-Körperchen nicht an der Beseitigung autoreaktiver T-Zellen beteiligt sind, dürften sie ihren Beitrag zur Etablierung der sogenannten zentralen Toleranz im Immunsystem leisten. Wie oben in der zweiten Zeichnung zu sehen, wandern nicht nur die einfach positiven, nunmehr reifen CD4+- oder CD8+-T-Zellen aus dem Thymusmark in die Blutgefäße aus, sondern noch ein dritter Zelltyp: die natürlichen regulatorischen T-Zellen oder nTregs.
Diese nTregs gehen aus autoreaktiven CD4+-T-Zellen hervor, die der negativen Selektion irgendwie entgehen – offenbar mit Hilfe bestimmter dendritischer Zellen, die wiederum von den Hassall-Körperchen unterstützt werden. Aber wie läuft diese Konversion potenziell gefährlicher, weil autoreaktiver CD4+-T-Zellen zu Friedensstiftern ab?
Die äußeren, lebendigen Epithelzellen in den Hassall-Körperchen produzieren kein Aire mehr und damit auch kaum noch präsentationsfähige Autoantigene. Stattdessen stellen sie den Botenstoff TSLP (thymic stromal lymphopoietin) her. Dieser hindert unreife dendritische Zellen in der Umgebung einerseits an der Produktion entzündungsfördernder Zytokine wie Interleukin 12 oder TNF-α, die für die meisten anderen dendritischen Zellen typisch sind, und regt dafür die Produktion anderer Zytokine wie TARC oder MDC an. Zum anderen steigert er die Herstellung von MHC-Klasse-II-Molekülen (den Antigen-Präsentiertellern, die für den Kontakt mit T-Zellen nötig sind) und startet in den dendritischen Zellen die Produktion der Kostimulatoren CD80 und CD86, die den mit ihnen in Kontakt tretenden T-Zellen Überlebenssignale senden.
Diese besondere Population dendritischer Zellen regt einfach positive CD4+-Thymozyten nicht nur zum Überleben, sondern auch zur Vermehrung und zur Expression des Treg-typischen Markers CD25 an. Die so entstandenen CD4+-CD25+-Thymozyten sind ausschließlich im Umfeld von Hassall-Körperchen tief im Inneren des Thymus anzutreffen und produzieren den Transkriptionsfaktor FoxP3, womit sie sich als regulatorische T-Zellen zu erkennen geben. Sie wandern dann in die Blutbahn aus und üben später im Körper einen besänftigenden Einfluss auf alle anderen T-Zellen in ihrer Nachbarschaft aus, sobald sie durch eine beginnende Autoimmunreaktion auf das Autoantigen aktiviert werden, das ihre T-Zell-Rezeptoren erkennen.
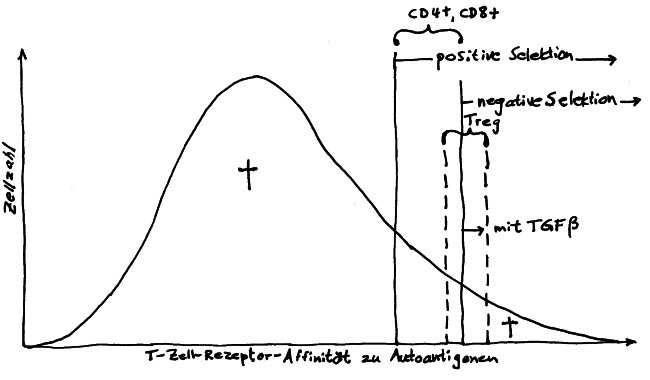
Die nTregs rekrutieren sich aus autoreaktiven Thymozyten, die von ihrer Autoantigen-Bindungsstärke her eigentlich zu normalen CD4+-T-Zellen (also Helferzellen) werden oder aber der negativen Selektion anheimfallen und im Thymus sterben müssten. Im folgenden Diagramm sind sie zwischen den beiden gestrichelten Linien angesiedelt:
Lange hat man sich gefragt, wie identische Autoantigen-Bindungsstärken zu so unterschiedlichen Schicksalen führen können. Wie so oft in der Biologie dürfte die Lösung in der komplexen räumlichen Struktur des Organs liegen: Künftige nTregs mögen zwar ebenso stark reagierende T-Zell-Rezeptoren haben wie viele der Thymozyten, die zu normalen T-Helferzellen werden oder aber abgetötet werden – aber sie bewohnen eine andere ökologische Nische im Thymus: Sie haben andere Nachbarn, die ihre weitere Entwicklung mit ihren Zytokinen beeinflussen. Nur da, wo Hassall-Körperchen sind, können sie zu regulatorischen T-Zellen heranreifen.
Vermutlich sorgt eine fein austarierte Rückkopplung dafür, dass die nTregs – normalerweise etwa 10 Prozent aller CD4+-T-Zellen im Körper – nicht auf Kosten der T-Helferzellen überhand nehmen oder umgekehrt: Tregs produzieren den Botenstoff TGF-β, der im Immunsystem viele Aufgaben erfüllt, zum Beispiel Entzündungsreaktionen unterdrückt. Im Thymus scheint er die Weiterentwicklung alter mTECs zu Hassall-Körperchen zu hemmen. Solange der Thymus genug nTregs hervorbringt, sorgt deren TGF-β dafür, dass keine weiteren Hassall-Körperchen und damit keine neuen „Treg-Missionsschulen“ entstehen. Gibt es dagegen zu wenige Tregs, so sinkt die TGF-β-Konzentration im Thymusmark, sodass sich neue Hassall-Körperchen bilden, und so weiter.
Die mutmaßliche Funktion der Hassall-Körperchen als Treg-Missionsschulen schließt übrigens weitere Aufgaben, etwa in der negativen Selektion, nicht aus. So könnten die Proteine, aus denen die alten mTECs in den Hassall-Körperchen ihre scheibenförmigen Zellkontaktstellen (Desmosomen) herstellen, von benachbarten antigenpräsentierenden Zellen aufgenommen, zu Autoantigenen weiterverarbeitet und den im Mark umherwandernden Thymozyten präsentiert werden, um T-Zellen auszusortieren, die auf diese typischen Epithelzellen-Produkte ansprechen.
Wie schon das Ammenmärchen endet also auch dieser Beitrag offen: Die Fachwelt ist sich noch uneins, wozu Hassall-Körperchen wirklich gut sind. Dass sie reine Abfallprodukte sind, wage ich angesichts ihres Aufbaus, ihrer Lage im Thymus und ihrer regen Kommunikation mit den Zellen in ihrer Nachbarschaft aber auszuschließen.