Was ein „Genom“ ist, lernen wir in der Schule: die Gesamtheit der Träger der Erbinformationen eines Lebewesens. Wer sich ein wenig für Biologie oder Medizin interessiert, ist auch mit dem „Proteom“ vertraut, also der Gesamtheit aller Proteine, die in einem Lebewesen vorkommen – hergestellt mithilfe der Bauanleitungen im Genom. Beim „Mikrobiom“ fangen die Schwierigkeiten an: Genau genommen ist das die Gesamtheit aller Genome aller Mikroorganismen, die auf und in einem Wirt leben. Doch von den meisten dieser Bakterien, Viren usw. kennen wir ohnehin nichts als ihre Gensequenzen, da wir sie – noch – nicht kultivieren können. Daher nennen wir oftmals auch die Gesamtheit dieser Mikroorganismen selbst, nicht nur ihrer Genome, „Mikrobiom“. Wer pingelig ist, darf dafür gerne „Mikrobiota“ sagen; ich mache mir die Mühe nicht.
Zu jedem -om gehört eine -omik: die Lehre, die sich mit dem -om beschäftigt, mit je eigener Methodik. Irgendwann in den letzten Jahren lief die Sache aus dem Ruder: Es gibt jetzt ein Transkriptom (Gesamtheit der transkribierten mRNA) und eine Transkriptomik, ein Metabolom (Gesamtheit der Stoffwechselprodukte) und eine Metabolomik, ja sogar ein Interaktom (Gesamtheit der molekularen Wechselwirkungen in einem Lebewesen) und eine Interaktomik; das heißt: Es müssen nicht einmal mehr Objekte sein, die da zusammengefasst werden.
Bereits 2012 hatte der Biologe Jonathan Eisen die Nase voll und schrieb ein Paper mit dem schönen Titel „Badomics words and the power and peril of the ome-meme“. 2013 legte er bei Twitter nach:
The „microgenderome“ is far & away the worst #badomics word I have seen in a long time http://t.co/ziggNjWKQM h/t @iddux @bioinfosm
— Jonathan Eisen (@phylogenomics) 1. März 2013
Er bezog sich auf die Science-Ausgabe vom selben Tag, in der die Harvard-GastroenterologInnen Magdalena B. Flak, Joana F. Neves und Richard S. Blumberg unter dem Titel „Welcome to the Microgenderome“ eine im selben Heft erschienene Forschungsarbeit von Janet G. M. Markle et al. vorstellten und kommentierten: „Sex Differences in the Gut Microbiome Drive Hormone-Dependent Regulation of Autoimmunity“. Eine zweite Arbeit des Markle-Teams trug 2014 den Titel „Microbiome Manipulation Modifies Sex-specific Risks for Autoimmunity“. Eine andere Forschergruppe (Leonid Yurkovetskiy et al.), die am selben Problem arbeitet, veröffentlichte ihre Ergebnisse 2014 unter der Überschrift „Gender Bias in Autoimmunity Is Influenced by Microbiota“. Damit steht es in der Frage „Sex oder Gender?“ zwei zu zwei.
Wie kommt man auf die seltsame Idee, Mäuse zu gendern? Denn, wohlgemerkt: Die Versuche, um die es hier geht, wurden ausschließlich an Mäusen eines besonderen Zuchtstamms durchgeführt, der eine genetische Neigung zu einer Autoimmunerkrankung hat, die dem menschlichen Typ-1-Diabetes ähnelt (sogenannte NOD-Mäuse, von non-obese diabetes). Unter den Weibchen ist der Anteil, der tatsächlich erkrankt, viel größer als unter den Männchen – wobei diese Anteile trotz identischen Erbguts und standardisierter Haltungsbedingungen von Labor zu Labor schwanken, ja sogar innerhalb eines Labors von Versuch zu Versuch. Wie sich jetzt zeigt, liegt das an der Darmflora (dem gut microbiome oder GM) der Tiere, die sich von Mäusefamilie zu Mäusefamilie, von Käfig zu Käfig leicht unterscheidet.
Da auch beim Menschen (1) die Prävalenz vieler Autoimmunerkrankungen – allerdings ausgerechnet nicht des Typ-1-Diabetes – bei Frauen deutlich größer ist als bei Männern, (2) Testosteron in den meisten Zusammenhängen entzündungshemmend wirkt und (3) vieles darauf hindeutet, dass die Zusammensetzung der Darmflora die Aktivitäten des Immunsystems beeinflusst, wollten die Forscher herausfinden, ob
- das Mikrobiom der Mäuseweibchen anders zusammengesetzt ist als das der Männchen,
- der Testosterongehalt mit der Erkrankungswahrscheinlichkeit und/oder der Mikrobiomzusammensetzung korreliert und
- eine Mikrobiom-Übertragung von männlichen auf weibliche Mäuse deren Erkrankungsrisiko senkt.
Während weibliche und männliche NOD-Mäusebabies noch gleichartige Mikrobiome haben, verändert sich die Darmflora der Männchen in der Mäusepubertät, vermutlich infolge der steigenden Testosteronproduktion. Irgendwelche Faktoren in der Darmflora geschlechtsreifer männlicher NOD-Mäuse schützen im Zusammenspiel mit Testosteron vor dem Ausbruch der Autoimmunerkrankung.
Die Schutzwirkung scheint zumindest zum Teil von sogenannten segmentierten filamentösen Bakterien (SFB) auszugehen, die in Nagetieren weit verbreitet sind, aber in der Darmflora von Menschen nicht vorkommen. Diese Bakterien senden Signale aus, die zum einen die Testosteronproduktion weiter ankurbeln und zum anderen die Ablesung von etwa 40 Mäusegenen verändern, die zum Immunsystem gehören – vor allem zur Interferon-γ- und Interleukin-1β-Produktion.
Kastriert man die Mäusemännchen frühzeitig, so bleibt ihr Mikrobiom „weiblich“, und sie erkranken ebenso häufig wie die Weibchen. Überträgt man das „männliche“ Mikrobiom rechtzeitig in Mäuseweibchen, so sinkt deren Erkrankungsrisiko. Zieht man die Mäuse mikrobiomfrei auf, so gleichen sich die Erkrankungsrisiken auf mittlerem Niveau an, d. h. Weibchen erkranken seltener, Männchen häufiger als unter dem Einfluss einer Darmflora.
So interessant das alles ist: Was hat es mit Menschen zu tun, und mit Gender? Die Mikrobiom-Zusammensetzung ist nicht im Mäusegenom codiert und lässt sich daher nicht recht als (tertiäres) Geschlechtsmerkmal auffassen. Das Mikrobiom steht an der Grenze zwischen Selbst und Umwelt. Daher scheuen sich manche Wissenschaftler, solche Unterschiede als sex-specific zu bezeichnen, und verfallen auf gender-biased. Das ist ein bisschen albern, da es einen kulturellen Überbau suggeriert, den NOD-Mäuse höchstwahrscheinlich nicht erleben. Und es verleitet dazu, die fundamentalen Unterschiede zwischen Maus und Mensch unter den Tisch zu kehren.
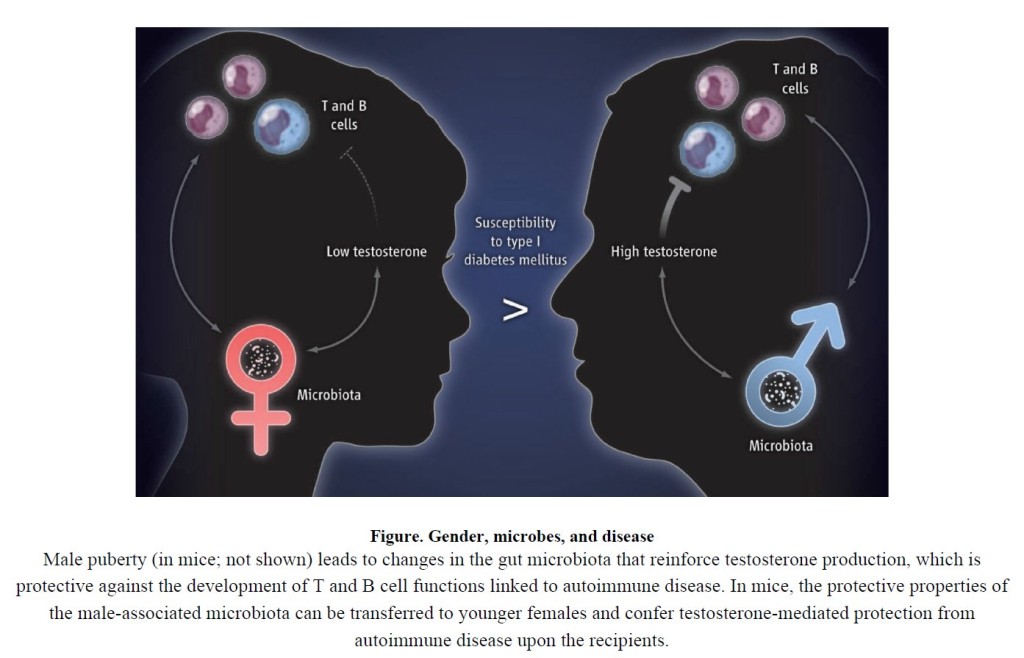
Das führen die Harvard-GastroenterologInnen in Science vor, unter anderem mit der bemerkenswertesten Text-Bild-Schere, die mir in der immunologischen Literatur bislang untergekommen ist:
In der Tat: „in mice; not shown“. Und wie ist es beim Menschen? Auch wir sind Säugetiere, genau wie Mäuse; auch wir haben ein Mikrobiom; auch wir produzieren Sexualhormone; auch wir bekommen Autoimmunerkrankungen; auch bei uns wirkt Testosteron zumeist entzündungshemmend. Da ist die Übertragung der an NOD-Mäusen gewonnenen Erkenntnisse doch sicher ein Kinderspiel, und schon bald wird man Mädchen vor schlimmen Erkrankungen bewahren können, indem man ihnen Stuhltransplantate ihrer Väter und Brüder verabreicht!
Mit dieser faszinierenden Perspektive endet nämlich der Artikel von Flak et al.: mit dem „possible transfer of protective microbiota from pubertal human males to younger females during early life … If so, family units with fathers and older brothers may offer a unique, unanticipated benefit for the health of their young daughters and sisters.“ Es gibt zweifellos gute Gründe, sich über intakte Familien mit Vätern und großen Brüdern zu freuen. Das hier ist – pun intended – vorläufig der beschissenste.
Es gibt fundamentale Unterschiede zwischen Menschen und Mäusen, die sich auf den Ressourceneinsatz, das Hormon- und das Immunsystem auswirken. Beispielsweise sind Nagetiere nachtaktiv. Außerdem setzen sie in kurzer Zeit viel Nachwuchs in die Welt, von dem nur ein kleiner Teil lang genug lebt, um selbst geschlechtsreif zu werden. Menschen bekommen dagegen erst spät und nur wenige Kinder, in die sie viel Energie investieren, sodass ein großer Teil von ihnen überlebt. Auch diese gegensätzlichen Reproduktionsstrategien und die damit einhergehenden Unterschiede im Verhalten der Weibchen und der Männchen haben erhebliche Auswirkungen auf das Immunsystem. Dazu mehr im nächsten Artikel.
Wie steht es nun um das menschliche „Mikrogenderom“, um geschlechtsspezifische Aspekte der Darmflora? Meines Wissens hat man signifikante Unterschiede bislang nur bei traditionell lebenden Hadza in Tansania entdeckt, bei denen sich die Kost der (häufiger jagenden) Männer und der (regelmäßiger sammelnden) Frauen stark unterscheidet: Bestimmte Bakterien helfen den Frauen, aus ihrer pflanzlichen Nahrung genug Energie zu gewinnen – vor allem während der Schwangerschaft.
Mag sein, dass wir nur noch genauer hinsehen müssen, um auch in anderen menschlichen Populationen geschlechtsspezifische Darmflora-Nuancen zu entdecken, die, wenn es sie gibt, dann vermutlich auch (auf höchst subtile und verschachtelte Weise) mit unserem Immunsystem wechselwirken und insofern womöglich ihr Scherflein zu den höheren Autoimmunerkrankungsrisiken von Frauen beitragen. Aber das ist noch ein langer Weg, den wir auch ohne Kunstworte aus der Hölle beschreiten können.