Ich habe kürzlich einen Vortrag gehalten, auf dessen Folien neben Zeichnungen aus Band 1 und für Band 2 auch einige neue Zeichnungen vorkommen. Der Vortrag dauert etwa 45-60 Minuten, ist also für eine 90-minütige Veranstaltung geeignet, etwa bei Selbsthilfegruppen oder in Bildungseinrichtungen oder Kliniken. (Anfragen bitte an die im Impressum genannte Mailadresse!)
Schlagwort-Archive: Immunsystem
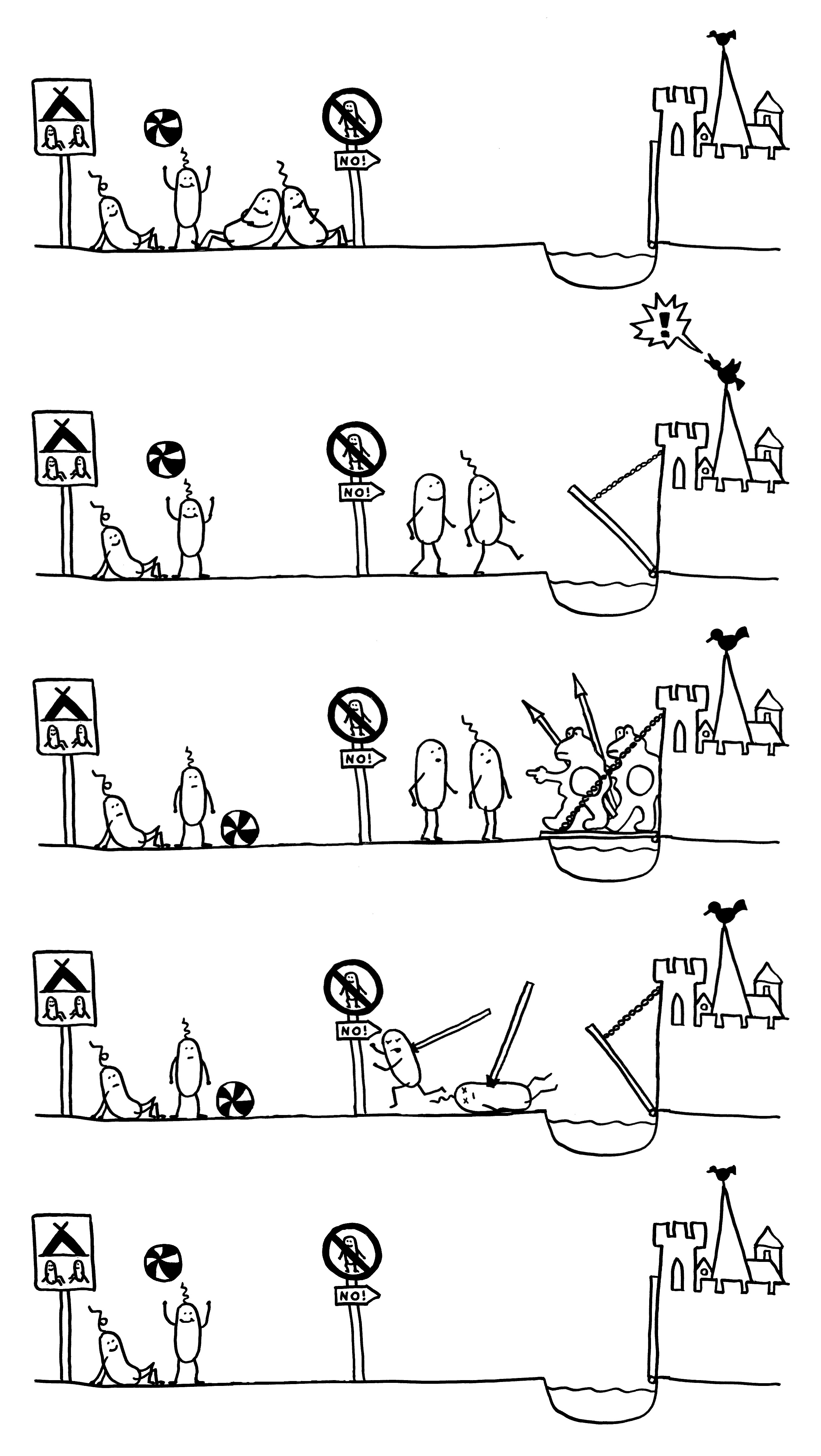
Abb. 186: Cordon sanitaire
Bitte Abstand halten! Solange sich Kommensalen von der Darmschleimhaut fernhalten,
haben sie vom Immunsystem nichts zu befürchten. Dringen sie allerdings in die
Sperrzone der innersten Schleimschicht vor, geht ein Alarm los. Dann rücken Zellen
der angeborenen Immunabwehr aus und töten sie ab, ohne dabei eine Entzündung auszulösen.
Sie dürfen diese Zeichnung gerne in Folien etc. übernehmen, sofern Sie die Quelle angeben: Dr. Andrea Kamphuis, https://autoimmunbuch.de
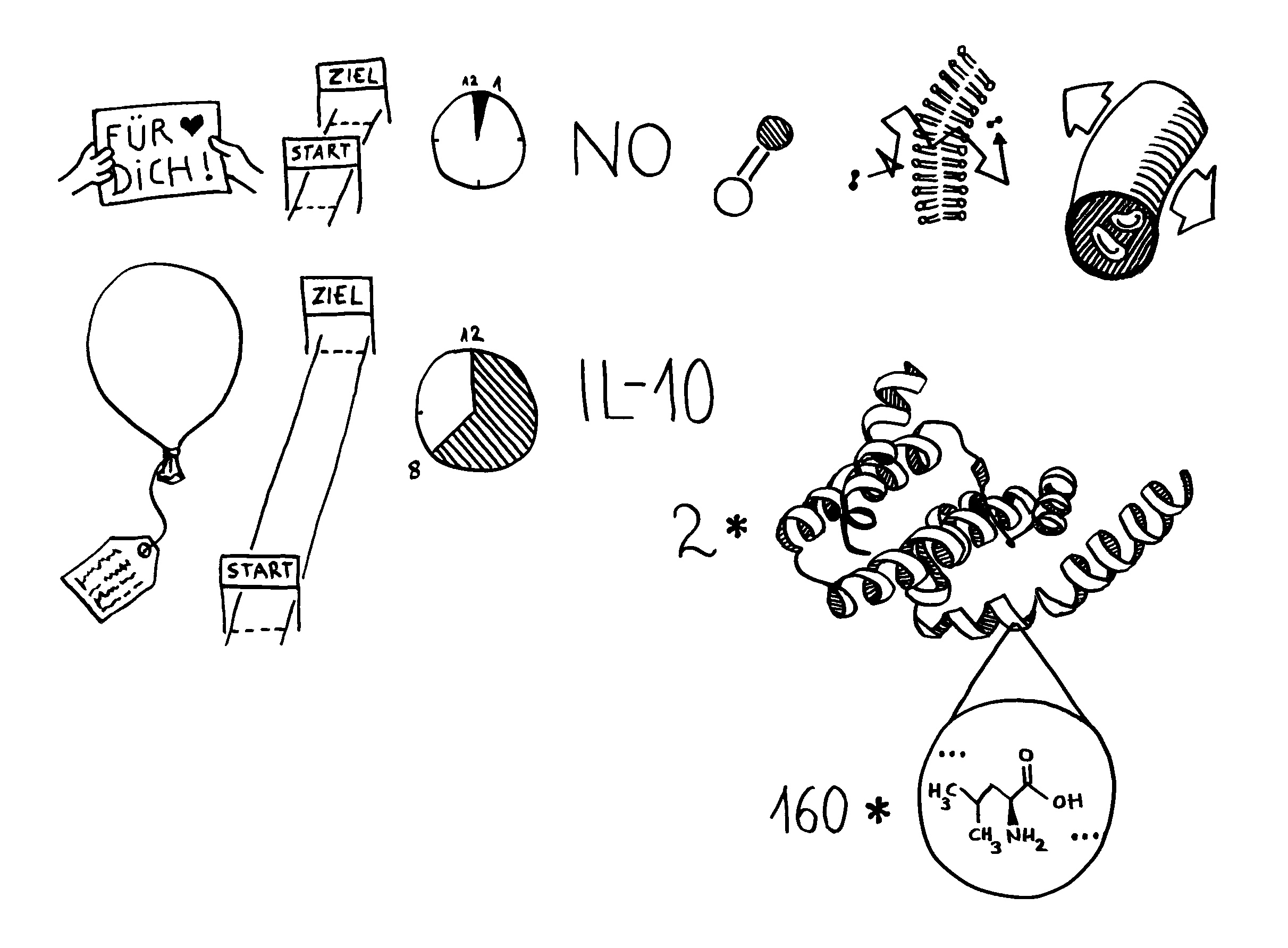
Abb. 53: Stickstoffmonoxid und Interleukin-10
Oben: Einige Botenstoffe des Immunsystems können nur von Zellen in der direkten Nachbarschaft empfangen werden: Sie legen nur kurze Strecken zurück, da sie kurzlebig sind. Zu ihnen zählt Stickstoffmonoxid (NO), ein Molekül, das nur aus einem Stickstoff- und einem Sauerstoff-Atom besteht. Es ist so klein, dass es durch Zellmembranen diffundiert (Zickzackpfad). Blutgefäße weiten sich, wenn sie NO wahrnehmen, zum Beispiel bei einer Entzündung.
Unten: Andere Botenstoffe setzen keinen direkten Kontakt zwischen Sender und Empfänger voraus. Sie können weitere Strecken zurücklegen, da sie chemisch stabiler sind. Zu ihnen zählt Interleukin-10 (IL-10), ein Protein aus zwei Ketten mit je 160 Aminosäuren. Da es so groß ist, kann es nicht durch eine Zellmembran diffundieren, sondern muss an einen spezifischen Rezeptor in der Membran binden. Dazu später mehr.
Sie dürfen diese Zeichnung gerne in Folien etc. übernehmen, sofern Sie die Quelle angeben: Dr. Andrea Kamphuis, https://autoimmunbuch.de
Große Unterschiede im Immunsystem eineiiger Zwillinge
Nur wenige Forscher beschäftigen sich mit der Entwicklung des gesamten Immunsystems, also all der Komponenten sowohl der angeborenen als auch der erworbenen Abwehr, über das ganze Leben hinweg: von der Geburt bis ins hohe Alter. Hier stelle ich eine dieser wenigen Arbeiten vor:
Petter Brodin et al. (2015): Variation in the Human Immune System Is Largely Driven by Non-Heritable Influences (Open Access)
Die Autoren haben an 105 gesunden Zwillingspaaren, also 210 Personen, 204 Immunsystem-Parameter untersucht, darunter die Häufigkeit von 95 verschiedenen Immunzelltypen, die Konzentration von 51 Zytokinen, Chemokinen und Wachstumsfaktoren im Serum und die Veränderungen dieser Werte nach Anregung der Immunzellen durch Botenstoffe. 78 Zwillingspaare waren eineiig, 27 zweieiig. Bei der großen Mehrheit, nämlich 77 Prozent der Parameter waren die Unterschiede zwischen den Zwillings-Messwerten überwiegend (nämlich zu mehr als der Hälfte) nicht erblich, sondern durch unterschiedliche Umwelteinflüsse bedingt. Die Unterschiede bei 58 Prozent der Immunsystem-Parameter waren sogar ganz überwiegend (zu mehr als 80 Prozent) nicht erblich bedingt. Außerdem unterschieden sich die Immunsysteme älterer Zwillingspaare deutlich stärker als die jüngerer: Der Umwelteinfluss nimmt mit den Jahren zu.
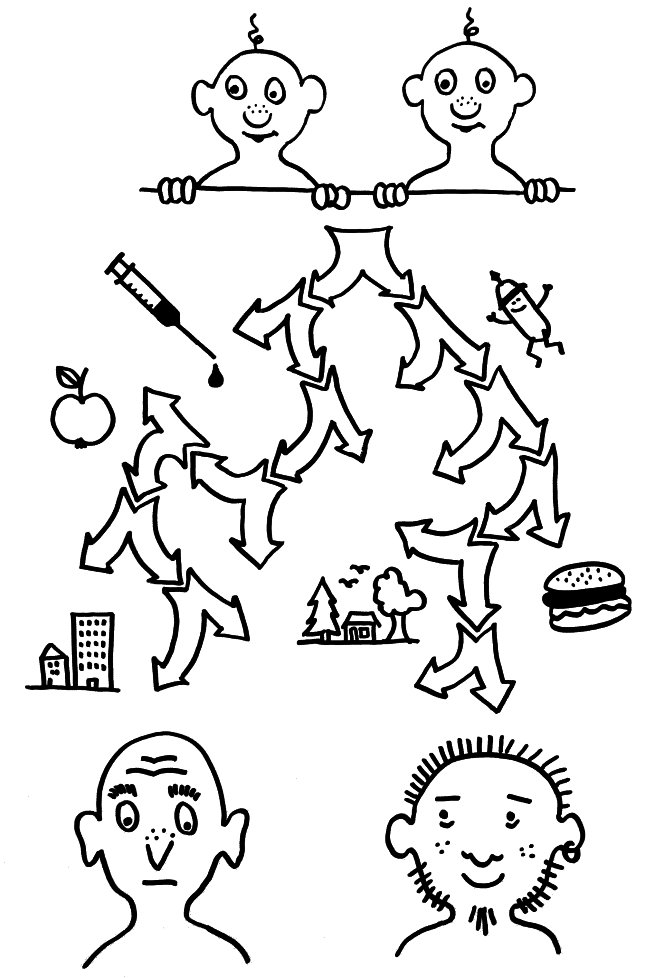
Mit den Jahren entwickeln sich Zwillinge immunologisch immer weiter auseinander, weil unterschiedliche Umwelteinflüsse auf sie einwirken, etwa Impfungen, Infektionen, Zellgifte oder ihre Kost.
Die Erblichkeit der Parameter wurde anhand von Messungen an eineiigen und zweieiigen Zwillingspaaren ermittelt. Zwischen eineiigen Zwillingen sollten erbliche Faktoren (also Gene und dauerhafte epigenetische Markierungen des Erbguts) zu 100 Prozent übereinstimmen, zwischen zweieiigen Zwillingen dagegen – wie bei anderen Geschwisterpaaren – nur zu 50 Prozent. Umweltfaktoren (darunter auch stochastische epigenetische Veränderungen) sollten dagegen ein- und zweieiige Zwillinge gleichermaßen beeinflussen.
Unter den Immunzelltypen gab es einige wenige, deren Häufigkeit im Blut der Probanden stark erblich bedingt war, also zwischen eineiigen Zwillingen sehr gut übereinstimmte – vor allem naive CD27+-T-Zellen und CD4+-Gedächtnis-T-Zellen. Die Häufigkeit der meisten Zellen der erworbenen (T- und B-Zellen) sowie der angeborenen Abwehr (Granulozyten, Monozyten und NK-Zellen) unterschied sich dagegen zwischen eineiigen Zwillingen praktisch ebenso stark wie zwischen zweieiigen Zwillingen, sodass man annehmen muss, dass Zufälle und Umweltreize wie Infektionen die Werte prägen.
Unter den Zytokinen erwies sich IL-12p40 als besonders stark erblich. Varianten im Gen dieses Proteins werden mit Krankheiten wie Psoriasis oder Asthma in Verbindung gebracht, an denen das Immunsystem beteiligt ist. Bei vielen anderen Zytokinen war der erbliche Einfluss gering.
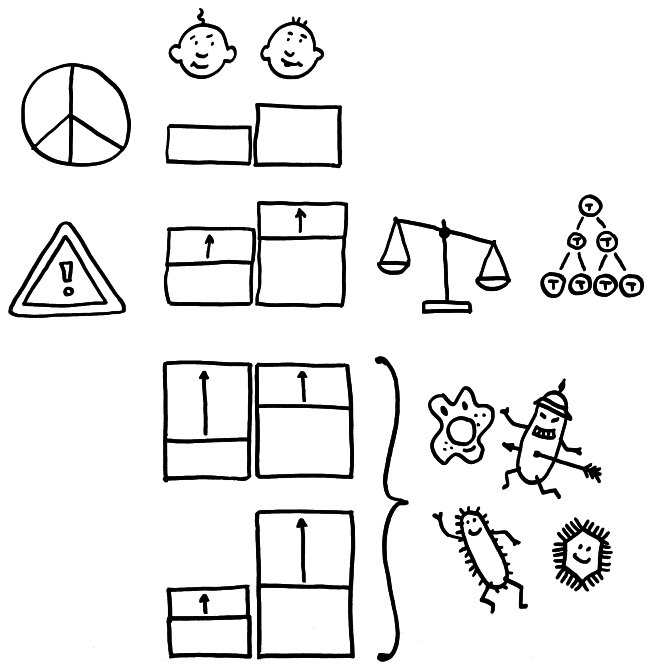
Schon im Ruhezustand (oben) unterscheiden sich viele Immunparameter zwischen Zwillingen. Eine Anregung des Immunsystems löst bei den wenigen erblich dominierten Parametern (etwa den homöostatischen Zytokinen IL-2 und IL-7, die die Vermehrung von T-Zellen steuern) gleich starke Veränderungen aus (Zeile 2). Bei den vielen nicht erblich dominierten Parametern (etwa IL-6, IL-20 oder IL-21) können die unterschiedlichen Reaktionsstärken die Unterschiede zwischen den Basiswerten ausgleichen oder verstärken.
Das galt sowohl für die Basiswerte, die ohne Stimulation des Immunsystems erhoben wurden, als auch für viele Werte, die nach Anregung einer Immunreaktion ermittelt wurden. Eine stark erbliche Komponente fand sich bei den sogenannten homöostatischen Zytokinen IL-2 und IL-7, die bei einer Aktivierung des Immunsystems für die Vermehrung und die richtige Spezialisierung von T-Zellen sorgen. Die meisten Messwerte variierten jedoch nach der Immunsystem-Stimulation zwischen eineiigen Zwillingen fast ebenso unterschiedlich wie zwischen zweieiigen Zwillingen. Dabei waren schwache und starke Immunsystem-Reaktionen gleichermaßen nicht erblich, also durch Umweltfaktoren geprägt.
Stellt man alle gemessenen Immunsystem-Parameter als Netzwerk dar, in dem voneinander abhängige Größen durch Linien verbunden sind, zeigt sich: Die relativ wenigen Parameter mit starker Erblichkeit sind von Parametern umgeben, deren Variabilität durch die Umwelt bedingt ist. Das könnte erklären, warum bekannte Risiko-Genvarianten für bestimmte Krankheiten des Immunsystems oft nur für einen kleinen Teil des Erkrankungsrisikos verantwortlich zeichnen: Ihr Einfluss wird durch andere, nicht erbliche Faktoren abgepuffert, die zum Beispiel in denselben Signalketten oder Regelkreisen angesiedelt sind.
Der im Laufe des Lebens zunehmende Einfluss der Umwelt, vor allem wohl der Infektions- und Impfgeschichte auf den Zustand des Immunsystems war bei den regulatorischen T-Zellen oder Tregs am auffälligsten: Während ihre Häufigkeit bei jungen Zwillingspaaren gut übereinstimmte (Erblichkeit 0,78 von maximal 1,0), waren die Werte bei alten Zwillingspaaren so gut wie unkorreliert (Erblichkeit 0,24, also knapp über der Nachweisbarkeitsgrenze von 0,2). Besonders großen Einfluss auf das Immunsystem nimmt offenbar das Cytomegalovirus (CMV), das uns – wie andere Herpesviren – ein Leben lang erhalten bleibt. In 16 eineiigen Zwillingspaaren aus der Versuchspopulation war ein Geschwister mit CMV infiziert und das andere nicht. Viele ihrer Immunsystem-Parameter unterschieden sich stark, und zwar sowohl im Basiszustand als auch nach Stimulation.
Die Antikörperproduktion nach einer Grippeschutzimpfung war bei den Zwillingspaaren so gut wie gar nicht erblich beeinflusst, sondern fiel – wohl je nach Impf- und Infektionsgeschichte der Individuen – recht unterschiedlich aus.
Angesichts dieser Ergebnisse ist es kein Wunder, dass unter Geschwistern, die dieselben Risikogenvarianten für Autoimmunerkrankungen erben, oftmals nur eines wirklich erkrankt.
Die Milch macht’s – zumindest bei Mäusen
Dass Muttermilch Antikörper enthält, die das Neugeborene in den ersten Monaten vor Infektionen schützen, ist schon länger bekannt. Aber Milch leistet noch mehr für das Immunsystem des Nachwuchses, wie zwei neuere Arbeiten zeigen:
M. K. Ghosh et al. (2016): Maternal Milk T Cells Drive Development of Transgenerational Th1 Immunity in Offspring Thymus (Open Access); dazu auch die Pressemitteilung der Universität: Vaccinating Babies Without Vaccinating Babies
In der Vorläuferstudie hatten die Forscher herausgefunden, dass Mäuse ihrem Nachwuchs beim Säugen nicht nur durch Antikörper, sondern auch durch Immunzellen eine Immunität gegen Pathogene vermitteln, mit denen ihr eigenes Immunsystem kürzlich konfrontiert wurde. Seltsamerweise ist diese Immunität noch beim erwachsenen Nachwuchs nachzuweisen, obwohl dieser keinerlei mütterliche Immunzellen mehr enthält. Die Natur und die Entstehung der Zellen, die diese Immunität vermitteln, sollte hier untersucht werden. Um eine Übertragung im Mutterleib auszuschließen, ließ man die gegen das Bakterium Mycobacterium tuberculosis oder gegen den Pilz Candida albicans immunisierten Mäuseweibchen fremden Nachwuchs aufziehen.
Die Immunität wird offenbar von Gedächtnis-T-Zellen übertragen, die über CD4+-Marker und MHC-Klasse-II-Komplexe verfügen – eine kuriose Kombination, denn normalerweise empfangen CD4+-T-Zellen Signale von antigenpräsentierenden Zellen wie etwa dendritischen Zellen, die Antigene auf MHC-Klasse-II-Komplexen präsentieren. Dendritische Zellen sind aber viel zu kurzlebig, um die hier beobachteten Effekte zu erklären; es waren eindeutig antigenpräsentierende CD4+-T-Zellen, die die Immunität übertrugen – vielleicht, weil nur T-Zellen gezielt in den Thymus wandern können. Wie diese Zellen an die MHC-Klasse-II-Komplexe gelangt sind, ist unklar. Die Autoren vermuten Trogozytose: die Übergabe von Membranflößen einschließlich MHC-Komplex und Kostimulatoren an einer immunologischen Synapse, also einer Bindungsstelle zwischen der (primären) antigenpräsentierenden Zelle und einer T-Zelle, deren T-Zell-Rezeptor spezifisch an den Komplex bindet. Diesen Mechanismus habe ich hier bereits vorgestellt.
Nach der Aufnahme über die Muttermilch wandern diese ungewöhnlichen mütterlichen Gedächtnis-T-Zellen gezielt in den Thymus und die Milz der Mäusebabies. Um an den Grenzen – also am Brustdrüsen-, Darm- und Thymusepithel – nicht von anderen Immunzellen aufgehalten zu werden, „verschlucken“ sie vermutlich ihre MHC-Klasse-II-Komplexe samt Antigenen in Vesikeln und befördern sie erst am Ziel wieder an die Zelloberfläche. Im Thymus werden die MHC-Klasse-II-Komplexe einschließlich der Antigene womöglich durch eine weitere Trogozytose an „ordentliche“ antigenpräsentierende Zellen übergeben, oder die CD4+-T-Zellen werfen die Antigene ab, und antigenpräsentierende Zellen nehmen sie auf.
Jedenfalls werden die Antigene aus den Pathogenen, mit denen die Mütter infiziert waren, nun den unreifen Mäusebaby-Thymozyten präsentiert, die daraufhin zu CD8+-T-Zellen mit einer Spezifität für diese Antigene heranreifen. Diese Immunitätsübertragung nennen die Autoren „maternal educational immunity“, um sie von der passiven Immunität zu unterscheiden, die vor allem durch mütterliche Antikörper in der Milch übertragen wird und sich rasch verliert, da diese Antikörper im Jungtier nicht nachproduziert werden können.
In der Pressemitteilung der Universität finden sich interessante Spekulationen über eine mögliche Nutzung dieses Mechanismus zur „indirekten Impfung“ von Säuglingen (nämlich durch Impfung der Mütter während der Schwangerschaft) und über die hohe historische Überlebensrate von Kleinkindern aus Adelsfamilien, die häufig von Ammen aus der Unterschicht gestillt wurden und so vielleicht eine besonders gute „Immunsystem-Erziehung“ genossen. Dabei sollte aber nicht vergessen werden, dass die Reifung des Immunsystems bei jungen Mäusen anders verläuft als bei Menschenkindern.
M. A. Koch et al. (2016): Maternal IgG and IgA Antibodies Dampen Mucosal T Helper Cell Responses in Early Life (Bezahlschranke, nur Abstract und eine Abbildung); dazu auch Meldung „Breast Milk Primes Gut for Microbes“ in The Scientist
Mütterliche, über die Milch übertragene Antikörper der Typen IgG und IgA dienen vor allem dazu, Pathogene im Darm junger Mäuse zu bekämpfen, solange deren Immunsystem dazu noch nicht imstande ist – so glaubte man bisher. Jetzt zeigt sich, dass insbesondere IgG auch Immunreaktionen hemmt, und zwar solche gegen nützliche Bakterien, die nach der Geburt den Darm von Mäusebabies besiedeln. Fehlen die mütterlichen Antikörper, reagiert das Lymphgewebe am Darm heftig auf die neue Darmflora: Es entstehen viel mehr T-Helferzellen, die wiederum B-Zellen zur Produktion von Antikörpern gegen die gutartigen Darmbakterien anregen.
Allerdings scheinen die Mäuse, denen das mütterliche IgG vorenthalten wurde, keine langfristigen Gesundheitsschäden davonzutragen. Der Begleitartikel in The Scientist stellt dennoch Spekulationen über langfristige Folgen einer gestörten Mikrobiom-Entwicklung an, etwa Morbus Crohn und Colitis ulcerosa – nur um dann abzuwiegeln und auf die Unterschiede zwischen Mensch und Maus hinzuweisen. Zum Beispiel darauf, dass menschliche Muttermilch viel weniger IgG enthält als die von Mäusen. Es ist zum Mäusemelken.
Das Immunsystem indigener Gruppen und das ethische Dilemma des Erstkontakts
Vor einem Jahr erschien eine Arbeit über das Mikrobiom unkontaktierter Yanomami, die ich damals nur kurz besprechen konnte. Jetzt habe ich sie noch einmal gelesen, obwohl sie immunologisch unergiebig ist: Die Entnahme von Blutproben, die Aufschluss über den Zustand des Immunsystems dieser Menschen hätte geben können, war bei einem Erstkontakt selbstverständlich unmöglich. Man muss schon froh sein, dass sie Abstriche aus ihrer Mundschleimhaut und das Einsammeln von Stuhlproben gestattet haben – vermutlich nicht, ohne sich über dieses merkwürdige Verhalten zu amüsieren.
Die Hauptergebnisse: Die Bakteriengemeinschaften auf der Haut und im Stuhl dieser mutmaßlich seit über 11.000 Jahren isolierten Menschen sind erheblich artenreicher als unsere – und auch als die Mikrobiome anderer naturnah lebender Völker. Die sogenannte Alpha-Diversität ihrer Mikrobiome ist also sehr hoch, vermutlich, weil sie nie mit antimikrobiellen Substanzen zu tun hatten und weil sie in ständigem Kontakt mit ihrer Umwelt leben. In ihrer Darm- und Hautflora leben zum Beispiel Bakterien, die man bislang für reine Bodenbakterien gehalten hat. Zugleich sind die Unterschiede in der Mikrobiom-Zusammensetzung zwischen den 34 Yanomami, von denen die Proben stammen, viel geringer als zwischen denen zweier Menschen aus einer Gruppe aus unserem Kulturkreis. Die sogenannte Beta-Diversität ist mithin sehr klein – wohl wegen des engen Zusammenlebens, der hygienischen Verhältnisse und der gleichartigen Lebensweise und Ernährung aller Gruppenmitglieder.
Unter den Genen dieser Bakterien, und zwar überweigend den Genen von zuvor unbekannten Stämmen des Darmbakteriums Escherichia coli, finden sich 28, die Antibiotika-Resistenzen vermitteln – sogar gegen einige neue, synthetische Antibiotika. Allerdings werden diese Gene in den Bakterien nicht abgelesen, sie sind „stummgeschaltet“ (silenced), sodass die Bakterien anfangs dennoch auf die Antibiotika ansprechen würden. Aber man muss damit rechnen, dass sie sehr bald wirklich Resistenzen entwickeln würden, und zwar gleich gegen mehrere Antibiotika. In Weltgegenden und Kulturen, in denen die sogenannte Therapietreue (die regelmäßige Einnahme des Medikaments über den kompletten notwendigen Zeitraum) vermutlich gering ist, geht das umso schneller.
Erstkontakt: Es gibt keinen Weg zurück
Dem Forscherteam war bewusst, dass die Probensammlung beim Erstkontakt eine einmalige Gelegenheit ist, ein Mikrobiom-Archiv anzulegen, das vermutlich große strukturelle und funktionale Ähnlichkeiten mit dem Mikrobiom unserer altsteinzeitlichen Vorfahren hat – auch wenn sich die einzelnen Bakterien-Arten und -Stämme natürlich auf dem Weg ihrer Wirte nach und durch Südamerika weiterentwickelt haben. 11.000 Jahre entsprechen ungefähr 100 Millionen Bakteriengenerationen. Zugleich begann mit dieser Begegnung zwischen der bislang isolierten Dorfgemeinschaft und den Medizinern und Wissenschaftlern unwiderruflich der Niedergang dieser Diversität – spätestens mit der ersten Antibiotika-Gabe.
Die Autoren schreiben in ihrer Danksagung: „Wir sind auch den Leuten in dem neu kontaktierten Dorf dankbar für ihr Vertrauen und für unser gemeinsamen Wunsch, dass der unvermeidliche Kontakt mit unserer Kultur ihrem Volk gesundheitliche Vorteile und Schutz bringen möge.“ Ist das nicht ein arg frommer Wunsch angesichts der bisherigen Erfahrungen mit der gesundheitlichen und sozialen Entwicklung neu kontaktierter, kleiner indigener Gruppen? Weiterlesen
Noch einmal: Geschlecht, Hormone, Immunsystem
Dieser Beitrag wird lang, trocken und abstrakt, und er enthält nur ein einziges eigenes Bild, und es bleibt kompliziert. Genau genommen ist er trotz langen Ringens mit dem Stoff nahezu unlesbar. Sorry. Ich musste das einfach mal notieren, um selbst nicht immer wieder durcheinander zu kommen. Im Buch landet dann eine weniger technische und überfrachtete Quintessenz.
Wann ist ein Mann ein Mann?
Und was macht eine Frau zur Frau, biologisch betrachtet? Das ist zum Glück bei Menschen, Mäusen und allen anderen Säugetieren grundsätzlich ähnlich geregelt: Neben einer Reihe „normaler“ Chromosomen, den sogenannten Autosomen, gibt es Geschlechtschromosomen – auch Gonosomen oder Heterochromosomen genannt. Während wir in jeder Körperzelle (abgesehen von unseren Keimzellen, also Eizellen oder Spermien) einen doppelten, zur Hälfte von der Mutter und zur Hälfte vom Vater stammenden Satz vom Aufbau her identischer Autosomen tragen, gilt das bei den Geschlechtschromosomen nur für die Frauen bzw. Weibchen, die von beiden Eltern je ein sogenanntes X-Chromosom erben. Männer bzw. Männchen erben dagegen von der Mutter ein X-Chromosom und vom Vater ein Y-Chromosom.
Das Y-Chromosom sieht unter dem Elektronenmikroskop im Grunde gar nicht wie ein Y aus; es ist einfach sehr klein und knubbelig und enthält viel weniger codierende, d. h. als Proteinbauanleitungen dienende Gene, nämlich 72 auf gut 57 Millionen Basenpaaren, als das X-Chromosom mit seinen 819 codierenden Genen auf 156 Millionen Basenpaaren. Evolutionär stammt das Y- wohl vom X-Chromosom ab, aber das ist schon sehr lange her: 240 bis 320 Millionen Jahre. An beiden Enden enthält es sogenannte pseudoautosomale Sequenzen, die direkte Entsprechungen auf den Enden des X-Chromosoms haben. Dadurch kommt es während der Meiose (der Reduktionsteilung, die bei der Bildung von Keimzellen den doppelten zu einem einfachen Chromosomensatz reduziert) an diesen Stellen zur Rekombination zwischen X- und Y-Chromosom, wie es sonst nur bei den Autosomen üblich ist. Die nicht pseudoautosomalen Sequenzen von X- und Y-Chromosom können dagegen schon sehr lange nicht mehr rekombinieren und tragen mittlerweile völlig unterschiedliche Gene.
Ein einzelnes Gen sorgt für Hoden
Die nicht pseudoautosomale Sequenz des kurzen Arms des Y-Chromosoms enthält das geschlechtsbestimmende Sry-Gen (für „sex-determining region of Y“), das ein Protein namens TDF codiert (für „testis determining factor“, zu Deutsch: Hoden-determinierender Faktor). Im jungen Embryo entstehen zunächst geschlechtsneutrale Keimdrüsen-Anlagen. Sobald im männlichen Embryo das Sry-Gen abgelesen wird, was beim Menschen ab der 7. Entwicklungswoche der Fall ist, regt das Protein TDF bestimmte Zellen in diesen Anlagen zur Testosteron-Produktion an, und aus den Keimdrüsen-Anlagen werden Hoden. In Abwesenheit eines Y-Chromosoms und damit des Sry-Gens entstehen dagegen Eierstöcke.
Ein Testosteron-Gen gibt es nicht
Es drängt sich die Frage auf, wo denn die Gene für Testosteron und die anderen Sexualhormone liegen – etwa auch auf den Geschlechtschromosomen? Die naive Annahme, die Bauanleitung für das männliche Sexualhormon sei wohl auf dem männlichen Geschlechtschromosom zu finden, kann nicht stimmen: Auch Frauen produzieren und benötigen Testosteron, und sie haben kein Y-Chromosom. Liegt das Gen also auf einem der Autosomen, die beiden Geschlechtern gemeinsam sind? Nein, es liegt nirgends: Es gibt kein Testosteron-Gen. Testosteron ist nämlich kein Protein, und Gene codieren nur Proteine.
Unsere Sexualhormone sind Steroidhormone, die in mehreren Schritten unter Beteiligung etlicher Enzyme aus (größtenteils vom Körper selbst hergestelltem) Cholesterin hergestellt werden, und zwar in den Keimdrüsen sowie der Nebennierenrinde. Gesteuert wird die Herstellung von der Hypophyse und dem Hypothalamus im Gehirn. Das Sexualhormonsystem ist so komplex und omnipräsent, dass es sinnlos wäre, ein bestimmtes Gen oder auch nur ein bestimmtes Chromosom für zuständig zu erklären. Einen guten Eindruck vermittelt diese Creative-Commons-Grafik:
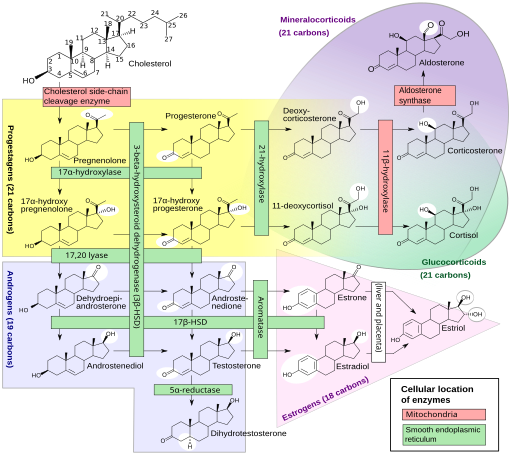
Häggström M, Richfield D (2014). „Diagram of the pathways of human steroidogenesis“. Wikiversity Journal of Medicine 1 (1). DOI:10.15347/wjm/2014.005. ISSN 20018762. (Self-made using bkchem and inkscape) [GFDL (http://www.gnu.org/copyleft/fdl.html) or CC-BY-SA-3.0 (http://creativecommons.org/licenses/by-sa/3.0/)], via Wikimedia Commons
Hormon- und Chromosomen-Wirkungen überlagern sich
An der Ausbildung der Unterschiede zwischen den Geschlechtern (beispielsweise in der Muskulatur, im Immunsystem oder im Gehirn, somit auch im Verhalten) sind weitere Gene auf dem X- und dem Y-Chromosom beteiligt, deren Wirkung nicht so gut erforscht ist wie die des Sry-Gens. Dass sie so schwer zu erforschen sind, liegt unter anderem an den Sexualhormonen, vor allem am Testosteron. Es wird bereits ab dem ersten Schwangerschaftsdrittel im Embryo produziert und prägt die gesamte weitere Entwicklung des Organismus dauerhaft. Deswegen lässt sich der reine, unverfälschte Einfluss der Geschlechtschromosomen auch nicht erforschen, indem man die neugeborenen Mäuse kastriert, sodass sie kein Testosteron mehr produzieren: Das Hormon hat dann bereits irreversible Wirkungen gezeitigt.
Selbst wenn die Hormone die geschlechtsspezifischen Effekte der Ablesung von Genen auf den Geschlechtschromosomen nicht überdecken würden, wäre es noch schwer zu ermitteln, ob und wie nun das X- oder das Y-Chromosom für einen Effekt verantwortlich ist. Wenn beispielsweise eine Erkrankung bei Männern häufiger auftritt oder dramatischer verläuft als bei Frauen, liegt das an der Ablesung eines Gens auf dem Y-Chromosom? Oder an der elternspezifischen genomischen Prägung, dem sogenannten parental imprinting, also der Tatsache, dass in allen Zellen eines Mannes das einzige, stets von der Mutter geerbte X-Chromosom aktiv ist (maternal imprinting), während im Körper einer Frau in etwa jeder zweiten Zelle das vom Vater geerbte X-Chromosom abgelesen wird (paternal imprinting)? Oder daran, dass Frauen eben zwei X-Chromosomen haben und damit u. U. über die doppelte Dosis bestimmter (in diesem Beispiel: vor Erkrankung schützender) Gene verfügen, die von der X-Inaktivierung (s. u. ) ausgenommenen sind?
Turner-Frauen, Klinefelter-Männer und der X-Dosis-Effekt
Beim Menschen lassen sich die Effekte der Geschlechtschromosomen und der Sexualhormone nicht entkoppeln, aus ethischen und aus praktischen Gründen. Gewisse Anhaltspunkte lassen sich aber aus der Untersuchung von Menschen ableiten, die nicht über den üblichen Geschlechtschromosomensatz verfügen. In der Fachliteratur werden sie häufig als experiments of nature bezeichnet.
Beim sogenannten Turner- oder Ullrich-Turner-Syndrom fehlt einer Frau eines der beiden X-Chromosomen; ihr Chromosomensatz wird als 45,X0 statt 46,XX notiert. Obwohl die Betroffenen meist ab dem Alter, in dem die Pubertät einsetzen sollte, mit Estrogen behandelt werden, hormonell also „normalen“ Frauen näherstehen als „normalen“ Männern, erkranken sie ähnlich selten wie Männer an bestimmten Autoimmunerkrankungen wie Lupus. Hier kann man einen sogenannten X-Dosis-Effekt vermuten: Irgendein Faktor, der auf dem X-Chromosom codiert ist und bei „normalen“ Frauen auf beiden Exemplaren abgelesen wird, erhöht das Erkrankungsrisiko. Hormonelle Einflüsse sind aber nicht völlig auszuschließen.
Ähnlich sieht es bei Männern aus, die neben ihrem Y-Chromosom zwei X-Chromosomen haben (Chromosomensatz 47,XXY statt 46,XY). Männer mit diesem sogenannten Klinefelter-Syndrom haben ein ebenso hohes Risiko, an Lupus zu erkranken, wie Frauen. Auch das spricht – bei aller Vorsicht wegen der gleichzeitigen Wirkung der Sexualhormone – für einen X-Dosis-Effekt.
Unvollständige X-Inaktivierung
Allerdings ist dieser X-Dosis-Effekt selbst erklärungsbedürftig. Eigentlich besagt das Dogma der X-Inaktivierung: Um die Dosis der vielen nicht für die Geschlechtsentwicklung zuständigen X-chromosomalen Gene zwischen Mann und Frau anzugleichen, wird zu einem frühen Zeitpunkt der Embryonalentwicklung in allen Zellen weiblicher Embryonen eines der beiden X-Chromosomen – und zwar zufällig das von der Mutter oder das vom Vater geerbte Exemplar – inaktiviert, indem es zu einem sehr dichten, nicht mehr ablesbaren Klümpchen verschnürt wird, dem sogenannten Barr-Körperchen. Diese Inaktivierung ist epigenetisch codiert und wird an alle durch die weiteren Zellteilungen entstehenden Tochterzellen weitergegeben. Der Körper einer Frau ist folglich ein Mosaik aus Zellkolonien, in denen das mütterliche, und solchen, in denen das väterliche X-Chromosom ablesbar bleibt.
Aber so einfach ist es nicht. Erstens scheint bei größeren X-Chromosomen-Defekten (etwa fehlenden oder verdoppelten Abschnitten) bevorzugt, d. h. nicht-zufällig, das defekte Exemplar stillgelegt zu werden. Und zweitens gibt es auf dem X-Chromosom eine ganze Reihe von Genen, die sehr wohl von beiden Exemplaren abgelesen werden. Aus dem kompakten Barr-Körperchen ragen Schlaufen nur locker aufgewickelter, sogenannter dekondensierter DNA heraus, an die die Transkriptionsmaschinerie andocken kann. Diese Stellen sind gute Kandidaten für Gene, deren Ablesung Geschlechtsunterschiede bewirkt.
Dann also Mäuse und Ratten
Wie im letzten Artikel erwähnt, lassen sich an Nagetieren (bei allen Unterschieden im Detail) Grundsatzfragen erforschen, die am Menschen niemals zu klären wären – aus ethischen und praktischen Gründen. Zufällig ist das Mäusegenom ähnlich groß wie das Humangenom: Beide umfassen etwa 23.000 bis 24.000 Gene, verteilt auf etwa drei Milliarden Basenpaare. Während Menschen 22 Autosomen-Paare sowie zwei Geschlechtschromosomen haben, verteilt sich das Hausmaus-Genom auf 19 Autosomen-Paare und ein Geschlechtschromosomen-Paar. Laborratten haben neben ihren Geschlechtschromosomen 20 Autosomen-Paare. Die Abstammungslinien der Ratten und der Mäuse haben sich vor 12 bis 24 Millionen Jahren getrennt.
Die einfachsten Experimente kommen ohne genetische Manipulation aus und wurden zum Teil schon vor einem halben Jahrhundert angestellt. Sie machen sich den aus unserer Sicht ungewöhnlichen Aufbau der Mäuse-Gebärmutter zunutze.
Testosteron: Der Positionseffekt
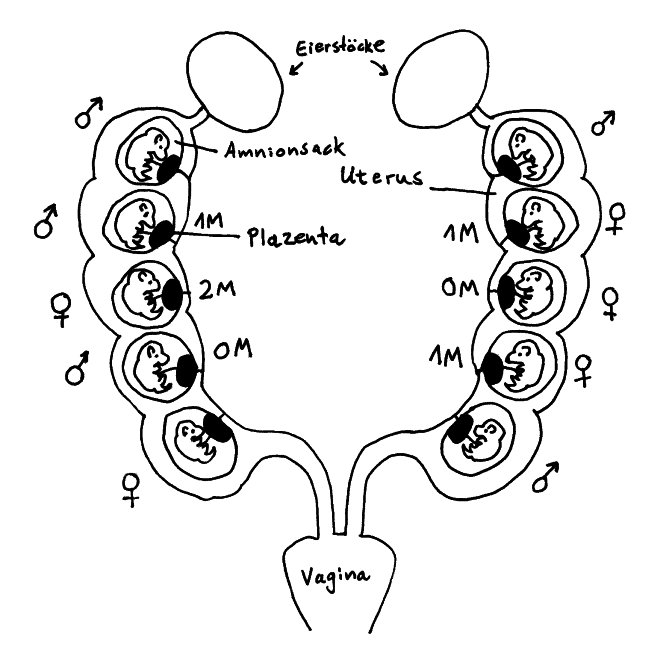
Die Gebärmutter der Maus besteht aus zwei Trakten, sogenannten Hörnern, die sich von den Eileitern bis zur Vagina erstrecken. Die Embryonen (bis zu einem Dutzend) liegen mit jeweils eigener Plazenta in separaten Amnionsäcken aufgereiht, sodass sie bis auf die Endpositionen je zwei Nachbarn haben. Das Testosteron, das die männlichen Embryonen von einem frühen Zeitpunkt an produzieren, diffundiert durch die Gebärmutter auch zu den nächsten Nachbarn hinüber.
Aus dieser Anordnung ergeben sich verschiedene vorgeburtliche Hormonmilieus: Sowohl männliche als auch weibliche Mäusebabies können 0 bis 2 männliche Nachbarn haben und sind entsprechend keinem (0M), wenig (1M) oder viel (2M) geschwisterlichem Testosteron ausgesetzt. Im Blut weiblicher 2M-Embryonen lässt sich deutlich mehr Testosteron und weniger Estrogen nachweisen als in weiblichen 0M-Embryonen.
Weibliche 2M-Embryonen werden zu leicht vermännlichten Weibchen: Ihr Anogenitalabstand (der Abstand zwischen Anus und Genitalöffnung) ist größer als bei den anderen Weibchen, sie sind weniger ängstlich, verteidigen größere Reviere, werden später geschlechtsreif, wirken auf die Männchen weniger attraktiv, haben – unter anderem wegen eines längeren Zyklus – weniger Würfe, sind aber durchaus fruchtbar und verteidigen ihre Jungen energischer gegen Angriffe als die weiblicheren Weibchen. Außerdem scheinen 0M-Weibchen mehr Weibchen und 2M-Weibchen mehr Männchen in die Welt zu setzen.
Es ist anzunehmen, dass auch die genaue Zusammensetzung, die Aktivierungsschwellen und die Reaktionsstärken des Immunsystems bei 2M-Weibchen anders ausfallen als bei 0M-Weibchen, aber das scheint an Mäusen oder Ratten noch nicht näher untersucht worden zu sein. Allerdings belegten andere Versuche, bei denen man neugeborenen Ratten Testosteron in unterschiedlicher Dosis verabreicht hat, eine Vermännlichung des Immunsystems: Die Zahl der CD4+-T-Zellen im Blut sank, und die Zahl der CD8+-T-Zellen sowie der regulatorischen T-Zellen stieg an. (Auch unter uns Menschen ist der CD4/CD8-Quotient, das Zahlenverhältnis der CD4+-T-Zellen zu den CD8+-T-Zellen, bei Männern ein wenig kleiner als bei Frauen.)
Stress wirkt ähnlich
Setzt man trächtige Mäuse hellem Licht oder Hitze oder sozialem Stress durch hohe Besatzdichten der Käfige aus, so hat das auf ihre Jungen ähnliche Auswirkungen wie das Testosteron benachbarter männlicher Embryonen: Ihre Töchter haben einen größeren Anogenitalabstand und – wie die gestressten Mütter selbst – mehr Testosteron im Blut als sonst.
Einer beliebten evolutionsbiologischen Hypothese zufolge ist das kein Zufall, sondern eine Anpassung an schwankende Umweltbedingungen: In bereits dicht besiedelten, mithin stressigen und ressourcenarmen Gebieten geborene Weibchen sind auf diese Weise aggressiver, neigen zur Abwanderung, haben weniger Würfe und bekommen mehr männliche als weibliche Junge, was die Überlebenschancen des Nachwuchses steigern dürfte. In weniger dicht besiedelten Lebensräumen, also unter weniger stressigen Bedingungen ausgetragene Weibchen entsprechen eher dem 0M-Typ, sind für die Männchen attraktiver, bekommen früher und mehr Junge, unter denen überproportional viele weitere „weibliche Weibchen“ sind, die ungern abwandern. So wächst die Population schnell an.
Insgesamt scheint das System der 0M-, 1M- und 2M-Babies die Flexibilität der Tiere bei der Anpassung an unterschiedliche Umwelten und Selektionsdrücke zu gewährleisten. Da mit der örtlichen Populationsdichte auch der Pathogendruck steigt, also mehr und andere Infektionen drohen als in dünn besiedeltem Gebiet, ist anzunehmen, dass diese Variabilität auch das Immunsystem umfasst.
Genetisch veränderte Mäuse: vier Kern-Genotypen
Aber welchen hormonunabhängigen Einfluss nehmen unsere Geschlechtschromosomen auf die Ausprägung der sekundärer und tertiärer Geschlechtsmerkmale, und wie führt das zu Geschlechtsunterschieden bei Erkrankungsrisiken? Um die Wirkung der Hormone von der Wirkung X- und Y-chromosomaler Gene außerhalb der Keimdrüsen zu trennen, muss man in das Genom der Mäuse eingreifen.
Dazu kann man zum Beispiel auf eine spontane Mutation zurückgreifen, die das Sry-Gen (und wohl nur dieses) aus dem männlichen Geschlechtschromosom der Maus entfernt. Dieser Geschlechtschromosomensatz wird als XY– bezeichnet. In einem zweiten Schritt fügt man bei einem Teil der Tiere ein Sry-Gen auf einem der Autosomen, also der Nicht-Geschlechtschromosomen ein. Das Y-Chromosom ist nun nicht mehr für die Entwicklung der Keimdrüsenanlagen zu Hoden zuständig. Man erhält vier Genotypen:
- männlicher Geschlechtschromosomensatz und männliche Keimdrüsen (XYM),
- männlicher Geschlechtschromosomensatz und weibliche Keimdrüsen (XYF = XY–),
- weiblicher Geschlechtschromosomensatz und männliche Keimdrüsen (XXM),
- weiblicher Geschlechtschromosomensatz und weibliche Keimdrüsen (XXF).
Daher werden diese Mäuse als FCG mice (für four core genotypes) bezeichnet. In den meisten Versuchen kastriert man die Tiere, sobald sie geschlechtsreif sind; d. h. man entfernt die Keimdrüsen, um akute Auswirkungen der Sexualhormone auszuschließen, insbesondere die Beeinflussung der Ablesung aller möglicher Gene. Damit verringern sich die Unterschiede zwischen den Geschlechtern, aber sie verschwinden nicht, da die Keimdrüsen und ihre Hormone die Organe und Gewebe der Tiere bis zum Zeitpunkt der Kastration irreversibel geprägt haben.
Der Vergleich der beiden F-Typen mit den beiden M-Typen, also der Mäuse ohne und mit Sry-Gen, offenbart die Auswirkungen der in den Keimdrüsen produzierten Sexualhormone – u. U. vermischt mit weiteren, nicht über die Hormone vermittelten Auswirkungen des Sry-Gens. Der Vergleich der beiden XX-Typen mit den beiden XY-Typen liefert dagegen Informationen über geschlechtschromosomale Effekte.
Dabei zeigt sich zum Beispiel, dass bei bestimmten Mäusestämmen mit einer angeborenen Neigung zu den Autoimmunerkrankungen XX-Tiere mit höherer Wahrscheinlichkeit tatsächlich erkranken als XY-Tiere, und zwar unabhängig davon, ob sie mit männlichen oder mit weiblichen Keimdrüsen zur Welt gekommen sind.
Geschlechtschromosomen-Effekt beim Mausmodell für Multiple Sklerose
Ein Forscherteam um Rhonda R. Voskuhl versucht seit über einem Jahrzehnt, anhand von FCG-Mäusen zu ergründen, ob es an den Sexualhormonen oder an den sonstigen Wirkungen der Geschlechtschromosomen liegt, dass einerseits so viel mehr Frauen als Männer Autoimmunerkrankungen wie Multiple Sklerose (MS) oder Lupus bekommen, die Krankheiten andererseits bei männlichen Patienten oft dramatischer verlaufen als bei Frauen. Bereits 2005 stellten sie fest, dass bei einem Mausmodell für MS, nämlich der experimentellen Autoimmun-Enzephalitis (EAE), das männliche Sexualhormon Testosteron die Autoimmunreaktion auf das verabreichte Autoantigen hemmt: Es verlangsamt die Vermehrung autoreaktiver Immunzellen und senkt in den Lymphknoten die Konzentration der Botenstoffe TNFα, IFNΥ und IL-10. Bei kastrierten Männchen und Weibchen fiel der Unterschied geringer aus, aber er blieb erhalten. Das konnte entweder ein langfristiger Testosteroneffekt sein, etwa eine entzündungshemmende Prägung des Immunsystems oder des von der Erkrankung betroffenen Gewebes, oder ein hormonunabhängiger Geschlechtschromosomen-Effekt.
Um das zu klären, kreuzte das Team die oben eingeführten vier Genotypen in ein Mausmodell für MS ein. Bei Mäusen mit Keimdrüsen konnten sie keinen Einfluss der Geschlechtschromosomen auf die Stärke der Autoimmunreaktion feststellen, da die akute Hormonwirkung alles überdeckte. Bei Mäusen mit weiblichen Keimdrüsen, die eine Woche vor der Verabreichung des Autoantigens kastriert wurden, tat sich ein Unterschied auf: „Normale“ Weibchen (XXF) reagierten schwächer auf das Autoantigen als Weibchen mit Y–-Chromosom (XYF = XY–). In den Tieren mit einem Y–-Chromosom vermehrten sich die Immunzellen nach der Stimulation durch das Autoantigen stärker, und sie hatten mehr TNFα, IFNΥ und IL-10 im Blut. Bei kastrierten XXM- und XYM-Mäusen war es genauso, allerdings nur, wenn zwischen Kastration und Autoantigen-Gabe genug Zeit verstrich, um das restliche Testosteron im Körper abzubauen, das andernfalls den Effekt überdeckte.
Damit war klar: Die schwächere Autoimmunreaktion der Männchen im ersten Teil des Experiments war auf die langfristigen Nachwirkungen des Testosterons zurückzuführen und nicht auf eine Schutzwirkung der Geschlechtschromosomen, denn diese wirken genau umgekehrt: Ein Y-Chromosom verstärkt die Autoimmunreaktionen – oder zwei X-Chromosomen schwächen sie ab. Die gegenläufige Wirkung von Testosteron und Geschlechtschromosomen in Männchen tauften die Autoren „Yin-Yang effect“. Nun ja.
Unklar blieb zunächst, welches der drei oben genannten Szenarien hinter der stärkeren, zur beschleunigten Neurodegeneration führenden Immunreaktion bei chromosomal männlichen Mäusen mit experimenteller Autoimmun-Enzephalomyelitis steckt: bestimmte Gene auf dem Y-Chromosom, die höhere X-Chromosomen-Dosis in den XX-Mäusen oder die genomische Prägung (parental imprinting).
Ein X-Dosis-Effekt in den Immunzellen
Weitere, ähnlich angelegte Versuche desselben Teams am selben Mäusestamm erbrachten verwirrende Ergebnisse: Die Autoimmun-Enzephalitis verlief bei kastrierten XX-Tieren (mit oder ohne Sry) nicht etwa leichter, sondern klinisch schwerer als bei kastrierten XY–-Tieren. Das lag offenbar nicht an einer größeren Empfindlichkeit ihres zentralen Nervensystems für Immunreaktionen, sondern an den Autoantigen-stimulierten Immunzellen, die, wenn sie aus chromosomal weiblichen Tieren stammten, mehr Schaden anrichteten als bei einer Herkunft aus chromosomalen Männchen.
Dasselbe galt für ein anderes Mausmodell, bei dem die Tiere eine Lupus-ähnliche Autoimmunkrankheit bekommen, wenn man ihnen die Chemikalie Pristan injiziert: Tiere mit einem XX-Chromosomensatz hatten schlechtere Überlebenschancen als solche mit XY-Chromosomensatz. Bei diesen Versuchen wirkten Ying (Testosteron) und Yang (XY-Chromosomensatz) in den Männchen also nicht gegenläufig, sondern in dieselbe Richtung.
Woran lag’s? In kastrierten XY–-Tieren waren die Konzentrationen der an Th2-Immunreaktionen beteiligten Zytokine IL-5, IL-10 und IL-13 sowie in geringerem Ausmaß auch die Konzentrationen der Th1-Zytokine TNFα und IFNΥ höher als in kastrierten XX-Tieren. Zugleich exprimieren viele Immunzellen (vor allem Makrophagen und dendritischen Zellen) in XY–-Mäuse das auf dem X-Chromosom angesiedelte Gen IL-13Rα2 schwächer als XX-Mäuse. Das Gen codiert einen Interleukin-Rezeptor, der als sogenannter decoy receptor Th2-Zytokine „ködern“ oder einfangen und damit unwirksam machen kann.
Den Zellen der XX-Mäuse stehen wegen der stärkeren IL-13Rα2-Ablesung also weniger Th2-Zytokine zur Verfügung, die Autoimmunreaktionen eindämmen können und damit vor experimenteller Autoimmun-Enzephalitis schützen. Auch bei anderen Mausmodellen für entzündlichen Erkrankungen mit Immunsystem-Überreaktion wurde eine selektive Erhöhung der IL-13Rα2-Expression nachgewiesen. Am einfachsten lässt sich die höhere Dosis des (zumindest in diesem Kontext) schädlichen Köder-Rezeptors mit einer unvollständigen X-Chromosom-Inaktivierung in XX-Mäusen erklären. Demnach handelt es sich um einen X-Dosis-Effekt.
Chimären
Es ist bekannt, dass im Gehirn besonders viele der Gene auf den Geschlechtschromosomen, insbesondere auf dem X-Chromosom, exprimiert werden. Daher wollte das Forscherteam in weiteren Versuchen klären, ob und wie die Geschlechtschromosomen neben der Stärke der Autoimmunreaktionen auch die Empfindlichkeit des zentralen Nervensystems für Beschädigungen durch diese Immunreaktionen beeinflussen.
Diese Frage klärten sie mit einem weiteren Mausmodell: Knochenmark-Chimären. Durch Bestrahlung zerstörten sie das Knochenmark und damit das Immunsystem von XX- und XY–-Mäusen, die beide mangels Sry-Gen weibliche Keimdrüsen und entsprechend ein hormonell weiblich geprägtes zentrales Nervensystem hatten. Dann ersetzten sie es durch Knochenmark (und somit Immunsystem-Stammzellen) aus XX- oder XY–-Mäusen. So entstanden vier Kombinationen:
- XX-Immunsystem mit XX-Gehirn,
- XX-Immunsystem mit XY–-Gehirn,
- XY–-Immunsystem mit XX-Gehirn und
- XY–-Immunsystem mit XY–-Gehirn.
Ein Parental-Imprinting-Effekt im zentralen Nervensystem
Durch die Verabreichung von Antigenen wurde das Immunsystem dieser Chimären zu Autoimmunreaktionen im zentralen Nervensystem angeregt. Die Autoimmun-Enzephalitis verlief im XY–-Gehirn dramatischer als im XX-Gehirn: Die Tiere konnten sich bald schlechter bewegen, ihre Nervenzellen hatten weniger intakte Myelinscheiden und Axone, und im Kortex waren mehr Synapsen verloren gegangen.
In den Kortex-Neuronen von XY–-Gehirnen wurde auch der Rezeptor Tlr7 stärker exprimiert, der eine solche Neurodegeneration fördert. Die Geschlechtschromosomen-Ausstattung des Immunsystems dieser Mäuse beeinflusste den Effekt nicht. Das Gen Tlr7 liegt auf dem X-Chromosom; am Y-Chromosom kann es also nicht liegen. Ein X-Dosis-Effekt kann es auch nicht sein, denn dann müsste das Gen in XX-Mäusen stärker exprimiert werden.
Aber ein X-Chromosomen-Gen, das je nach seiner Herkunft (Mutter oder Vater) und seiner entsprechenden epigenetischen Markierung, also dem parental imprinting, unterschiedlich stark inaktiviert wird, kann den Effekt erklären. Alle X-Chromosomen in den XY–-Mäusen stammen von der Mutter, da das Y-Chromosom nur vom Vater kommen kann. Aber nur etwa Hälfte aller Zellen in XX-Mäusen exprimiert das mütterliche Tlr7-Gen; in der anderen Hälfte stammt das Gen vom Vater. Wenn die epigenetische Markierung auf dem väterlichen X-Chromosom die Stilllegung dieses Gens fördert, verfügen XX-Mäuse insgesamt über weniger Tlr7 als XY–-Mäuse, deren Nervensystem folglich stärker degeneriert.
Ich mach mir die Maus, widewide wie sie mir gefällt?
Es gibt noch radikalere Versuche, den störenden Einfluss der Sexualhormone auf die Analyse der geschlechtschromosomalen Effekte auszuschließen: In den Embryonen der sogenannten SF1 knockout mouse verhindert eine Mutation im Gen SF1 (für steroidogenic factor 1) die Bildung von Keimdrüsen- und Nebennieren-Anlagen. Auch Teile des Hypothalamus und Hypophyse entwicklen sich nicht normal. Vor allem wegen der fehlenden Nebennierenrinde, dem Produktionsort der Corticosteroide, sterben die Tiere kurz nach der Geburt – es sei denn, man injiziert ihnen sofort Glucocorticoide und implantiert ihnen dann Nebennierenrinden-Gewebe aus intakten Mäusen.
Auch bei diesen Kreaturen unterscheiden sich die „Geschlechter“ (sofern man keimdrüsen- und sexualhormonlose Tiere mit XX- und mit XY-Chromosomen so nennen möchte) noch ein wenig, unter anderem im Körpergewicht und in der Expression eines Enzyms in einigen limbischen Gehirnstrukturen. Ob auch ihr Immunreaktionen Unterschiede aufweist, weiß ich nicht. Aber die Ergebnisse wären ohnehin sehr schwer zu interpretieren, denn diese Geschöpfe haben so viele Defekte, dass sich aus ihnen m. E. nicht viel über normale Säugetiere lernen lässt.
Und als wäre das alles nicht schon kompliziert und entmutigend genug, gibt es ein weiteres Mausmodell für Multiple Skerose, den C57BL/6-Stamm, bei dem die experimentelle Autoimmun-Enzephalitis bei Männchen und Weibchen und auch bei kastrierten Tieren mit allen vier Kern-Genotypen gleich häufig auftritt.
Zusammenfassung: Es ist kompliziert
Man kann also allerlei Mäuse züchten, Puzzle-artig zusammensetzen, zurichten, retten und opfern, um die normalerweise eng verwobenen, zum Teil gegenläufigen Effekte von Sexualhormonen, Geschlechtschromosomen-Genen und epigenetischen Markierungen dieser Gene voneinander zu trennen. Solche Experimente können beliebig kompliziert und artifiziell werden, liefern aber wichtige Hinweise auf mögliche Gründe für Geschlechtsunterschiede bei Autoimmunerkrankungsrisiken.
Leider lautet die Hauptbotschaft dieser Versuche: Es gibt keine einfache Antwort. Sexualhormone wirken sowohl lang- als auch kurzfristig, und zwar unter anderem auf das Immunsystem und auf das Gehirn. Die Geschlechtschromosomen beeinflussen ebenfalls verschiedene Systeme, darunter wiederum Immunsystem und Gehirn, und wirken den Sexualhormonen zum Teil entgegen. Darüber hinaus wirken sie auch von Organ zu Organ unterschiedlich – und über verschiedene Mechanismen, etwa X-Dosis und parentales Imprinting. Bei einigen Mausmodellen für Autoimmunerkrankungen scheinen diese Mechanismen jedoch keine Rolle zu spielen – oder sich gegenseitig aufzuheben. Und das heißt: Man muss eben doch jede Autoimmunerkrankung einzeln untersuchen, an Mäusen, aber auch an Menschen.
Literatur:
- Bruce C. Ryan, John G. Vandenbergh (2003): Intrauterine position effects (PDF)
- Arthur P. Arnold (2009): Mouse Models for Evaluating Sex Chromosome Effects that Cause Sex Differences in Non-Gonadal Tissues
- Karen M. Palaszynski et al. (2005): A Yin-Yang Effect between Sex Chromosome Complement and Sex Hormones on the Immune Response
- Deborah L. Smith-Bouvier et al. (2008): A role for sex chromosome complement in the female bias in autoimmunge disease
- Sienmi Du et al. (2014): XY sex chromosome complement, compared with XX, in the CNS confers greater neurodegeneration during experimental autoimmune encephalomyelitis
Ältere Blogbeiträge mit Literaturzusammenfassungen:
Live Fast, Love Hard, Die Young
Im vorigen Beitrag habe ich den Unterschied zwischen den Reproduktionsstrategien von Maus und Mensch erwähnt, der – neben anderen guten Gründen – die Übertragbarkeit von Ergebnissen immunologischer Studien an Labormäusen auf Menschen erschwert. Das will ich hier genauer ausführen.
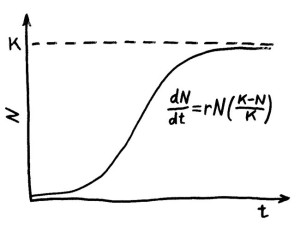
Theoretische Ökologie, erste Lektion: Malthus’sche Gleichung. Der Mathematiker Thomas Malthus beschrieb 1798 in seinem Essay on the Principle of Population das Wachstum einer Bevölkerung, deren Geburtenrate über der Sterberate liegt. Eine anfangs kleine Gründerpopulation in einem neuen Lebensraum wächst zunächst exponentiell an, und zwar mit der Wachstumsrate r: der Differenz aus Geburten- und Sterberate.
Zweite Lektion: die logistische Gleichung, eingeführt 1837 vom Mathematiker Pierre François Verhulst. Wenn die verfügbaren Ressourcen nicht ebenfalls exponentiell anwachsen, schwächt sich der Zuwachs durch Konkurrenz um diese knappen Ressourcen ab – und zwar umso stärker, je näher die Populationsgröße N der sogenannten Kapazitätsgrenze K kommt, der maximalen Tragfähigkeit der Umwelt. Die Populationsentwicklung nimmt eine S-Kurve; in einer stabilen Umwelt halten sich schließlich Zuwachs und Schwund die Waage.
Gender-Mäuschen und Badomics
Was ein „Genom“ ist, lernen wir in der Schule: die Gesamtheit der Träger der Erbinformationen eines Lebewesens. Wer sich ein wenig für Biologie oder Medizin interessiert, ist auch mit dem „Proteom“ vertraut, also der Gesamtheit aller Proteine, die in einem Lebewesen vorkommen – hergestellt mithilfe der Bauanleitungen im Genom. Beim „Mikrobiom“ fangen die Schwierigkeiten an: Genau genommen ist das die Gesamtheit aller Genome aller Mikroorganismen, die auf und in einem Wirt leben. Doch von den meisten dieser Bakterien, Viren usw. kennen wir ohnehin nichts als ihre Gensequenzen, da wir sie – noch – nicht kultivieren können. Daher nennen wir oftmals auch die Gesamtheit dieser Mikroorganismen selbst, nicht nur ihrer Genome, „Mikrobiom“. Wer pingelig ist, darf dafür gerne „Mikrobiota“ sagen; ich mache mir die Mühe nicht.
Zu jedem -om gehört eine -omik: die Lehre, die sich mit dem -om beschäftigt, mit je eigener Methodik. Irgendwann in den letzten Jahren lief die Sache aus dem Ruder: Es gibt jetzt ein Transkriptom (Gesamtheit der transkribierten mRNA) und eine Transkriptomik, ein Metabolom (Gesamtheit der Stoffwechselprodukte) und eine Metabolomik, ja sogar ein Interaktom (Gesamtheit der molekularen Wechselwirkungen in einem Lebewesen) und eine Interaktomik; das heißt: Es müssen nicht einmal mehr Objekte sein, die da zusammengefasst werden.
Bereits 2012 hatte der Biologe Jonathan Eisen die Nase voll und schrieb ein Paper mit dem schönen Titel „Badomics words and the power and peril of the ome-meme“. 2013 legte er bei Twitter nach:
The „microgenderome“ is far & away the worst #badomics word I have seen in a long time http://t.co/ziggNjWKQM h/t @iddux @bioinfosm
— Jonathan Eisen (@phylogenomics) 1. März 2013
Er bezog sich auf die Science-Ausgabe vom selben Tag, in der die Harvard-GastroenterologInnen Magdalena B. Flak, Joana F. Neves und Richard S. Blumberg unter dem Titel „Welcome to the Microgenderome“ eine im selben Heft erschienene Forschungsarbeit von Janet G. M. Markle et al. vorstellten und kommentierten: „Sex Differences in the Gut Microbiome Drive Hormone-Dependent Regulation of Autoimmunity“. Eine zweite Arbeit des Markle-Teams trug 2014 den Titel „Microbiome Manipulation Modifies Sex-specific Risks for Autoimmunity“. Eine andere Forschergruppe (Leonid Yurkovetskiy et al.), die am selben Problem arbeitet, veröffentlichte ihre Ergebnisse 2014 unter der Überschrift „Gender Bias in Autoimmunity Is Influenced by Microbiota“. Damit steht es in der Frage „Sex oder Gender?“ zwei zu zwei.
Peter Parham: The Immune System (4. Auflage)
Kurzbesprechung: gutes Buch.
Etwas länger: Im Dezember 2014 habe ich hier einige immunologische Lehrbücher vorgestellt. Mit dem „Janeway’s“ bin ich nie recht warm geworden, und die mir vorliegende 7. Auflage ist hoffnungslos veraltet. Um mich terminologisch und konzeptionell auf den neusten Stand zu bringen, habe ich mir die Ende 2014 (laut Verlagswebsite) bzw. Anfang 2015 (laut Impressum) erschienene 4. Auflage von Peter Parhams „The Immune System“ zugelegt – mit nicht allzu hohen Erwartungen, da dieses Werk auf dem ebenfalls bei Garland Science verlegten „Janeway’s“ basiert. Es richtet sich an Studentinnen und Studenten, die die Immunologie nicht zu ihrem Schwerpunkt machen wollen, und kommt daher mit gut 500 Seiten plus Anhang schlanker daher.
In Rezensionen der Vorauflage wurde der Aufbau kritisiert, den ich auch beim „Janeway’s“ verwirrend fand. Aber die mir vorliegende 4. Auflage ist einleuchtend gegliedert. Zahlreiche klare Abbildungen und Tabellen erleichtern das Verständnis und die Einordnung des Stoffs. Der Härtetest: Lässt sich der Parham als Hauptinformationsquelle für die Anlage und Überarbeitung immunologischer Wikipedia-Artikel verwenden? Ja, das funktioniert – und das lässt sich von meinen anderen Lehrbüchern nicht behaupten. Weiterlesen