Am Ende des letzten Beitrags habe ich das Protein HLA-G erwähnt, mit dem der Trophoblast – die Kontaktfläche des Embryos zum mütterlichen Gewebe – die Immunzellen in der Gebärmutter friedlich stimmt und für die nötigen Umbaumaßnahmen im Adernetz rekrutiert.
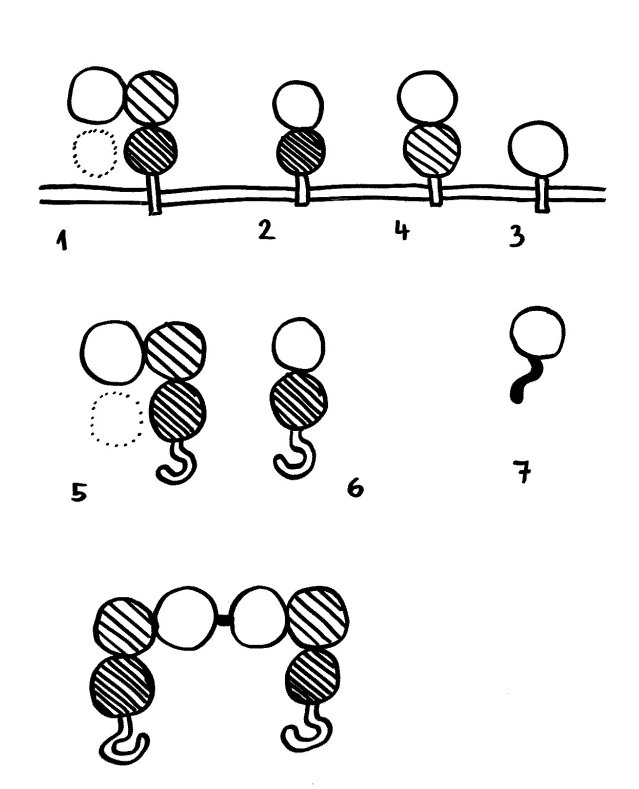
Die klassischen HLA-Moleküle wie HLA-A sind extrem polymorph, d. h. es gibt zahlreiche leicht unterschiedliche Varianten, da diese Moleküle die Aufgabe haben, Abermillionen unterschiedlicher Antigen-Bruchstücke zu binden und den Immunzellen zu präsentieren. HLA-G weist einen viel geringeren Polymorphismus auf und hat entsprechend andere Funktionen. Sein Gen liegt – wie das von HLA-A – im Haupthistokompatibilitätskomplex (MHC) auf Chromosom 6. Man kennt vier membrangebundene Formen (G1 bis G4) und drei lösliche (G5 bis G7).
Die membrangebundenen Formen können aber durch Enzyme von der Zelloberfläche abgeschnitten werden und den Zellen dann ebenfalls als lösliche Signalstoffe dienen. Einige der Formen können sich zu Dimeren zusammenlagern (s. Abb.: unten ein Dimer aus zwei HLA-G5-Molekülen).
Im gesunden Organismus produzieren außer dem Trophoblasten in der Plazenta auch der Thymus, die Hornhaut, die Nagelbetten, die Bauchspeicheldrüse und die Vorläufer von roten Blutkörperchen sowie Endothelzellen (also den Zellen in unseren Lymph- und Blutgefäßwänden) HLA-G. Bei Vireninfektionen, Krebs- und Autoimmunerkrankungen sowie nach Transplantationen können auch weitere Zelltypen HLA-G herstellen.
HLA-G gilt als Immunmodulator, also als Molekül, das Entzündungs- und andere Abwehrreaktionen dämpft und so die Immuntoleranz aufrecht erhält – zum Beispiel gegenüber dem Embryo oder dem Transplantat, aber leider auch gegenüber Tumoren, die sich gewissermaßen als Embryonen tarnen können. Sowohl die membrangebundenen als auch die löslichen Formen wirken auf mehreren Wegen, indem sie an spezifische inhibitorische Rezeptoren der Immunzellen binden:
- Sie inaktivieren zytotoxische T-Zellen (CD8+) und natürliche Killerzellen und regen sie zur Apoptose, also zum „programmierten Selbstmord“ an (s. Abb.).
- Sie verhindern die Vermehrung von CD4+-T-Zellen.
- Sie hemmen antigenpräsentierende Zellen und die Reifung von B-Zellen.
- Sie führen zu einer Th2-Polarisierung, hemmen also die Entstehung und Aktivität entzündungsfördernder Helfer-T-Zellen vom Typ 1 (Th1).
- Sie induzieren regulatorische T-Zellen (Tregs) und dendritische Zellen, die das entzündungshemmende Interleukin IL-10 absondern.
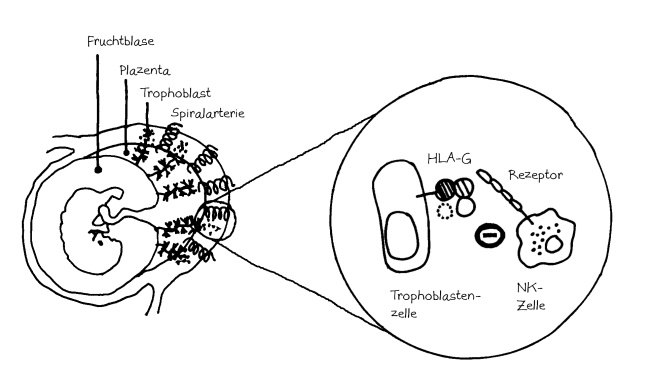
In der Gebärmutter dockt das HLA-G der Trophoblastenzellen an den inhibitorischen NK-Zell-Rezeptor ILT-2 an und hemmt so die Aktivität der natürlichen Killerzellen.
Die Herstellung von HLA-G wird durch die Ausschüttung von IL-10 angeregt und umgekehrt. Durch diese positive Rückkopplung verstärkt sich eine einmal gestartete Entzündungshemmung bzw. Toleranzförderung.
Bei einigen chronischen Entzündungen und Autoimmunerkrankungen scheint die HLA-G-Expression aus dem Gleichgewicht zu geraten zu sein. So ist im Blut der Betroffenen entweder mehr oder aber weniger lösliches HLA-G nachzuweisen als bei Gesunden. Als Ursache kommen bestimmte Genvarianten oder Allele infrage. Zum Beispiel ist bei einer Variante an einem Ende des Gens eine 14 Basenpaare lange Sequenz eingefügt (14bp INS, von „Insertion“), die bei der anderen Variante fehlt (14bp DEL, von „Deletion“). Das Vorhandensein dieser Sequenz beeinflusst die Stabilität der Messenger-RNA, die von der DNA abgelesen wird, und damit die Menge an neu produzierten Proteinmolekülen pro Ablesevorgang.
Bei der Autoimmunerkrankung Systemischer Lupus erythematosus (SLE), die das Bindegewebe zerstört und sich durch Th2-dominierte (humorale, also nichtzelluläre, stattdessen auf Antikörpern basierende) Immunreaktionen auszeichnet, ist das Allel 14bp INS beispielsweise häufiger vertreten als in der Allgemeinbevölkerung, und Menschen, die diese Variante von beiden Eltern geerbt haben, leiden einer Studie zufolge unter stärkeren Symptomen als solche, die von einem Elternteil stattdessen das Allel 14bp DEL geerbt haben.
Wie so oft bei Autoimmunerkrankungen ist der bloße Nachweis von HLA-G in einem erkrankten Gewebe noch lange kein Nachweis einer Mitverursachung der Erkrankung. Vor allem bei Th1-dominierten, also durch die zelluläre Abwehr geprägten Autoimmunstörungen kann die Expression von HLA-G in einem Gewebe, in dem es normalerweise nicht hergestellt wird, auch ein Versuch des Systems sein, die chronische Entzündung durch Stärkung des Th2-Arms und Hemmung des Th1-Arms des Immunsystems in den Griff zu bekommen. Das gilt beispielsweise für Typ-1-Diabetes.
Auch bei Multipler Sklerose (MS) scheint HLA-G eine günstige Rolle zu spielen, da es die autoreaktiven Th1-Zellen und damit die Entzündung im Gehirn bekämpft. Das passt zu der Beobachtung, dass sich die Krankheitssymptome während der Schwangerschaft, also in einer Zeit verstärkter HLA-G-Produktion, oftmals zurückbilden. Im Blut von MS-Patienten hat man auch einen neuen Typ regulatorischer T-Zellen (Tregs) entdeckt, der HLA-G produziert.
Lit.: R. Rizzo et al (2014), HLA-G molecules in autoimmune diseases and infections