Wie bin ich noch gleich auf das Thema Thymus gekommen, damals im September? Ach ja: Ich wollte im Autoimmunbuch-Manuskript „mal rasch“ erklären, wann und wie der Thymus während der Embryonalentwicklung entsteht. Ha! Haha! Nach der einen oder anderen Abschweifung komme ich nun auf diese Frage zurück – und verfolge den Werdegang des Organs gleich bis ins hohe Alter.
Entstehung des Thymus
Der Thymus wird beim Menschen recht früh angelegt, und zwar nicht dort, wo sich das Organ später befindet (zwischen Brustbein und Herz), sondern weiter oben: in der Region der dritten Kiementasche am Hals des Embryos. Dass Säugetier-Embryonen zunächst Kiementaschen ausbilden, ist einer der zahlreichen Belege für unsere stammesgeschichtliche Verwandtschaft mit den Fischen, die ja ebenfalls zu den Wirbeltieren gehören und auch (mindestens) einen Thymus haben. (Haie haben fünf Thymi, Knochenfische nur einen, wie wir Säugetiere.)
Stammzellen aus dem Endoderm – dem innersten der drei Keimblätter im jungen Embryo, aus dem unter anderem der Verdauungstrakt, die Leber und die Lunge entstehen – entwickeln sich hier zu Epithelzellen. In manchen, durchaus auch neuen Lehrbüchern ist noch von einer Beteiligung eines zweiten Keimblatts die Rede, nämlich des Ektoderms, das unter anderem die Haut und das Nervensystem hervorbringt. Tatsächlich haben Thymuszellen mit diesen Organen einiges gemeinsam, etwa die Keratinproduktion oder die Kommunikation über Neuropeptide. Nach derzeitigem Wissensstand stammen sie dennoch alle aus dem Endoderm.
Anfangs ist noch kein Unterschied zwischen einer Rinde und einem Mark zu erkennen, und es fehlen die Hohlräume zwischen den Zellen sowie die Blutgefäße. Besiedelt wird der junge Thymus mit T-Zell-Vorläufern aus dem blutbildenden Knochenmark, das wiederum dem mittleren Keimblatt entstammt: dem Mesoderm, das neben Knochen und Blut auch die Muskeln, die Nieren und das Herz hervorbringt. Die Besiedlung beginnt etwa ab Tag 60 der Schwangerschaft. Die durch Lockstoffe (Chemokine) angezogenen und anfangs – mangels Blutgefäßen – direkt durch das Gewebe einwandernden T-Zell-Vorläufer regen den jungen Thymus zur Ausbildung seiner charakteristischen Schwammstruktur, zur Differenzierung in Rinde und Mark sowie zur Ausbildung von Blutgefäßen an, über die dann weitere Prä-Thymozyten nachkommen.
Die T-Zell-Produktion setzt weit vor der Geburt ein
Sobald die Architektur steht, setzen die positive und die negative Selektion ein. Ab der 9. Schwangerschaftswoche produziert der junge Thymus zunächst sogenannte γδ-T-Zellen, die bei Erwachsenen nur etwa fünf Prozent aller Lymphozyten ausmachen und vor allem in der Haut und den Schleimhäuten sehr schnell auf Gewebsveränderungen (etwa durch Infektionen) reagieren können, da sie bereits voraktiviert in das Gewebe einwandern. Ihre T-Zell-Rezeptoren bestehen aus einer Gamma- und einer Delta-Kette und weisen eine viel geringere Diversität auf als die später viel häufigeren αβ-T-Zellen.
Ab der 10. Woche werden auch T-Zellen mit Rezeptoren aus α- und β-Ketten hergestellt, also Helferzellen (CD4+), zytotoxische T-Zellen (CD8+) und regulatorische T-Zellen (Tregs). Die Nachfahren der Einwanderer aus dem Knochenmark vermehren sich dabei enorm, sowohl im Thymus als auch anschließend in der Peripherie. So ist jeder individuelle T-Zell-Rezeptor mit dem ihm eigenen Antigen-Erkennungsmuster, der die Selektion im Thymus bestanden hat, im menschlichen Körper auf schätzungsweise 1000 bis 10.000 naiven (d. h. noch nie mit „ihrem“ Antigen konfrontiert gewesenen) T-Zellen vertreten, die von einem einzigen Thymozyten abstammen, also einen Klon bilden. Wenn eine T-Zelle ein Antigen erkennt, setzt eine weitere starke Vermehrung ein, damit der expandierte Klon die Gefahr schnell und gründlich eindämmen kann.
Der Thymus schrumpft – relativ ab der Geburt, absolut spätestens ab der Pubertät
Im voll entwickelten Thymus kommen auf jede Thymus-Epithelzelle etwa 1000 Thymozyten, also künftige T-Zellen. Bei der Geburt des Kindes wiegt das Organ – nunmehr an seiner endgültigen Position vor dem Herzen angelangt – etwa 15 Gramm, in der Pubertät etwa 35 Gramm, mit 25 Jahren etwa 25 Gramm, bei 60-Jährigen höchstens noch 15 Gramm und mit 70 Jahren gelegentlich sogar weniger als 5 Gramm. Das relative Gewicht sinkt bereits von der Geburt an kontinuierlich.
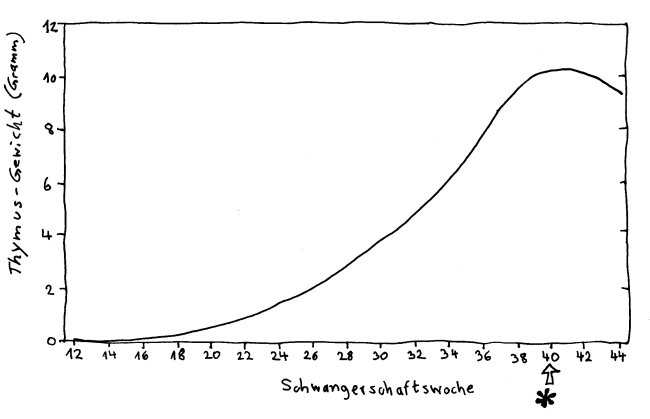
Das Thymusgewicht erreicht zur Geburt seinen vorläufigen Höhepunkt. In der Kindheit wächst der Thymus zwar weiter, aber langsamer als der Rest des Körpers. Nach FitzSimmons et al. (1988): Normal length of the human fetal gastrointestinal tract.
Schon mit etwa einem Jahr setzt beim Menschen die sogenannte Involution oder Atrophie des Thymus ein, die von außen nach innen voranschreitet: Thymus-Epithelzellen werden durch Adipozyten, also Fettzellen, sowie Bindegewebszellen ersetzt. Durch diesen Umbau kann das Gewicht noch einige Jahre weiter ansteigen, obwohl die Involution bereits in vollem Gange ist. Übrig bleiben schließlich in jedem Läppchen vereinzelte Inseln mit einem Rinden- und einem Mark-Anteil, getrennt durch nichtfunktionales Gewebe. Durch den Schwund des funktionalen Thymusgewebes sinkt auch der tägliche Output an neuen naiven T-Zellen.

Schematische Darstellung der Thymus-Involution: Funktionales Gewebe (Rinde und Mark) wird durch Fett- und Bindegewebe ersetzt. Nach R. Rezzani et al. (2014): Thymus and aging.
Der genaue Mechanismus der Thymus-Involution ist noch nicht aufgeklärt. Offenbar brauchen Thymozyten und Thymus-Epithelzellen sich gegenseitig, um zu gedeihen. Die Verkümmerung des Thymus scheint aber nicht allein durch einen Rückgang der Einwanderung von Prä-Thymozyten aus dem Knochenmark ausgelöst zu werden, denn sie lässt sich durch die Injektion frischer Prä-Thymozyten nicht aufhalten. Vielmehr scheinen die Thymus-Epithelzellen mit der Zeit ihre Zytokinproduktion umzustellen und die eingewanderten Prä-Thymozyten dann nicht mehr hinreichend bei ihrer Reifung zu unterstützen. Außerdem neigen die Thymus-Epithelzellen von Erwachsenen stärker zur Apoptose als die von Neugeborenen, sie vermehren sich schlechter durch Teilung und sie exprimieren weniger MHC-Klasse-II-Moleküle.
All das führt dazu, dass von Jahr zu Jahr weniger reife T-Zellen aus dem Thymus in die Peripherie übertreten. Aber so dramatisch der Rückgang des funktionalen Thymusgewebes mit dem Alter auch aussieht: Selbst bei 100-Jährigen gibt es noch arbeitsfähige Reste, die den T-Zell-Pool in der Peripherie regelmäßig um frische naive T-Zellen bereichern.
Thymus-Involution: schädlich, nützlich oder belanglos?
Ob die Schrumpfung des Thymus die Gesundheit älterer Menschen beeinträchtigt oder schützt, ist eine große Streitfrage, an der viel hängt. Um sie zu beantworten, kann man beispielsweise untersuchen:
- die Restaktivität des Thymus und den Zustand des Immunsystems bei alten Menschen,
- die Unterschiede in der Thymus-Involution im weiblichen und männlichen Organismus,
- die Lebensspanne und die Gesundheit nach einer operativen Entfernung des Thymus,
- andere Formen des Rückgangs der Thymus-Aktivität,
- die Auswirkungen einer experimentellen Thymus-Verjüngung,
- mathematische Modelle zum Einfluss des Thymus auf den T-Zell-Pool im Alter oder
- die Entwicklung des Thymus bei anderen Wirbeltieren.
1. Thymus-Involution und Alterung des Immunsystems
Die Änderungen, die unser Immunsystem im Lebensverlauf erfährt, sind zu umfassend, um sie hier systematisch zu besprechen – nicht ohne Grund widme ich ihnen einen der fünf Abschnitte meines Buchs. Hier beschränke ich mich auf einige wenige Aspekte des altersbedingten Nachlassens unserer Abwehrkräfte, der sogenannten Immunoseneszenz.
Im hohen Alter sind wir anfälliger für Infektionen; so entfallen 80 bis 90 Prozent aller Todesfälle bei Grippe-Epidemien auf über 65-Jährige. Alte Menschen bekommen auch mehr Autoimmunstörungen und erkranken häufiger an Krebs. Schätzungsweise 80 Prozent aller Alten haben mindestens eine chronische Erkrankung. Sowohl die zelluläre als auch die humorale, also über B-Zellen und ihre Antikörper arbeitende Abwehr lässt nach: Die B-Zellen alter Menschen sind schlechter zum Klassenwechsel imstande und stellen überwiegend Antikörper mit mäßiger Antigen-Affinität her – vermutlich, weil ihnen weniger passende T-Helferzellen zur Seite stehen. Entsprechend schlecht wirken Impfungen im hohen Alter.
Die T-Zellen, die wir im Alter produzieren, sind durch die Bindung ihres Rezeptors an das passende Antigen nicht so leicht zu aktivieren wie in unserer Jugend. Nach ihrer Aktivierung sind sie weniger teilungsfreudig als in jüngeren Jahren, und da sie weniger Chemokin-Rezeptoren ausbilden, wandern sie nicht so zielstrebig an ihren Einsatzort (sogenanntes Homing).
Allerdings altern nicht alle Menschen gleich: Bei etwa 30 Prozent der gesunden Älteren ist eine CD8+-T-Zell-Population nachweisbar, die bei Bedarf viel IL-2 produziert und ein sehr vielfältiges T-Zell-Rezeptor-Repertoire hat. Diese Zellen ähneln jungen naiven T-Zellen und sorgen für eine robuste Immunantwort, etwa bei einer Impfung. Was diese Subpopulation alter Menschen so robust macht, ist noch unklar.
Bis zum Alter von etwa 65 Jahren ist die Zusammensetzung des peripheren CD4+-T-Zell-Pools trotz der Thymus-Involution erstaunlich stabil. Stochastische Schwankungen bei den homöostatischen Zellteilungen, die Verluste ausgleichen und den T-Zell-Pool in der Peripherie in etwa gleich groß halten, können zwar zu ungleich großen Klonen führen – ebenso wie die Expansion einiger Klone während einer Infektion, die auf Kosten der anderen, noch naiven Klone geht. Aber da ein normaler naiver T-Zell-Klon etwa 1000 bis 10.000 Zellen umfasst, gehen auf diese Weise praktisch keine Antigen-Erkennungsmuster ganz verloren. Erst mit etwa 70 Jahren bricht die T-Zell-Rezeptor-Vielfalt im peripheren CD4+-T-Zell-Repertoire dramatisch ein.

Der periphere T-Zell-Pool bleibt über die Jahre etwa gleich groß, kann aber durch stochastische Schwankungen bei der homöostatischen Proliferation (Würfel) oder durch oligoklonale Expansion infolge einer Infektion (Selektionsdruck als „wind of change“) seine Zusammensetzung ändern. Sind die Klone groß genug, entstehen trotzdem keine Lücken im Antigen-Erkennungs-Repertoire. Kleine Klone können dagegen im Alter aus dem Repertoire verschwinden.
Auch das Zytokin-Milieu ändert sich mit dem Alter. Die Veränderung des peripheren CD8+-T-Zell-Repertoires setzt früher ein als die des CD4+-T-Zell-Pools: Ab dem 6. Lebensjahrzehnt vermehren sich sogenannte CD8+CD28–-T-Zellen, denen der Kostimulator CD28 fehlt und die entzündungsfördernde Zytokine wie IL-6 herstellen, stärker als andere T-Zell-Populationen. Und sie bleiben länger am Leben, weil sie kaum noch auf Apoptose-Signale reagieren, sich also dem programmierten Zelltod verweigern. Zugleich werden etwa ab dem 50. Lebensjahr weniger regulatorischen T-Zellen hergestellt, die entzündungshemmend wirken. So etabliert sich im Körper vieler (sehr) alter Menschen eine schwache, nicht lokalisierte Dauerentzündung, ein permanenter unterschwelliger Alarmzustand, Entzündungsaltern oder inflammaging genannt – von inflammation (Entzündung) und aging (Altern).
Nicht alle diese Veränderungen des Immunsystems gehen unmittelbar auf die Thymus-Involution zurück: Auch das Knochenmark, aus dem die Vorläufer der Thymozyten stammen, schrumpft und wird mit den Jahren durch Fettgewebe ersetzt. Und die Zusammensetzung der blutbildenden Zellen im Knochenmark verschiebt sich: weg von den lymphoiden Zellen (also künftigen B- und T-Zellen), hin zu den myeloiden Zellen (Zellen der angeborenen Abwehr, etwa Makrophagen und Granulozyten) – vermutlich, weil sich ein einmal etabliertes Repertoire an T- und B-Zellen mit Rezeptoren für alle möglichen Antigene durch die Bildung von Gedächtniszellen und durch homöostatische Zellteilungen erhalten kann, während die Zellen der angeborenen Abwehr kurzlebiger sind und daher bis ins Alter immer wieder durch Neuzugänge aus dem Knochenmark ersetzt werden müssen.
Außerdem sammeln sich in den Stammzellen DNA-Fehler an, zum Ausgleich werden sogenannte Tumorsuppressorgene abgelesen, die eine unkontrollierte Vermehrung fehlerhafter Zellen verhindern sollen, und die „Schutzkappen“ an den Enden der Chromosomen – die Telomere – verkürzen sich mit jeder Zellteilung, sodass viele der in den Thymus einwandernden Vorläuferzellen wegen Schäden aus dem Verkehr gezogen werden müssen. Darauf komme ich unten im Abschnitt über die Funktion der Involution zurück.
Festzuhalten bleibt vorerst, dass die Thymus-Involution viel zu früh einsetzt und zu schleichend verläuft, um allein für den ziemlich abrupten Einbruch der T-Zell-Rezeptor-Vielfalt etwa um das 70. Lebensjahr und für das inflammaging im hohen Alter verantwortlich zu sein.
2. Der weibliche Thymus altert langsamer
Auf der Suche nach den Auslösern und Regulatoren der Thymus-Involution zählten die Sexualhormone schon früh zu den Hauptverdächtigen. Schließlich haben sowohl Thymozyten als auch Thymus-Epithelzellen Rezeptoren für Sexualhormone. Vor allem männliche Hormone (Androgene) beschleunigen offenbar die Involution: Männer zwischen 20 und 60 haben im Allgemeinen einen kleineren Thymus und produzieren weniger frische naive T-Zellen als gleichaltrige Frauen; im hohen Alter gleichen sich die Verhältnisse wieder an.
Auch bei Mäusen gibt es diesen Effekt: Während die T-Zell-Produktion bei neugeborenen und bei alten Mäusen weitgehend vom Geschlecht unabhängig ist, stellt der Thymus eines jungen erwachsenen Mäuseweibchens noch viel mehr T-Zellen her als der eines jungen Männchens. Die Männchen legen dafür schneller an Gewicht und an Körperfett zu. Das könnte bedeuten, dass der männliche Organismus seine Ressourcen eher in physische Überlegenheit (zum Beispiel gegenüber Paarungskonkurrenten) steckt als in die Abwehrkräfte. Andererseits haben Studien gezeigt, dass eine übermäßige Kalorienzufuhr und Fettleibigkeit sowohl bei Mäusen als auch bei Menschen mit einer beschleunigten Thymus-Involution einhergehen. Es könnte also auch sein, dass der höhere Körperfettanteil der jungen Mäusemännchen nicht Folge, sondern Ursache des Thymus-Abbaus ist – vermittelt etwa über Hormone, die das Fettgewebe produziert.
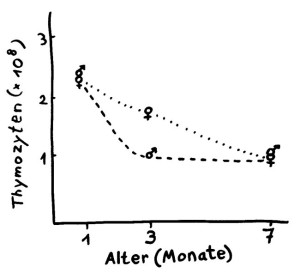
Der Thymus-Output bricht beim männlichen Geschlecht schon früh stark ein und sinkt beim weiblichen Geschlecht eher allmählich. Das gilt (wie hier) für Mäuse, aber auch für Menschen. Nach J. Gui et al. (2012): Thymus size …
Kastriert man ein junges Mäusemännchen, so vergrößert sich sein Thymus wieder. Der Effekt hält allerdings nicht an: Nach einigen Monaten schreitet die Involution wieder voran, obwohl der Organismus keine männlichen Sexualhormone mehr produziert. Das zeigt, dass die männlichen Sexualhormone die Verkümmerung des Thymus zwar beeinflussen, aber nicht verursachen. Beim Menschen mit seiner erheblich längeren Lebenszeit wird das noch deutlicher: Die normale Thymus-Involution setzt viele Jahre vor der Pubertät ein, in der unser Körper erstmals Sexualhormone produziert. Diese können diese nicht die treibende Kraft sein.
Auch wenn man den Ursachen, Auslösern oder Vermittlern der Involution so nicht auf die Spur kommt: Die geschlechtsspezifische Dynamik der Involution deutet zumindest darauf hin, dass der Rückbau dieses Organs ein planmäßiger Prozess ist, der auf die life history des Organismus abgestimmt ist.
3. Thymektomie: Wie lebt es sich ohne Thymus?
Braucht man seinen Thymus noch, nachdem man in der Kindheit ein T-Zell-Repertoire ausgebildet hat, das alle erdenklichen Antigen-Erkennungsmuster lückenlos abdeckt? Wenn ja, dann müssten Menschen, deren Thymus operativ entfernt wurde, große Gesundheitsprobleme bekommen – bis hin zu einem frühen Tod.
Zwar ist es seit etwa 30 bis 40 Jahren üblich, Kindern mit einem angeborenen Herzfehler bei der notwendigen Operation am Herzen einen Großteil des Thymus zu entfernen, weil dieser „im Weg“ liegt. Aber erstens bleiben bei diesen Thymektomien fast immer einige Thymusreste erhalten, und zweitens werden diese Operationen noch nicht lang genug durchgeführt, um schon sichere Aussagen über eine verkürzte Lebensspanne zu treffen.
Dennoch wurden bei Untersuchungen des Immunsystems der Betroffenen bereits wertvolle Erkenntnisse gewonnen: Viele von ihnen sind gesund und munter. Offenbar reicht ihr zum Zeitpunkt der Operation etabliertes Repertoire an langlebigen T-Zellen aus, um die meisten gängigen Gefahren abzuwehren. Außerdem bleibt ihr Thymusrest aktiv, ja, er regeneriert sich. Nur in den ersten fünf Jahren nach der Operation gibt es in ihrem T-Zell-Pool weniger frische naive T-Zellen als bei Nichtoperierten; danach hat sich ihre Thymusfunktion normalisiert.
Allerdings scheint das Immunsystem bei einem Teil der Operierten beschleunigt zu altern; so bekommen sie in jungen Jahren Autoimmunerkrankungen, die sonst erst Jahrzehnte später ausbrechen. Diese Menschen sind größtenteils CMV-seropositiv, das heißt, sie haben sich bereits in jungen Jahren mit dem weit verbreiteten und zumeist unauffälligen Cytomegalovirus infiziert. Dazu mehr im nächsten Abschnitt. Diese „immunologisch frühvergreisten“ Personen haben weniger CD4+– und CD8+-T-Zellen, als für ihr Alter typisch; zugleich hat eine oligoklonale Expansion vor allem bestimmter CD8+-Gedächtnis-T-Zellen stattgefunden, die große Teile der verfügbaren Überlebensnischen für T-Zellen in der Peripherie besetzt halten und ständig entzündungsfördernde Stoffe produzieren. Bei seronegativen Operierten sind die Größe und die Zusammensetzung des T-Zell-Pools dagegen normal.
4. Andere Formen der Thymus-Atrophie
Genau genommen keine Form der Thymus-Atrophie, sondern eine Krankheit, die die Entstehung eines funktionstüchtigen Thymus verhindert, ist das DiGeorge-Syndrom. Bei dieser genetischen Erkrankung haben die Betroffenen nur wenige naive T-Zellen, und ihr T-Zell-Repertoire ist oligoklonal expandiert; das heißt, einige wenige T-ZellKlone breiten sich aus. Menschen mit dem DiGeorge-Syndrom leiden häufig unter Infektionen und haben ein hohes Risiko, an Blutkrebs zu erkranken. Ihr Immunsystem ist gewissermaßen frühvergreist. Heutzutage haben sie gute Chancen, zumindest das Erwachsenenalter zu erreichen, aber geheilt werden können sie nicht: Ihr Thymus bleibt verkümmert.
Eine – zumindest zeitweilige – Schrumpfung oder Atrophie des Thymus kann unter anderem durch eine Schwangerschaft, Stillen, Infektionen, Operationen, Bestrahlung, Chemotherapie, Antibiotika, Immunsuppressoren, Transplantatabstoßung, Autoimmunerkrankungen, bestimmte Krebserkrankungen, starken psychischen Stress (etwa durch Gefangenschaft), Unterernährung oder pränatales Untergewicht ausgelöst werden.
Viele dieser Auslöser deuten auf eine Konkurrenz um knappe Energievorräte hin. Der Thymus ist offenbar kostspielig im Unterhalt und muss – da er nicht akut lebensnotwendig ist – in bestimmten Mangelsituationen zurückstehen. Sowohl bei den Krebserkrankungen als auch bei der Schwangerschaft kann aber auch etwas anderes dahinterstecken: Der Tumor bzw. das werdende Kind könnten die im Thymus befindlichen Thymozyten und Epithelzellen zum Absterben anregen, also das Immunsystem gezielt schwächen, um Abstoßungsreaktionen zu verhindern.
Bei unterernährten Kindern scheint vor allem der Zinkmangel zur Thymus-Rückbildung zu führen. Jedenfalls erholen sich die Mikroarchitektur des Organs, das Gewicht und die Funktion des Thymus in drei bis sechs Monaten, wenn man den Kindern Zink zuführt.
Auch Medikamente können den Thymus beeinflussen. So dockt das Antidiabetikum Rosiglitazon, das die Empfindlichkeit des Körpers für das selbstproduzierte Insulin erhöhen soll, an den Thymuszell-Rezeptor PPARγ an. In Mäusen fördert es die Umwandlung dieser Zellen in Adipozyten, also Fettzellen, beschleunigt so die Thymus-Involution und verringert damit die Rezeptor-Diversität im T-Zell-Reservoire. Am Menschen wurde das m. W. noch nicht untersucht.
Viele Viren wie HIV oder das Rabiesvirus (der Tollwuterreger), Parasiten wie Trypanosoma cruzi, Plasmodium berghei oder Schistosoma mansoni sowie bestimmte Pilze führen nach einer Infektion zu einer (oftmals reversiblen) Thymus-Involution. Das kann auf mehreren Wegen geschehen, etwa durch eine schwächere Vermehrung oder ein stärkeres Absterben der Thymozyten im Thymus oder ihren beschleunigten Austritt aus dem Organ. So können Infektionen auch zu Autoimmunerkrankungen führen: indem sie die Chemokinausschüttung verändern und so unreife, doppelt positive Thymozyten zum Übertritt in die Peripherie verleiten, bevor die Thymus-Epithelzellen die autoreaktiven Zellen aussondern oder in regulatorische T-Zellen umwandeln können.
Viele dieser Vorgänge sind reversibel und auch sonst untypisch für die normale Involution. Ein Sonderfall ist die persistente Cytomegalovirus-Infektion, die das Immunsystem einiger Betroffener dauerhaft vorzeitig altern lässt. Das Cytomegalovirus (CMV) gehört zur Familie der Herpesviren; etwa 60 bis 100 Prozent der Bevölkerung sind dauerhaft mit ihm infiziert – die meisten ohne Symptome. Bei einigen Infizierten vermehren sich jedoch die oben bereits erwähnten CD8+CD28–-T-Zellen, die sonst nur für das Immunsystem sehr alter Menschen typisch sind, inflationär. Diese Inflation CMV-spezifischer Gedächtnis-T-Zellen, mit der der Körper wohl die Viren in Schach zu halten versucht, geht auf Kosten der übrigen CD8+-T-Zell-Klone, sodass das Antigen-Erkennungsspektrum Lücken bekommen kann.
Ob es zu einer solchen vorzeitigen Vergreisung der Abwehrkräfte kommt, könnte vom Alter abhängen, mit dem man sich infiziert – also von der Frage, ob das T-Zell-Repertoire zu diesem Zeitpunkt schon komplett und stabil ist. Die Thymus-Involution scheint an dieser vorzeitigen Alterung des Immunsystems jedenfalls nicht schuld zu sein.
5. Versuche zur Thymus-Verjüngung
Nach Therapien (etwa einer Bestrahlung) oder bei Erkrankungen (etwa einer HIV-Infektion), die den Thymus stark schädigen, kann man versuchen, seine Regeneration zu fördern – etwa durch Interleukine, die die Thymozyten zur Vermehrung anregen. Es gibt aber auch weitergehende Ansätze, die bislang aus gutem Grund nur an Mäusen ausprobiert werden: Kann man den Thymus wirklich verjüngen, also einen bereits begonnen Abbau der Gewebestrukturen im Thymus stoppen und umkehren?
Interleukine allein reichen nicht aus. IL-7 etwa kann zwar Thymozyten älterer Mäuse zu einem frühen Reifungsschritt (dem Übergang vom DN1- zum DN2-Stadium) anregen, aber weiter kommen die Zellen nicht, wenn die Thymus-Epithelzellen in ihrer Umgebung ihnen nicht die nötige Unterstützung geben. Die Epithelzellen kann man mit Wachstumshormonen und Wachstumsfaktoren wie IGF-1 oder KGF dazu bringen, länger zu leben, sich stärker zu vermehren und Zytokine auszuschütten, die wiederum das Überleben der Thymozyten fördern. Der Thymus wächst, der T-Zell-Pool verjüngt und vergrößert sich.
Allerdings ist noch völlig unklar, ob dieser Effekt anhält, ob die Ergebnisse auf Menschen übertragbar sind (siehe unten unter 7.) und ob man für diese Thymus-Verjüngung nicht einen hohen Preis zahlen würde (siehe unten unter Funktion der Involution).
6. Mathematische Modelle zum Rückgang der T-Zell-Vielfalt im Alter
Um zu klären, ob eher der Rückgang der Neuzugänge aus dem verkümmernden Thymus oder Vorgänge in der Peripherie zu dem abrupten Einbruch der T-Zell-Rezeptor-Vielfalt im T-Zell-Pool alter Menschen führen, muss man nicht unbedingt Tierversuche oder Studien an Menschen durchführen: Man kann auch mathematische Modelle konstruieren und prüfen, ob Simulationen auf Basis dieser Modelle den beobachteten Einbruch der T-Zell-Diversität im Alter reproduzieren oder nicht (Philip L. F. Johnson et al, 2012). Die Modelle sind aus der theoretischen Ökologie und der Populationsgenetik abgeleitet, in denen der Einfluss von Migration, genetischer Drift, veränderten Populationsgrößen sowie Mutation und Selektion auf die Diversität einer Population untersucht wird.
In solchen Modellen kann man beispielsweise die Wanderungen von Gnus, Zufallsschwankungen beim Paarungserfolg, die Reduzierung von Wildbeständen durch schrumpfende Lebensräume und die natürliche Auslese durch die Anwesenheit von Krokodilen abbilden – aber ebenso gut den mit den Jahren schwindenden Nachschub naiver T-Zellen aus dem Thymus, stochastische Schwankungen bei der T-Zell-Proliferation in der Peripherie, die allmähliche Verkleinerung des T-Zell-Pools im Zuge unserer Alterung und eine Zunahme der Teilungsrate bestimmter Klone durch genetische oder epigenetische Veränderungen der Zellen in der Peripherie.
Dabei zeigt sich: Ohne Mutation und Selektion in der Peripherie, ohne oligoklonale Expansion lässt sich mit realistischen, für Menschen typischen Parametern kein abrupter Rückgang der T-Zell-Rezeptor-Diversität im hohen Alter simulieren – auch nicht mit einer sehr starken Thymus-Involution, etwa einem kompletten Stopp der Einwanderung frischer naiver T-Zellen ab dem 20. Lebensjahr. Erst Zellveränderungen in der Peripherie, die die Teilungsrate einzelner Klone erhöhen, können zur Auslöschung so vieler andere Klone führen, dass die Diversität im hohen Alter einbricht.
Sollten diese Modelle die tatsächlichen Verhältnisse richtig abbilden, wäre es sinnlos, die Immunoseneszenz durch eine Thymus-Verjüngung verhindern zu wollen, weil der Thymus beim erwachsenen und erst recht beim alten Menschen kaum noch einen Einfluss auf die Rezeptorvielfalt im T-Zell-Pool hat.
7. Thymus-Involution bei anderen Wirbeltieren
Beim Metzger kann man Kalbsbries ordern, aber kein Rinderbries: Auch bei Rindern verkümmert der Thymus nach wenigen Monaten. Eine Thymus-Involution findet bei allen Wirbeltieren statt: bei Säugetieren wie Vögeln oder Amphibien. (Bei Wirbeltieren, die eine Winteruhe oder einen Winterschlaf abhalten, schrumpft und wächst der Thymus außerdem saisonal.) Die Thymus-Involution ist demnach stammesgeschichtlich sehr alt, und sie ist evolutionär konserviert: Es sind keine Ausnahmen bekannt, lediglich Unterschiede im Zeitverlauf und in der Art und Weise der Schrumpfung (mit oder ohne Fetteinlagerung). Das spricht stark für eine wichtige Funktion dieses Vorgangs.
Trotzdem können wir an Mäusen, Ratten, Zebrafischen oder andere Standard-Versuchstieren gewonnene Erkenntnisse nicht einfach auf den Menschen übertragen. Wie in einem anderen Beitrag ausgeführt, haben kurzlebige Tiere eine ganz andere life history als langlebige Lebewesen wie der Mensch: Sie investieren beispielsweise mehr Energie in möglichst viel Nachwuchs, der sehr früh von den Eltern unabhängig und seinerseits geschlechtsreif wird. Auch ihr Immunsystem ist auf diese Lebensweise eingestellt.
Das betrifft auch die Thymus-Involution und ihren Einfluss auf die Zusammensetzung des peripheren T-Zell-Pools. Bei Mäusen sind beispielsweise die einzelnen T-Zell-Klone viel kleiner als beim Menschen, das heißt, es gibt viel weniger T-Zellen mit exakt demselben T-Zell-Rezeptor, sodass stochastische Schwankungen oder Selektionsereignisse in der Peripherie viel leichter Löcher in das Spektrum der Antigen-Erkennungsmuster reißen können. Die naiven CD4+– und CD8+-T-Zellen von Mäusen halten sich auch viel kürzer: Ihre Halblebenszeit beträgt 7 bzw. 8 Wochen, verglichen mit 6 bzw. 9 Jahren beim Menschen.
Wie schaffen es Mäuse, mit ihren kleinen Klonen auf kurzlebigen T-Zellen dennoch immerhin zwei, drei Jahre zu überleben? Durch ständigen Nachschub aus dem Thymus, bis ins hohe Alter. Diese frischen T-Zellen aus dem Thymus stellen bei ihnen fast den gesamten peripheren T-Zell-Pool, während dieser beim Menschen – zumal im Alter – von Zellen dominiert wird, die aus homöostatischen Teilungen von Zellen hervorgehen, deren Urahnen irgendwann aus dem Thymus in die Peripherie eingewandert sind.

TRECs (TCR excicion circles) sind DNA-Ringe, die bei der somatischen Rekombination der TCR-Gene von Thymozyten im Thymus anfallen. Sie werden bei den folgenden Teilungen der T-Zellen nicht mitkopiert, sodass ihr Gehalt ein Maß für „frischen“ Thymus-Output ist. Bei Mäusen bleibt der TREC-Spiegel in den T-Zellen bis ins hohe Alter hoch, bei Menschen sinkt er mit den Jahren: Der T-Zell-Pool erwachsener Menschen besteht größtenteils aus Zellen aus homöostatischen Teilungen und wird nur in geringem Umfang aus dem Thymus aufgefrischt. Nach Zhang/Bhandoola (2012): Losing TTREC with age.
Schon kurz nach der Geburt machen neu aus dem Thymus dazugekommene Zellen nur etwa 50 Prozent unseres naiven T-Zell-Pools aus. Bei alten Menschen liegt ihr Beitrag bei nur noch etwa 10 Prozent. Leider lassen sich frische naive T-Zellen mangels eindeutiger Marker bisher nicht sicher von den Produkten homöostatischer Zellteilungen unterschieden, sodass wir nicht wissen können, ob sie sich in ihren immunologischen Eigenschaften unterscheiden.
Es mag sein, dass der dramatische Einbruch der T-Zell-Diversität, der das Immunsystem alter Menschen auszeichnet, eine Folge dieser Dominanz der homöostatischen Zellteilungen ist. Aber das heißt noch lange nicht, dass wir unseren Thymus künstlich verjüngen sollten, um diesen Einbruch zu vermeiden: Erstens altert ja auch der Mäuse-Thymus – und produziert dennoch bis zum Ende genug frische T-Zellen. Zweitens kann eine Strategie der ständigen Pool-Auffrischung, die für Wesen mit einer Lebensdauer von zwei, drei Jahren gut funktioniert, für Wesen mit einer Lebenserwartung von 80, 90 oder 100 Jahren fatal sein.
Die Funktion der Involution: Energiesparen oder Tumorvermeidung?
Die Thymus-Involution setzt zwar viel früher ein als die üblichen Alterserscheinungen. Dennoch wird eine der wichtigsten Theorien über das Altern auch zur Erklärung dieses Vorgangs herangezogen: die disposable soma theory, der zufolge es Verschwendung wäre, Gewebe, das entbehrlich geworden ist, weiter zu unterhalten. Der Thymus mit seiner komplexen Feinstruktur, den vielen Thymozyten-Teilungen und der Entsorgung der aussortierten Zellen verschlingt sehr viel Energie. Sobald das Organ seine Hauptaufgabe erledigt hat, nämlich die Etablierung eines lückenlosen und stabilen T-Zell-Rezeptor-Repertoires in der Peripherie, wird ein Teil dieser Ressourcen besser in den Unterhalt des restlichen Körpers und in Funktionen wie Wachstum oder Fortpflanzung investiert, um die Fitness des Organismus zu maximieren.
Wie lange der Thymus benötigt wird, dürfte von der Lebensdauer und -weise des Wirbeltiers abhängen. Der Thymus von Zugvögeln und anderen weit wandernden Tiere, die immer wieder mit neuen Pathogenen und anderen Gefahren konfrontiert werden, involviert langsamer als der von ortsfesten Wirbeltieren, die vermutlich ein kleineres Antigen-Erkennungsspektrum haben.
Die Involution könnte aber auch notwendig sein, um Risiken zu minimieren, die mit dem langfristigen Betrieb des Organs einhergehen. So könnten sich Pathogene darauf verlegen, in den Thymus einzudringen, um sich unter die dort präsentierten Autoantigene zu mischen und sich so eine Toleranz des Immunsystems gegen diese Antigene zu erschleichen. Das kann der Thymus am besten verhindern, indem er den größten Teil des T-Zell-Repertoires bereits vor und kurz nach der Geburt anlegt und sich dann zur Ruhe begibt.
Mit der Zeit sammeln sich in unseren Zellen DNA-Fehler und andere Schäden an, die dazu führen, dass sich viele alte Zellen unkontrolliert vermehren und so Tumoren hervorbringen. Thymus-Tumoren sind relativ selten – vielleicht aber nur deshalb, weil weite Teile des Organs rechtzeitig stillgelegt werden. Schließlich zeichnet es sich durch besonders hohe Zellteilungsraten aus. Unsere Zellen enthalten sogenannte Tumorsuppressorgene, die vor allem in Zellen aus älteren Organismen abgelesen werden und die Aufgabe haben, aus dem Ruder laufende Zellen rechtzeitig zum Absterben zu bringen, bevor sie sich zu Krebs auswachsen. Transgene Mäuse, in deren B- und T-Zell-Vorläufern Tumorsuppressorgene ausgeschaltet wurden, bekommen tatsächlich häufiger Blutkrebs – und ihre Thymus-Involution läuft verlangsamt ab.
Ausblick: Thymus-Veränderungen und Autoimmunerkrankungen
Die Thymus-Involution kann also eine Sicherheitsmaßnahme sein. Die meisten Thymus-Tumoren, die trotzdem entstehen, sind zum Glück gutartig. Auffällig oft leiden die Betroffenen zugleich unter einer Autoimmunerkrankung. Damit sind wir endlich wieder beim Hauptthema meines Blogs und Buchs angelangt. Die Zusammenhänge zwischen Autoimmunerkrankungen und Auffälligkeiten im Thymus werde ich im nächsten Artikel behandeln – dem hoffentlich letzten Blog-Text zu diesem seltsamen Organ. Ich suche schon mal ein Kalbsbries-Rezept, um diesen Abschluss gebührend zu feiern.