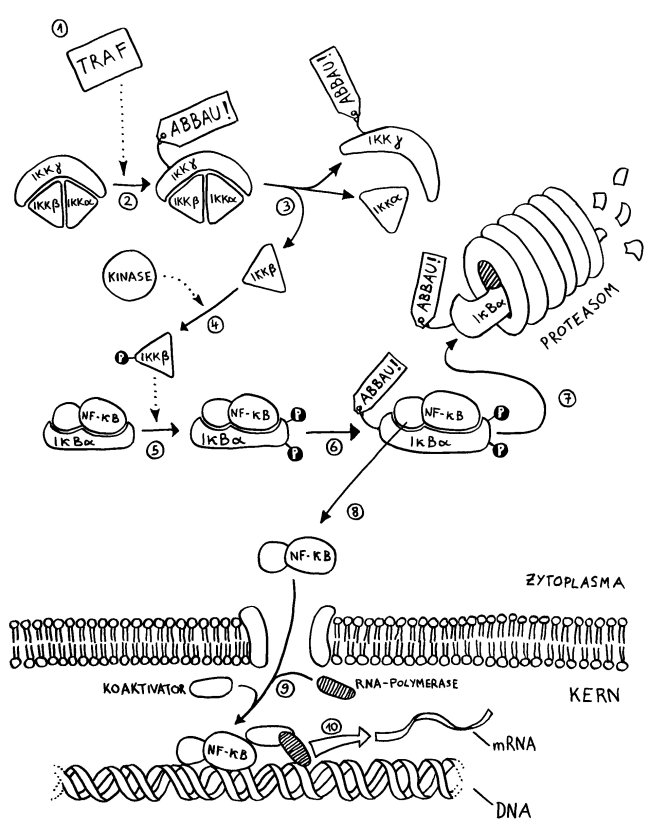
- Ein TNF-Rezeptor-assoziierter Faktor (TRAF) wurde an der Innenseite eines Rezeptors in der Zellmembran aktiviert und löst den weiteren Signalweg aus.
- Er ubiquitiniert die Kinase IKKγ im IKK-Komplex, der daraufhin seine Gestalt ändert.
- Die Kinase IKKβ löst sich von IKKα und IKKγ.
- IKKβ kann nun durch eine andere Kinase phosphoryliert und damit aktiviert werden.
- Der zweiteilige Transkriptionsfaktor NF-κB ist noch an den Inhibitor IκBα gebunden. Aber jetzt phosphoryliert die aktivierte Kinase IKKβ den Inhibitor doppelt.
- Daraufhin wird der Inhibitor ubiquitiniert und damit zum Abbau freigegeben.
- Der Komplex zerfällt; der Inhibitor wird in einem Proteasom zerlegt.
- Der Transkriptionsfaktor NF-κB ist befreit und kann durch eine Pore in der Kernhülle vom Zytoplasma in den Zellkern einwandern.
- Im Zellkern lagern sich ein Koaktivator und das Enzym RNA-Polymerase mit dem Transkriptionsfaktor zusammen.
- Der Komplex dockt am abzulesenden Gen an und startet dessen Transkription: Es entsteht Messenger- oder mRNA, die die Informationen für die Synthese eines Proteins enthält, z. B. eines Zytokins. Die mRNA wandert dann ins Zytoplasma, wo sie als Vorlage für die Proteinsynthese (Translation) dient.
Sie dürfen diese Zeichnung gerne in Folien etc. übernehmen, sofern Sie die Quelle angeben: Dr. Andrea Kamphuis, https://autoimmunbuch.de