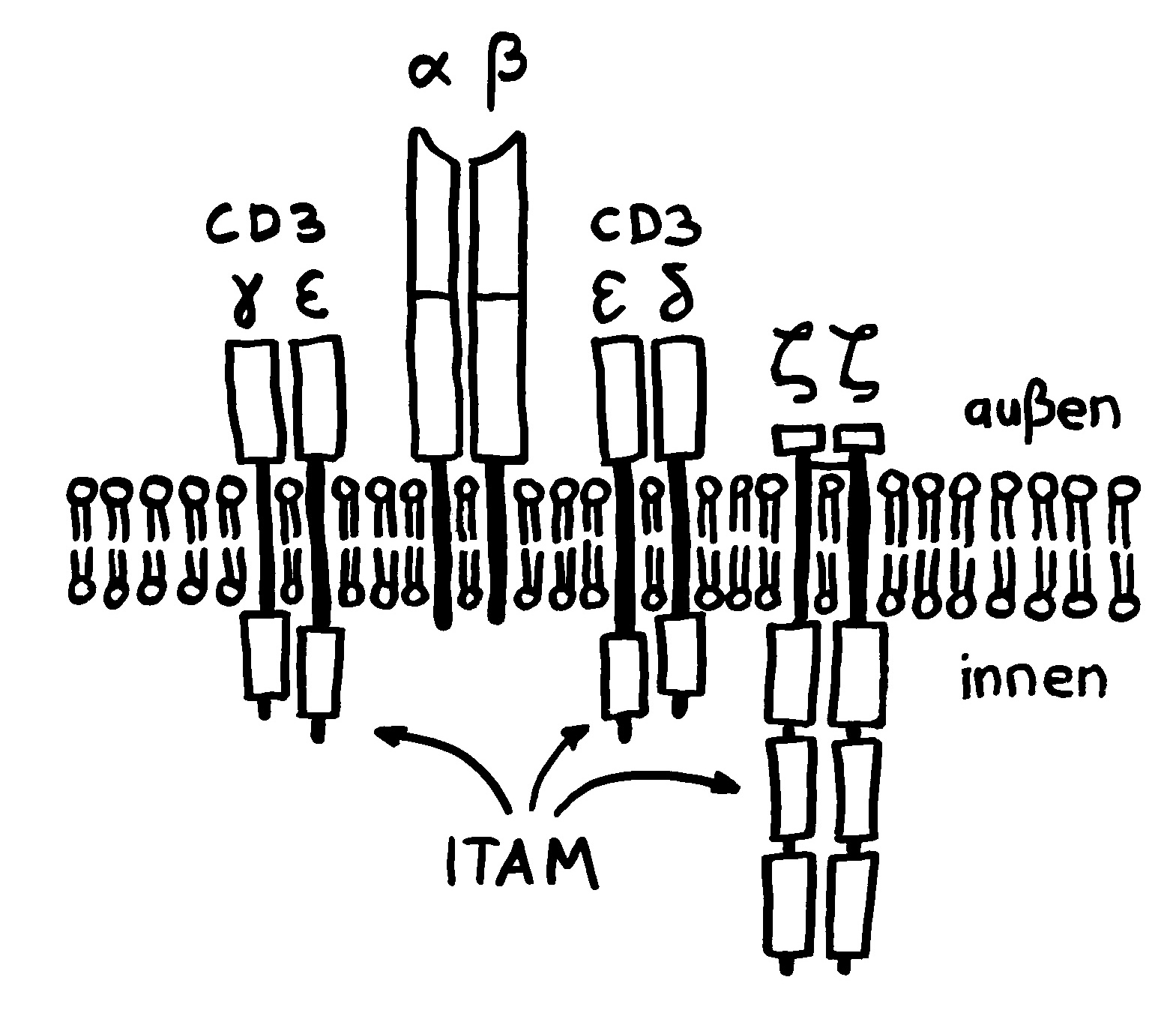
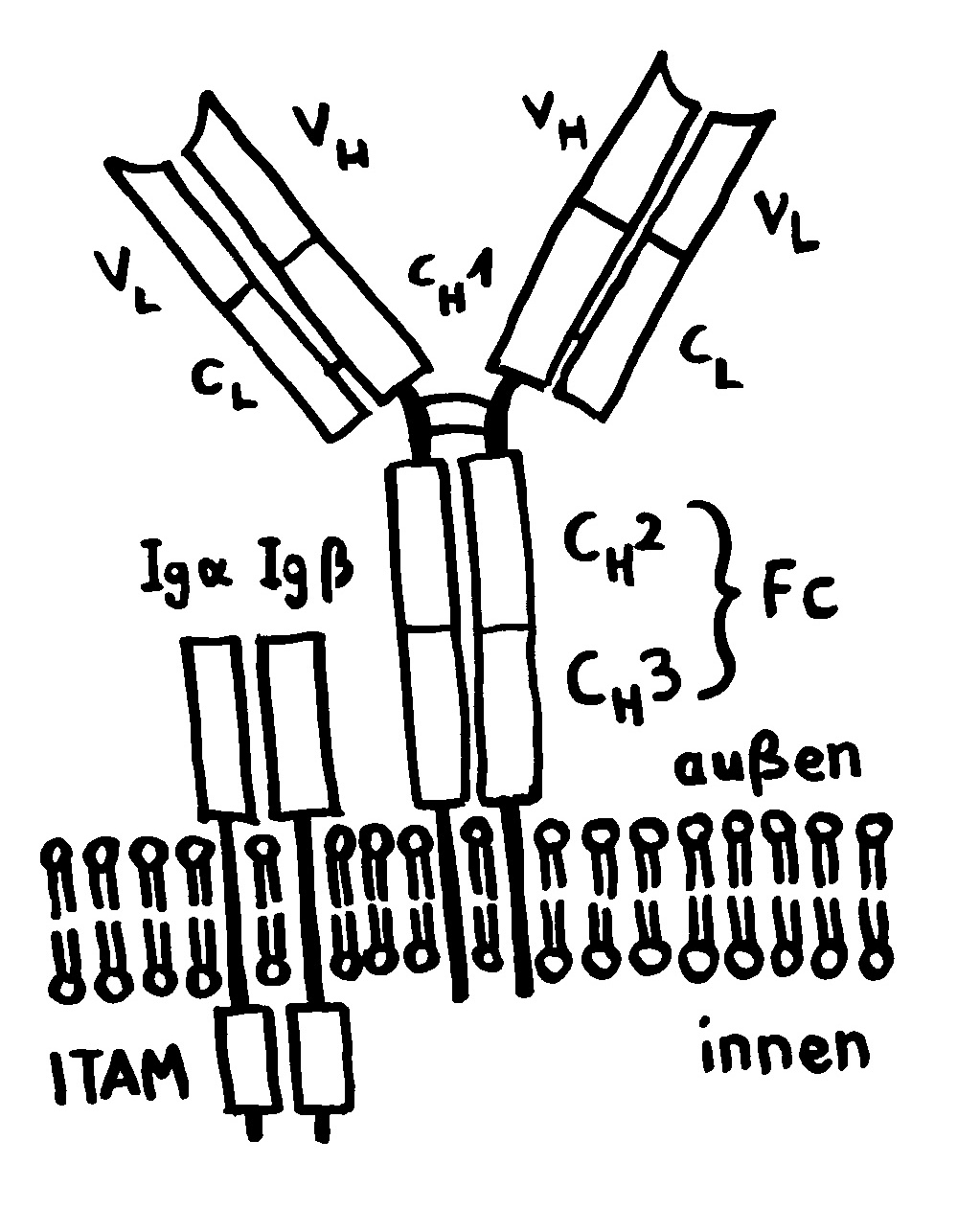
Der T-Zell-Rezeptorkomplex besteht aus vier Proteinen. Genau wie beim B-Zell-Rezeptor sind es die Begleitproteine, die mit ihren ITAM-Sequenzen die innerzelluläre Signalkette starten, sobald die zentrale Einheit mit dem variablen Ende ihrer α- und β-Kette an ein MHC-Molekül bindet, das mit einem passenden Antigen beladen ist.
Sie dürfen diese Zeichnung gerne in Folien etc. übernehmen, sofern Sie die Quelle angeben: Dr. Andrea Kamphuis, https://autoimmunbuch.de