Biomphalaria glabrata, Quelle: Fred A. Lewis, Yung-san Liang, Nithya Raghavan & Matty Knight, CC BY 2.5
Aus dem dicken 4. Kapitel des Buchs notiere ich hier nur diejenigen Stellen, die für Band 2 des Autoimmunbuchs relevant werden könnten. Wie in den bisherigen Notizen zum Buch löse ich Abkürzungen nicht auf usw.; daher liest sich das Folgende nicht schön und bleibt für Leute, die sich mit der Biologie des Immunsystems nicht auskennen, kryptisch.
Somatische Evolution von Immunsystemen, die Protein-Sensoren verwenden: Wird die Schnecke Biomphalaria glabrata von parasitären Würmern angegriffen, sammeln die Rezeptorgene aus der FREP-Familie (fibrinogen-related protein) zufällige somatische Mutationen (Genkonversion sowie Punktmutationen) an, was offenbar hilft, die Parasiten abzuwehren, deren Antigene sich rasch ändern. [Adema C.M. 2015, Fibrinogen-Related Proteins (FREPs) in Mollusks: FREPs sind Plasma-Lektine, die auf Antigene reagieren und 1-2 Immunglobulin-Domänen enthalten. Sie sind sehr polymorph, jede Schnecke hat ein anderes, zudem dynamisches Repertoire. Da nichts auf eine Selektion besonders wirksamer Varianten oder ein immunologisches Gedächtnis hinwiest, verleiht die FREP-Diversifizierung der Schnecke wohl eine antizipative, aber nicht adaptive Immunität.] Dieser Mechanismus blieb eine Fußnote in der Geschichte des Immunsystems; echte proteinbasierte adaptive Abwehr kam erst bei den Wirbeltieren auf.
Toleranz bei Kieferlosen: Jedes hinreichend große Antigen-Repertoire, das durch zufällige Mutationen entsteht, geht zwangsläufig mit tödlichen Autoimmunreaktionen einher. Mit jeder adaptiven Abwehr muss also zugleich ein mächtiger Mechanismus entstehen, der Rezeptoren, die auf Elemente des Selbst reagieren, unterdrückt oder eliminiert. Auch bei den Neunaugen und Schleimaalen muss es einen solchen Toleranzmechanismus geben; er ist aber noch völlig unbekannt!
MHC-Polymorphismus: MHC Klasse I wird auf jeder Zelle mit Zellkern exprimiert, MHC Klasse II auf APC und weiteren Zelltypen -> massives Investment von Energie und Metaboliten. Die Zahl der MHC-Varianten in einem Individuum ist ein Trade-off zwischen diesem Ressourceneinsatz und dem Fitnessgewinn durch ein Peptid-erkennendes T-Zell-System. [Buch: siehe Fische, bei denen Weibchen durch die Partnerwahl die MHC-Diversität im Nachwuchs nicht zu maximieren, sondern auf ein optimales = mittleres Niveau zu bringen versuchen!]
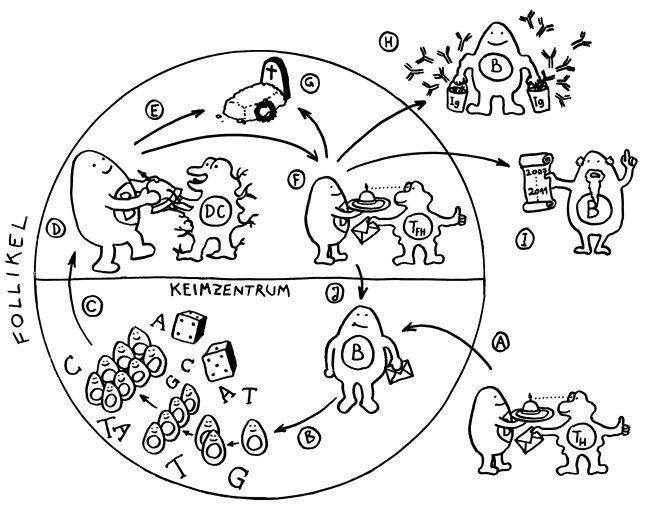
Wechselwarme Wirbeltiere, die keine Keimzentren in den Lymphknoten haben, haben entsprechende Schwierigkeiten, ihre Immunantwort „reifen“ zu lassen (somatische Hypermutation usw.).
Vinuesa C. G. et al. 2016: „Immunity operates on the edge of autoimmunity. The more potent an immune response is, the greater the risk of auto-reactivity an self-harm.“
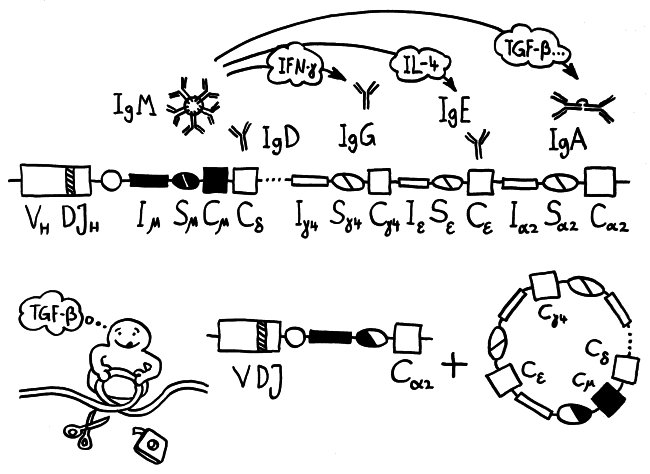
Gute Erklärung für Klassenwechsel in B-Zellen von Kiefermäulern: B-Zellen sammeln und analysieren Informationen über Zytokine u. a. Faktoren in ihrer direkten Umgebung und entscheiden anhand dessen, welches Effektorsystem mit dem antigenbindenden Teil des BCR verknüpft wird: Aktivierung Komplementsystem, Phagozytose durch Makrophagen, Schleimhaut mit löslichen Rezeptoren = Antikörpern präparieren, AK durch Plazenta schicken … Das lässt sich am besten erreichen, wenn der ganze antigenbindende Teild es BCR als Modul auf eine Reihe verschiedener konstanter Regionen gepfropft wird, die die Effektorfunktion des Moleküls festlegen -> Klassenwechsel-Rekombination.
Diversität der V-, D-, J-Module, durch deren Rekombination BCR, AK und TCR entstehen: Je größer die Genfamilien werden, desto geringer ist der Selektionsdruck auf jede einzelne Variante -> Mutationen sammeln sich an -> Verfall zu Pseudogenen. Kaninchen und Hühner sowie weitere Wirbeltiere haben nur ein einziges intaktes V-Segment. Sie lösen das Problem der zu geringen Vielfalt mit der „Methode Neunauge“: Nachdem RAG-Rekombinase das letzte verbleibende V-Gensegment mit D und J verbunden hat, wird durch AID-vermittelte Genkonversion Information aus den Pseudogenen in das rearrangierte VDJ-Gensegment hineinkopiert.
Selektive Nische, in der mehrfach adaptive Abwehr entstand: Proteinbasiertes antizipatives adaptives IS erfordert sehr große Zahl unterschiedlicher Rezeptoren. Da jeder Lymphozyt nur 1 spezifischen Rezeptor trägt, müssen ständig sehr viele Lymphozyten produziert werden, von denen die meisten gleich wieder einkassiert werden und unter den Überlebenden die meisten nie dem passenden Antigen begegnen. Metabolisch kostspielig, lohnt sich nicht für kleine, kurzlebige Vielzeller mit wenigen Immunzellen wie Würmer oder Taufliegen. Erst zu Beginn der Wirbeltier-Evolution wurde die Generationslücke zwischen sich schnell reproduzierenden Pathogenen und immer größeren und langlebigeren Tieren groß genug, dass sich der Unterhalt eines adaptiven IS lohnte.
Evolutionäre Beziehung zwischen adaptiven Abwehrsystemen der Kieferlosen und der Kiefermäuler: Analogie oder Homologie? Vergleich mit Augen-Evolution als Bsp. für „tiefe“ Homologie: Strukturell sehr verschiedene Systeme bauen alle auf Pax6-Transkriptionsfaktor-Kaskade auf. TF-Netzwerke sind sehr schwer evolutionär zu ändern, wenn erst die passenden Erkennungssequenzen an den Anfang der von ihnen gesteuerten Gene eingebaut sind -> hochgradig konserviert. Zugleich gibt es so viele unterschiedliche TF, dass es schon ein arg unwahrscheinlicher Zufall wäre, wenn in 2 so unterschiedlichen adaptiven Immunsystemen dieselben TF auftauchen. B-Zellen sind die einzigen Blutzellen, in denen TF Pax5 zum Einsatz kommt; in den Neunaugen wird Pax5 nur in den VLRB-Zellen exprimiert, die – wie B-Zellen – nach ihrer Aktivierung eine lösliche Form ihres Rezeptors herstellen. Auf vergleichbare Weise ähneln die TF-Profile der VLRA- und VLRC-Zellen jenen der Alpha-beta- und der Gamma-delta-T-Zellen -> Homologie. Die 2. starke Homologie ist die Existenz von spezialisierten FOXN1- und DLL4-exprimierenden sekundären Lymphorganen, nämlich Thymus und „Thymoid“.
Evolution der AID-artigen Cytidin-Aminase-Funktionen: Zu Beginn der Wirbeltier-Evolution tauchte eine neue Familie von Cytidin-Deaminasen auf, die „aktivierungsinduzierten Deaminasen“ (AID). Im kieferlosen Neunauge spielen diese Enzyme die Schlüsselrolle bei der Genkonverson, die zum adaptiven Rezeptor-Repertoire führt. Bei den Kiefermäulern ist stattdessen die RAG-Rekombination dafür zuständig. Das sind zwei recht unterschiedliche Mechanismen; wie ist der Übergang gelaufen? Große Sprünge macht die Evolution nur selten. Es gibt tatsächlich Übergänge: Im Ammenhai, einem basalen Kiefermäuler, arbeiten RAG und AID offenbar noch zusammen, um das primäre Repertoire zu bilden. Auch später wurde diese Funktion der AID nicht völlig vergessen, wie das Bsp. der AID-vermittelten V-Genkonversion bei Hühnern und Kaninchen (s. o.) zeigt. Als RAG im Laufe der Kiefermäuler-Evolution die Rolle des primären Erzeugers der Rezeptordiversität zunehmend allein übernahm, wurde AID frei für neue Rollen wie die Initiation der Klassenwechsel-Rekombination und der somatischen Hypermutation bei B-Zellen in den Keimzentren, die bei den Kieferlosen kein Pendant haben.
Eigentümlichkeit bei den Knorpelfischen: nicht ein einziger großer Cluster von V, D, J, die dann rekombinieren, sondern mehrere Mini-Cluster, die jeweils wenige V-, D- und J-Segmente enthalten – oftmals schon in der Keimbahn rekombiniert zu D-J-, V-D- oder sogar V-D-J-Segmenten (Lee et al. 2000: Rearrangement of immunoglobuline genes in shark germ cells). Demnach muss RAG in den Vorfahren in der Keimbahn aktiv gewesen sein – evtl. eine Strategie, um neue keimbahncodierte Rezeptoren der angeborenen Abwehr zu erschaffen. Evtl. geht die RAG-basierte adaptive Abwehr in den Kiefermäulern also auf ein Versehen zurück, als RAG nicht in der Keimbahn, sondern in Lymphozyten-Vorläufern exprimiert wurde. Ähnliches kann mit der AID-Expression in den Kieferlosen geschehen sein.