Eigentlich wollte ich mich bei Twitter und hier im Blog nicht über COVID-19 äußern, weil ich meiner Meinung nach zu wenig Ahnung davon habe. Mehr Ahnung als die allermeisten, die sich keinerlei Zurückhaltung auferlegen, aber eben doch zu wenig, um etwas Sinnvolles zur Verbesserung der Lage beizutragen.
Das habe ich schon bei Twitter nicht ganz durchgehalten. Und inzwischen gibt es erste Berichte, die in mein Wissensgebiet fallen und die ich daher kurz einordnen möchte: Man hat untersucht, wie das Immunsystem von Patient*innen auf eine SARS-CoV-2-Infektion reagiert. Ich gehe hier zum einen auf eine Besonderheit bei der Antikörper-Produktion ein, die kürzlich im Ärzteblatt mitgeteilt wurde, und zum anderen auf die Nachricht, dass Kuba mit seiner Interferon-alpha-2b-Produktion anderen Ländern bei der Behandlung der Betroffenen helfen will, wie die taz am 20. März berichtete.
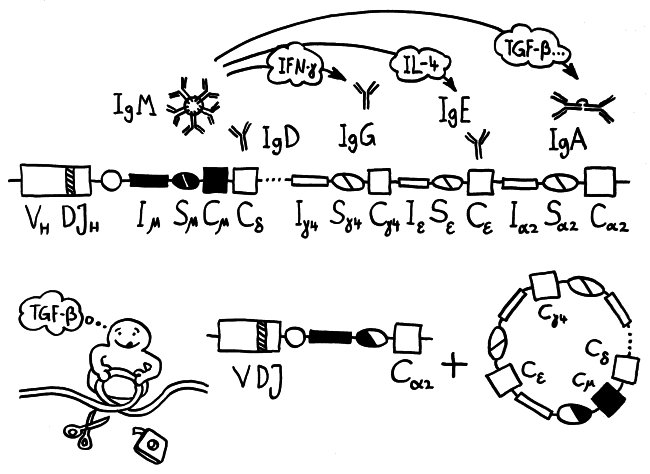
Zunächst zu den Antikörpern oder Immunglobulinen. Das sind Proteine, die von B-Lymphozyten (Zellen der sogenannten erworbenen Abwehr) hergestellt werden. Sie erkennen und binden hochspezifisch bestimmte Antigene, also Bestandteile von Krankheitserregern, hier von den Coronaviren. Jeder B-Lymphozyt kann genau ein Antigen erkennen und bekämpfen, mit dem seine Rezeptoren und später seine Antikörper nach dem Schlüssel-Schloss-Prinzip zusammenpassen. Die zu den Viren passenden B-Lymphozyten brauchen ein paar Tage, bis sie von anderen Zellen des Immunsystems ausfindig gemacht und aktiviert wurden, sich hinreichend vermehrt und mit der Massenproduktion von Antikörpern begonnen haben.
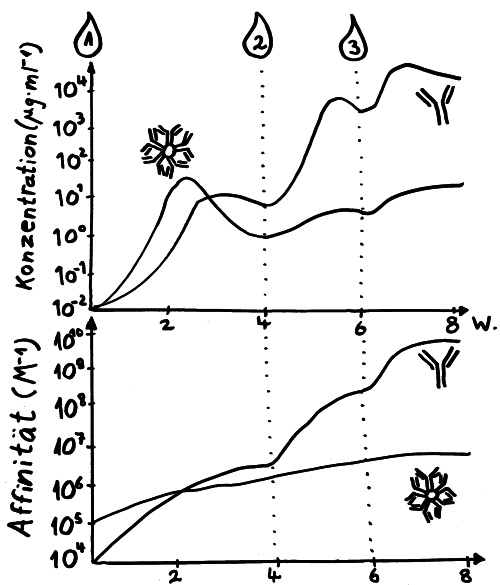
Außerdem werden die Antikörper in einer Art Turbo-Mini-Evolution immer passgenauer; sie durchlaufen ein Feintuning, die sogenannte Affinitätsreifung. Und die B-Lymphozyten stellen normalerweise erst ziemlich klobige Antikörper her, das sogenannte Immunglobulin M (kurz: IgM). In ihm sind 5 Y-förmige Funktionseinheiten sternförmig am „Stiel“ miteinander verbunden, sodass insgesamt 10 Antigen-Bindungsstellen nach außen ragen. Diese Sterne sind so groß, dass sie die Blutbahn nicht verlassen können. Sie rauschen in der Frühphase der erworbenen Abwehrreaktion durch unsere Adern und binden dort möglichst alle Viruspartikel, denen sie begegnen. Die so entstehenden Klumpen aus IgM und Viren werden dann von bestimmten Zellen des Immunsystems beseitigt. So wird die sogenannte Virenlast schon stark verringert, aber das IgM allein schafft es meist nicht, alle Viren zu erwischen.
Daher schalten die B-Lymphozyten im Zuge des sogenannten Klassenwechsels schon bald auf die Herstellung einer anderen Antikörperklasse um, nämlich Immunglobulin G (kurz: IgG). Dieses Protein besteht aus einem einzelnen Y und ist damit so klein, dass es aus dem Blut durch die Gefäßwände ins Gewebe eindringen kann, um dort weitere Virenpartikel aufzustöbern und durch Bindung unschädlich zu machen, bevor die Viren in unsere Körperzellen eindringen konnten. Denn nur wenn den Viren das gelingt, können sie sich massenhaft vermehren, die Zellen zerstören und in immer neue Zellen eindringen.
Wie das Ärzteblatt berichtet, hat ein Forscherteam in Melbourne immer wieder den Zustand des Immunsytsems einer 47-jährigen Frau untersucht, die an COVID-19 erkrankt war. Der Verlauf war vergleichsweise leicht, sie musste nicht beatmet werden. „Der Kampf des Immunsystems gegen das neue Virus“, so das Ärzteblatt, „scheint kurz und nicht besonders heftig gewesen zu sein. Einen Anstieg der proinflammatorischen Zytokine und Chemokine, die bei einer Influenza einen schweren Verlauf anzeigen, ist … ausgeblieben.“
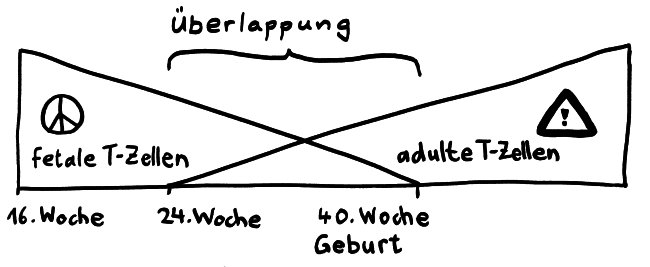
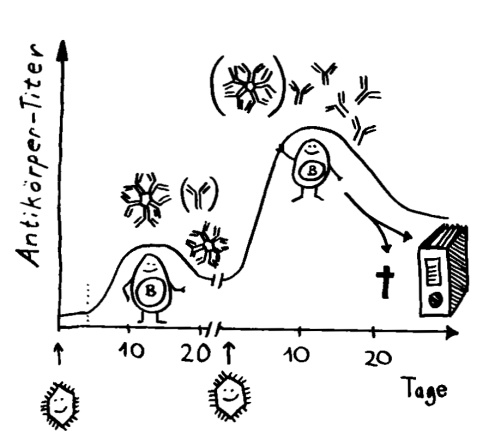
Am 7. Tag ihres Klinikaufenthalts (der 11 Tage nach ihrer Rückkehr aus Wuhan begann, wo sie sich mutmaßlich angesteckt hatte) wurden bei ihr erstmals Antikörper nachgewiesen. Und jetzt kommt’s: IgG-Antikörper (die kleinen, die ins Gewebe eindringen) wurden zwei Tage vor den IgM-Antikörpern gefunden (den großen, die normalerweise erst mal im Blut aufräumen). Die Ergebnisse bei einer einzelnen Patientin seien aber, so die Studienautoren, vielleicht noch nicht aussagekräftig.
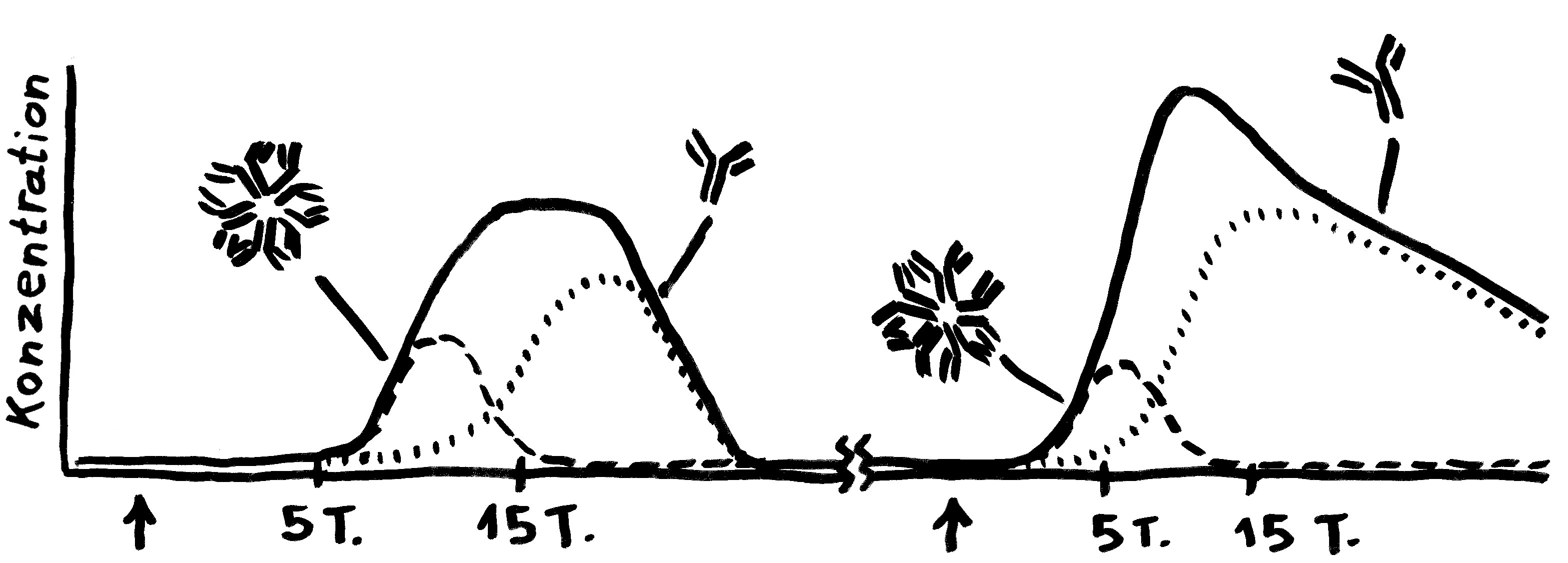
Bei einer Viren-Infektion produziert das Immunsystem erst das große IgM und dann zunehmend das kleinere IgG. Bei einer erneuten Infektion spielt IgM keine große Rolle; dafür schießt die IgG-Herstellung schnell in die Höhe.
Tatsächlich stellt sich die Lage in einer chinesischen Arbeit anders dar. Die Autoren haben das Blut von 173 COVID-19-Patient*innen in einer Klinik wiederholt auf die Antikörper gegen das Virus SARS-CoV-2 untersucht und dies mit der Schwere der Erkrankung in Beziehung zu setzen versucht. Antikörper vom Typ IgM, die gegen das Virus gerichtet waren, ließen sich im Median am 12. Tag nach der Klinikeinweisung nachweisen, IgG folgte dann am 14. Tag: der klassische Verlauf, wie bei anderen Infektionen. Das lässt vermuten, dass die Melbourne-Patientin untypisch war. Je schwerer der Krankheitsverlauf, desto mehr Antikörper hatten die chinesischen Patient*innen im Blut. Und vor allem bei den sehr schweren Verläufen reichten die Antikörper offenbar nicht aus, um die Infektion besiegen: Das Erbgut der Viren war trotz der starken Abwehrreaktion der B-Lymphozyten noch im Blut nachweisbar.
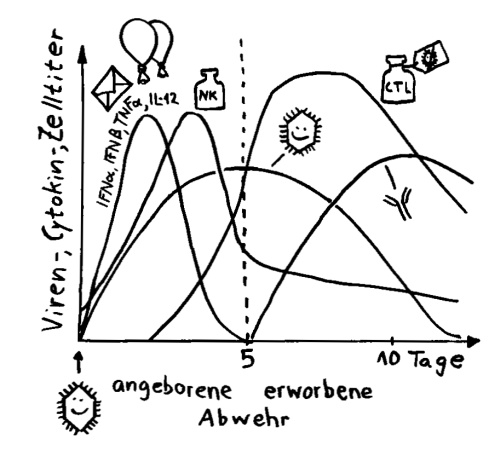
Nun zur zweiten Nachricht, die auch bei Twitter Entrüstung über das vermeintliche Versagen unseres Gesundheitssystems im Vergleich zu demjenigen Kubas geführt hat: Wie die taz berichtet hat, feiert Kuba große Erfolge bei der Behandlung von COVID-19-Patient*innen mit dem Zytokin Interferon alfa-2b. Ich bezweifle nicht, dass man in der Frühphase (!) bestimmter viraler Infektionen das Immunsystem durch die Gabe dieses Immunzellbotenstoffs unterstützen kann. Aber: Das ist eine sehr, sehr unspezifische Therapie, denn Interferone bewirken an tausenderlei Stellen im Organismus tausend verschiedene Dinge – nicht alle davon sind der Genesung förderlich.
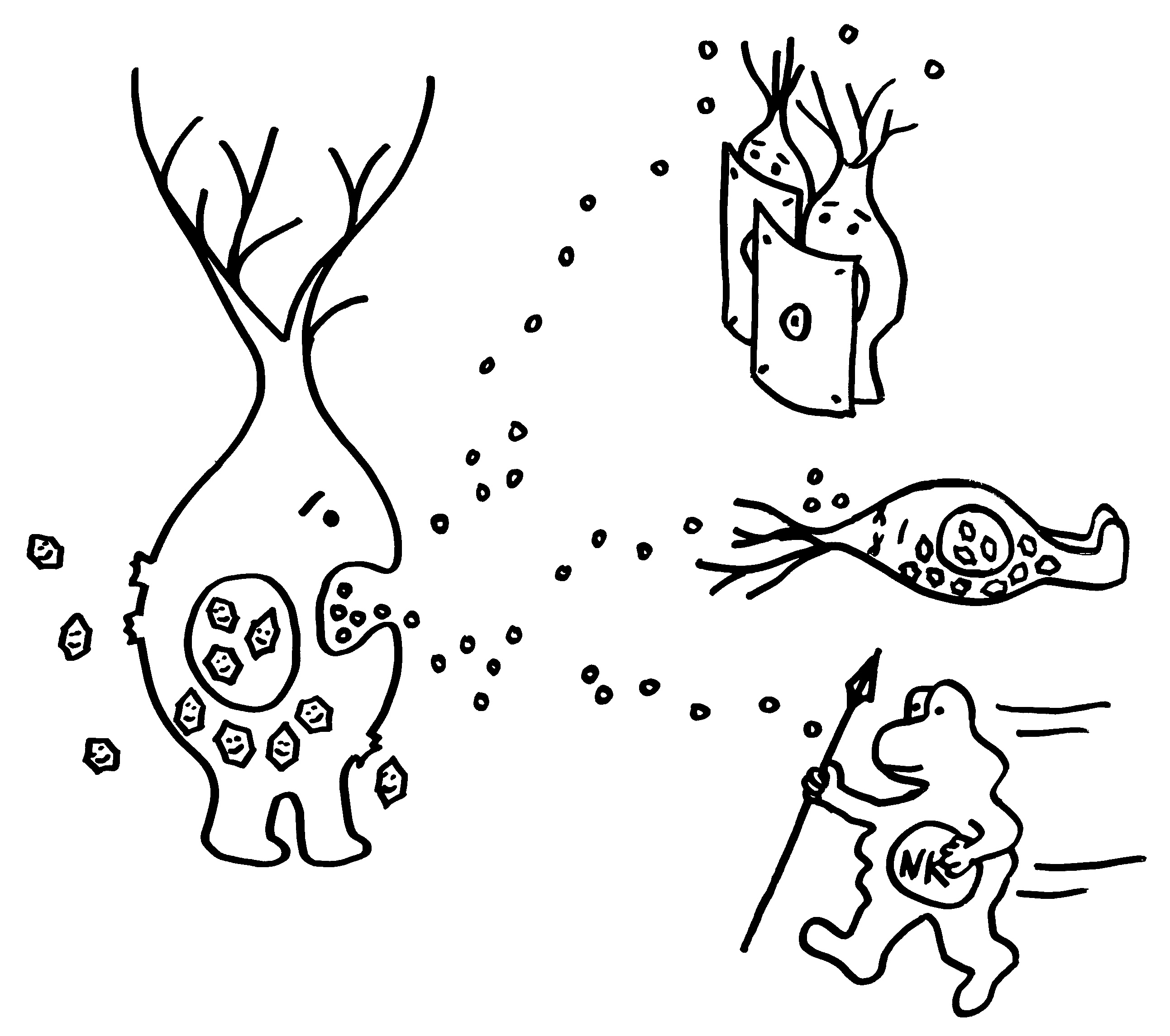
Gleich zu Beginn einer Viren-Infektion stoßen befallene Zellen Interferone aus, um andere Zellen zu warnen und Immunzellen anzulocken.
Und vor allem kommt es auf das Timing an: Die großen Schwierigkeiten schwer erkrankter COVID-19-Patient*innen, die mit kaputter Lunge an einen Beatmungsapparat angeschlossen sind, stammen ja nicht primär von den Viruspartikeln und den durch sie vernichteten Zellen, sondern vor allem von der bereits heftigen Reaktion des Immunsystems auf die Infektion. Eine überschießende Abwehrreaktion kann lebenswichtiges Gewebe zerstören – hier in der Lunge.
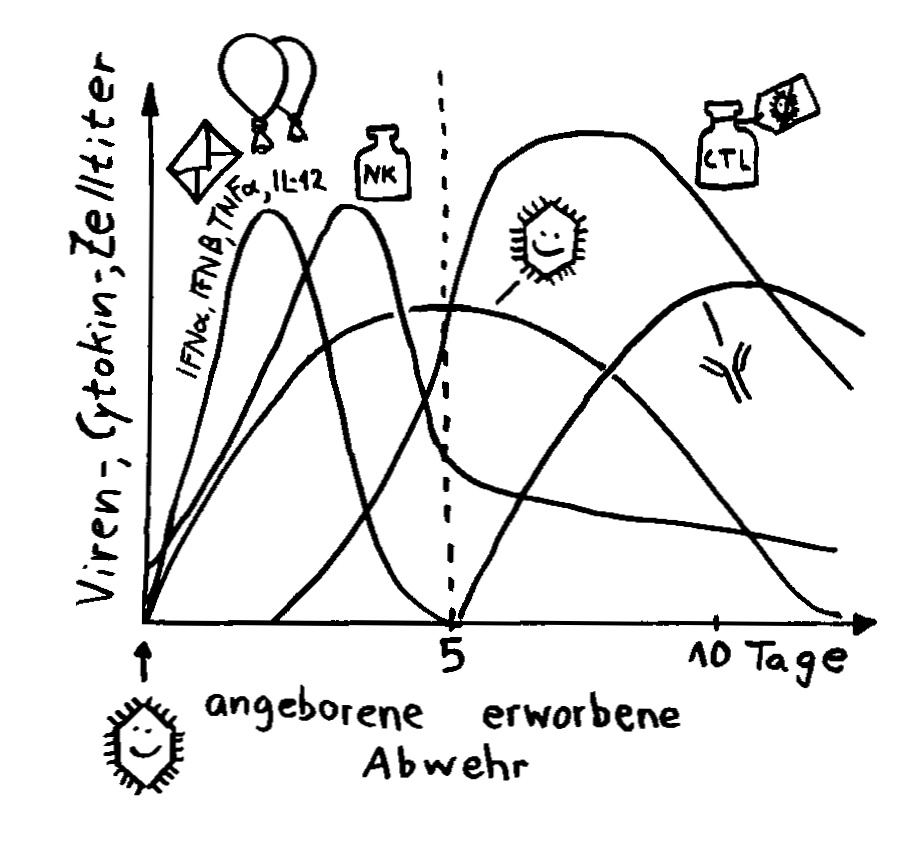
Interferon alpha (IFNα) und beta (IFNβ) spielen in der Frühphase einer Infektion eine große Rolle. Noch bevor die Antikörperproduktion einsetzt, geht ihre Konzentration im Blut wieder stark zurück.
Die meisten COVID-19-Patient*innen in den Kliniken, insbesondere auf den Intensivstationen, sind in einem sehr weit fortgeschrittenen Krankheitsstadium. Sie nun mit einem Interferon zu traktieren, das kann böse nach hinten losgehen. Einige Zytokine können einen sogenannten Zytokinsturm auslösen, eine Überreaktion, bei der die Botenstoffe zum Beispiel die Adern so weit stellen, dass das Blut viel langsamer fließt und daher gleich mehrere Organe des Körpers nicht mehr hinreichend mit Sauerstoff versorgt werden – und das womöglich in einer Situation, in der durch die kaputte Lunge ohnehin schon Sauerstoffmangel herrscht. Es ist also keine Borniertheit, dass Mediziner*innen in Deutschland kaum über Interferon reden, wenn es um mögliche COVID-19-Medikamente geht.