Mit dem Werden und Vergehen des Thymus im Lebensverlauf habe ich mich bereits ausführlich beschäftigt, etwa hier. Im letzten Beitrag habe ich die Herkunft der Lymphgefäße skizziert. (Kurz: Sie entstehen größtenteils durch Abknospung von Endothel, also Blutgefäßwänden, aus einigen Hauptadern des Embryos; in einigen Organen und Geweben tragen aber auch andere embryonale Zellen zu den Lymphgefäßen bei.) Weiter geht es mit der Entstehung den Lymphknoten.
Wer Autoimmunerkrankungen verstehen will, sollte Lymphknoten nicht ignorieren
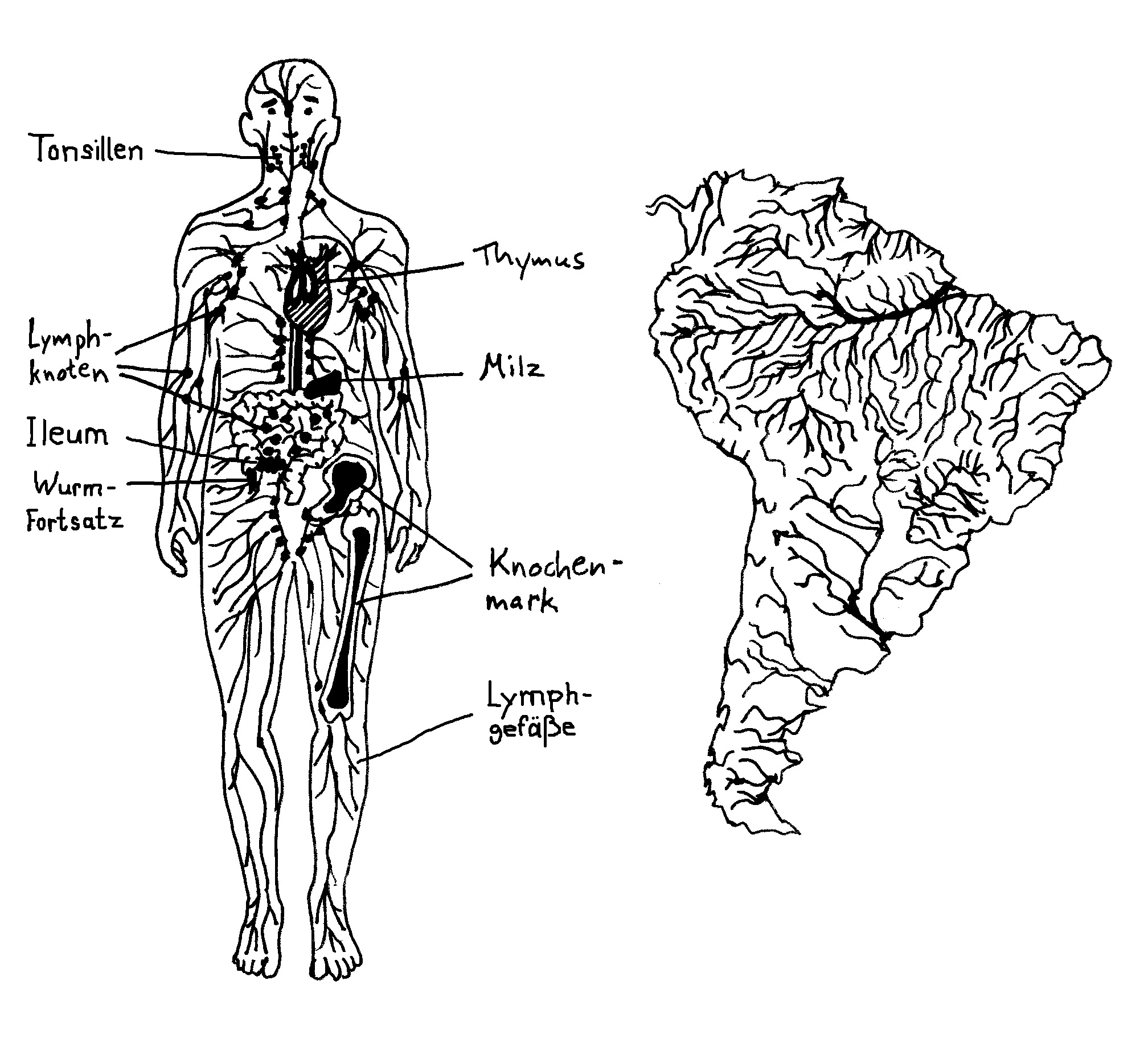
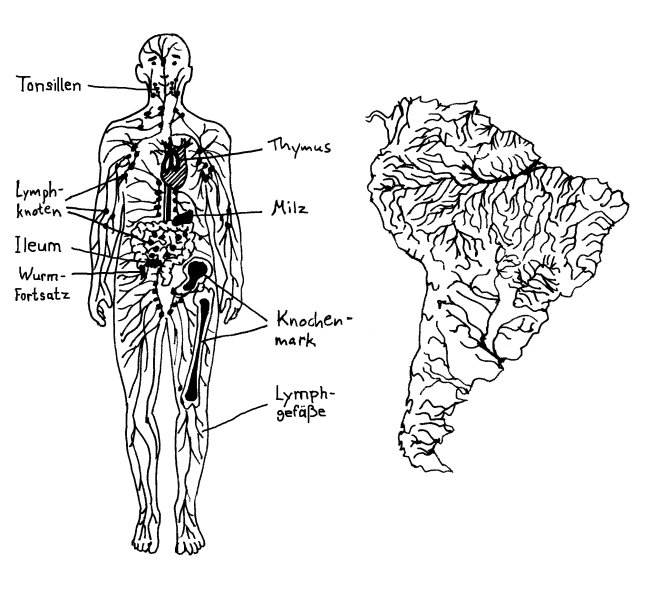
Warum interessiert mich das überhaupt? Das Lymphsystem erfüllt im Wesentlichen drei Aufgaben: Erstens schafft es Flüssigkeit, die aufgrund des Blutdrucks aus den Kapillaren austritt und das Gewebe anschwellen lässt, in die größeren Blutgefäße zurück – jeden Tag etwa drei Liter. Zweitens transportiert es Proteine und vor allem Fette, die unser Verdauungssystem aus der Nahrung gewonnen hat, aus der Darmschleimhaut in den Blutkreislauf. Und drittens – jetzt wird es relevant für’s Buch – führt es den Lymphknoten, gewissermaßen den Kontaktbörsen des Immunsystems, Antigene und Immunzellen zu, und es schickt die dort von den Antigenen aktivierten Immunzellen in das Blut zurück, von dem sie sich an ihre Einsatzorte verfrachten lassen.
Neben den normalen Lymphknoten, die während der Embryonalentwicklung an vordefinierten Stellen entstehen, bilden sich im Körper später auch bedarfsgesteuerte Strukturen: zum einen kurz nach der Geburt die sogenannten Peyer-Plaques in der Darmschleimhaut, die dem Management unserer Beziehungen zur Darmflora dienen. Und zum anderen ein Leben lang improvisierte Lymphknötchen in der Nähe von Entzündungsherden, sogenannte tertiäre lymphatische Organe (TLO). Sie verkürzen die Transportwege für Antigene und Immunzellen und machen so die Bekämpfung der Entzündungsauslöser effizienter. Für das Buch habe ich sie als Feldlager skizziert.
Bei einer akuten Infektion ist das gut – aber bei einer chronischen Autoimmunerkrankung verstärkt es leider die Reaktion des Immunsystems auf körpereigene Antigene. Zudem unterstützen TLOs bei vielen Autoimmunerkrankungen ausgerechnet die schädlichen autoreaktiven Immunzellen, während sie andere, nützliche Immunzellen abweisen (siehe „Ärger mit dem Passwort“). Solche tertiären Lymphstrukturen entstehen im Prinzip ähnlich wie die normalen Lymphknoten, nämlich durch einen Dialog von Immunzellen und lokalen Bindegewebszellen. Daher sehen wir uns zunächst die normalen Entwicklung während der Embryogenese an.
Es beginnt im zweiten Monat
Im menschlichen Embryo schnüren sich im zweiten Monat zunächst sechs sogenannte Lymphsäcke von den Kardinalvenen im oberen Bereich des Rumpfes ab. Aus diesen Ausbuchtungen wächst dann das Lymphgefäßsystem allmählich in die Peripherie hinein, wie im letzten Beitrag beschrieben. Wo das Netzwerk besonders dicht ist, etwa in der Nachbarschaft des künftigen Verdauungstrakts, nennt man es Lymphplexus. Am Ende durchzieht das System den gesamten Körper, ähnlich wie der Amazonas das ganze Amazonasbecken drainiert.
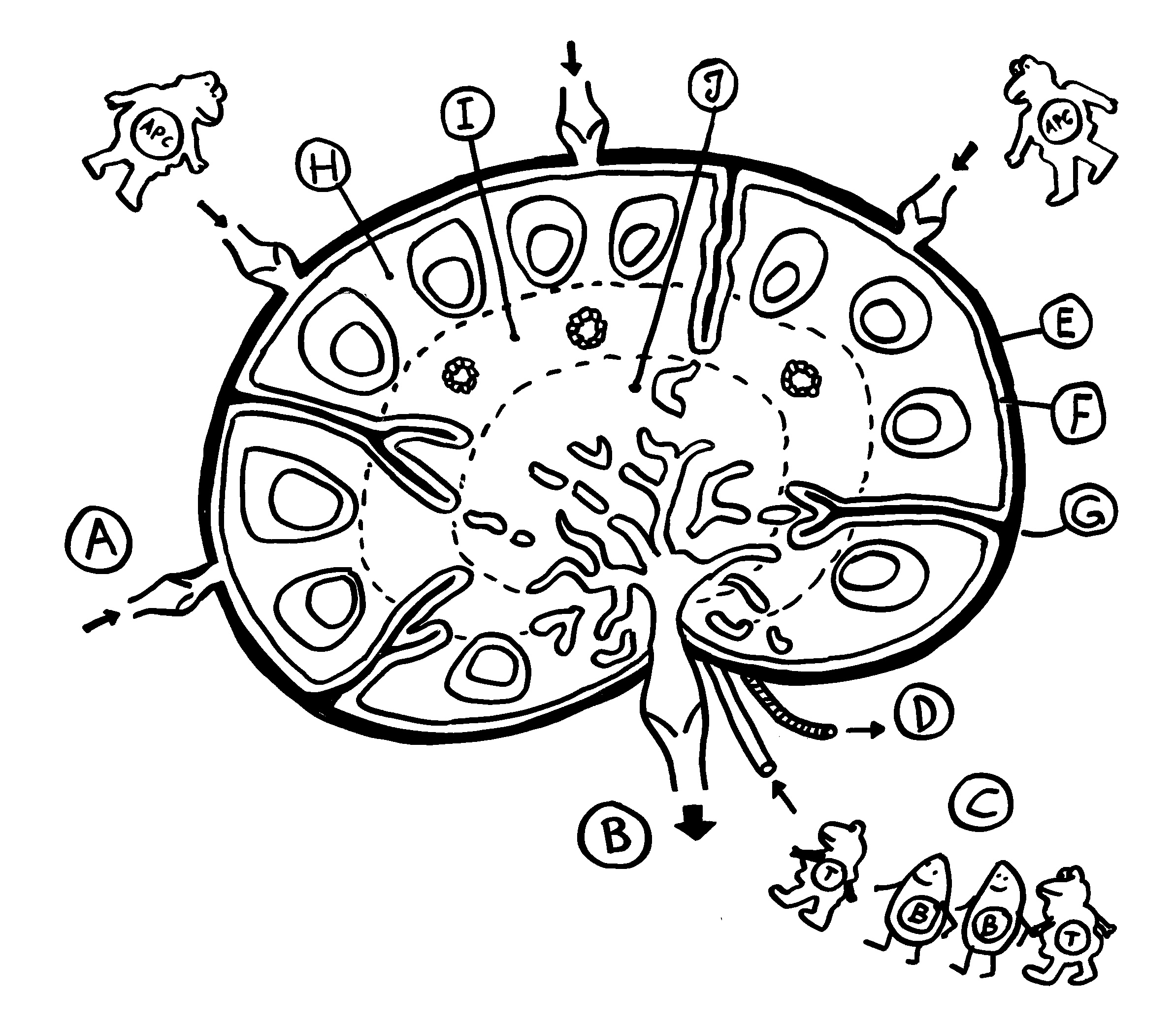
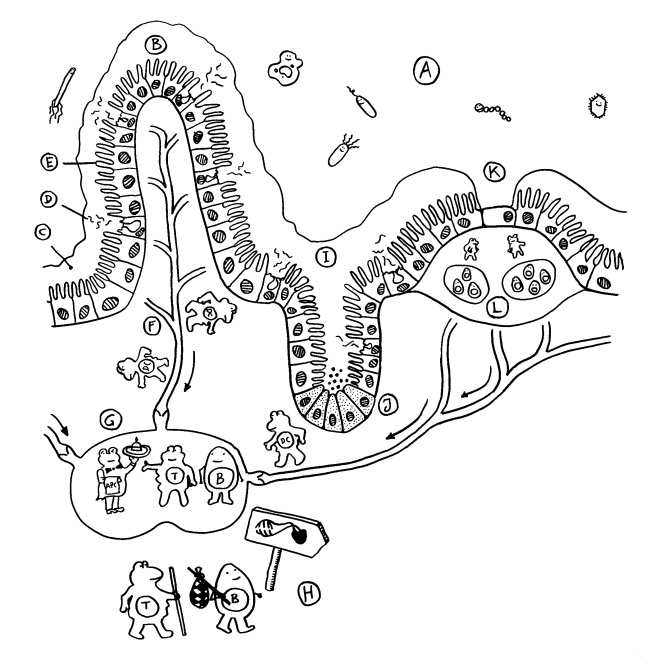
Erste Ansätze zu Lymphknoten finden sich etwa ab Tag 36 der Embryonalentwicklung in der Nähe des Zusammenflusses zweier paarig angelegter Kardinalvenen, die dort zur Vena cardinalis communis fusionieren. Die Lymphsäcke, die noch überwiegend aus Endothel bestehen, werden jetzt mit Mesenchymzellen durchsetzt, die zur charakteristischen Zonenbildung in den Lymphknoten beitragen (H bis J in dieser Zeichnung). Weitere Mesenchymzellen bilden die Bindegewebskapsel und die Stützwände der Knoten (E bis G).
Dialoge zwischen Induktoren und Organisatoren
Doch woher wissen die Vorläuferzellen, wohin sie sich begeben sollen, mit welchen anderen Zellen sie sich wie zusammenlagern und welche genaue Funktion sie übernehmen sollen? Das wird über einen Austausch von Signalen organisiert. An einem Ort, der für einen Lymphknoten prädestiniert ist – einer sogenannten Anlage* -, wird zunächst ein Botenstoff namens TRANCE ausgeschüttet. Dieser lockt sogenannte lymphoid tissue inducer cells oder LTi-Zellen an. Das sind erste weiße Blutkörperchen, die eng mit den späteren Immunzellen verwandt sind. Über Rezeptoren auf ihrer Oberfläche nehmen sie Verbindung mit den Mesenchymzellen auf, die als lymphoid tissue organizer (LTo) bezeichnet werden. Die LTo-Zellen werden durch den Kontakt aktiviert: Sie überziehen sich mit Adhäsionsmolekülen, sozusagen Widerhaken oder Klebstoffen, und schütten sowohl entzündungstypische Botenstoffe (Zytokine) als auch Lockstoffe (Chemokine) aus. Durch diese positive Rückkopplung werden weitere Immunzellen rekrutiert, zur Ansiedlung ermuntert und aktiviert, ähnlich wie bei einer Entzündung.
Nach der Geburt
All dies geschieht im Embryo, also noch ohne Kontakt zu fremden Antigenen. Aber sobald nach der Geburt der Darm des Säuglings mit Mikroben besiedelt wird, erfährt die Entwicklung des Lymphgewebes noch einen Schub. Vor allem in der Darmschleimhaut bilden sich durch den Kontakt zur Darmflora tertiäre Lymphorgane, und zwar ähnlich wie eben beschrieben, also angestoßen durch LTi-Zellen und andere Immunzellen, die sich in der Darmschleimhaut niederlassen und mit ihren Nachbarzellen in Kontakt treten, um „Feldlager“ zu errichten. Mit diesen Strukturen kann das Immunsystem die Darmflora regelmäßig auf ihre Zusammensetzung prüfen und gegebenenfalls in ihre Schranken weisen.
Inwieweit auch die Bildung tertiärer Lymphorgane bei chronischen Entzündungen und Autoimmunerkrankungen der vorgeburtlichen Entstehung der Lymphknoten ähnelt und in welcher Hinsicht die beiden Prozesse voneinander abweichen, beschreibe ich im nächsten Beitrag.
* Auch in englischen Arbeiten heißen sie anlagen. In der Embryologie waren im 19. Jahrhundert deutsche Forscher führend, und die Fachsprache hat diesen Ausdruck übernommen.
Literatur:
Manuela Ferreira et al. (2012): Stroma cell priming in enteric lymphoid organ morphogenesis
Lucille Rankin et al. (2013): Diversity, function, and transcriptional regulation of gut innate lymphocytes