Zu den Autoimmunerkrankungen mit deutlichem Frauenüberschuss zählt der Systemische Lupus erythematosus (SLE), kurz Lupus: Auf einen männlichen Erkrankten kommen etwa neun weibliche Betroffene; dafür erwischt es Männer oft stärker. Schon das spricht gegen einen einfachen ursächlichen Zusammenhang mit unseren Sexualhormonen nach dem Motto: Estrogen schlecht, Testosteron gut. Es muss zumindest weitere Faktoren geben, die das Geschlecht als Risikofaktor mit dem tatsächlichen Ausbruch und Verlauf der Krankheit verbinden.
Solche Zusammenhänge aufzuklären, ist methodisch ganz schön anspruchsvoll. Eine solche Arbeit stelle ich hier vor, denn der Aufwand hat sich gelohnt: Die Autoren haben ein Netzwerk von Genen aufgespürt, das vor allem in Frauen aktiv ist und das bei Lupus-Patientinnen und -Patienten zu Entzündungen und anderen Immunreaktionen beiträgt. Aktiviert wird es von einem wenig bekannten Transkriptionsfaktor, der in gesunden Frauen viel stärker exprimiert wird als in gesunden Männern: VGLL3. (Sein Langname ist nichtssagend und wenig einprägsam, drum erspare ich ihn uns.) Dasselbe Genregulierungsnetzwerk ist offenbar auch an weiteren Autoimmunerkrankungen mit Frauenüberhang beteiligt, darunter systemische Sklerose und Sjögren-Syndrom.
Frauenhaut ≠ Männerhaut
Da hat die Kosmetikindustrie ausnahmsweise recht, wenngleich das mit ihren Produkten herzlich wenig zu tun hat: Es gibt zahlreiche Unterschiede zwischen Frauen- und Männerhaut. Die Autoren haben Transkriptiomanalysen durchgeführt, also die Messenger-RNA (mRNA) aus weiblichen und männlichen Hautzellen sequenziert und so herausgefunden, dass 661 Gene in diesem Organ – und zwar im gesunden Zustand – in einem Geschlecht stärker abgelesen („transkribiert“) werden als im anderen. In Männerhaut ist die Ablesung von 268 Genen hochreguliert, in Frauenhaut werden 393 Genen stärker transkribiert. Diese Gene verteilen sich auf all unsere 23 Chromosomen, sind also bei weitem nicht nur auf den Sex-Chromosomen X und Y angesiedelt, wo ein Unterschied ja nicht weiter verwunderlich wäre: Gene auf dem Y-Chromosom fehlen in Frauen ganz, und Gene auf dem X-Chromosom kommen in Frauen in doppelter Ausführung vor, in Männern dagegen in Einzahl.
Die Zahl 661 ist schon beeindruckend genug, aber die Geschlechtsunterschiede in der Haut gehen noch viel weiter: Die Autoren untersuchten als Nächstes, inwieweit die Ablesestärke dieser 661 Gene mit der Ablesestärke aller anderen Gene in Hautzellen korreliert. Zum Beispiel: Gibt es in den Hautzellen einer Person besonders viel mRNA mit der Erbinformation von Gen A, so enthalten diese Zellen meist auch besonders viel (oder, bei einer negativen Korrelation, besonders wenig) RNA von Gen B. Sie fanden sage und schreibe 124.521 Gen-Paare, deren Expression nur in der weiblichen Haut korreliert, und 158.303 Gen-Paare, deren Ableseniveaus nur in der männlichen Haut Hand in Hand gehen. Das deutet auf riesige geschlechtsspezifische Genregulierungsnetzwerke hin, die über das gesamte Genom verteilt sind.
In Frauenhaut stark abgelesene Gene sind mit Autoimmunität assoziiert
Die biologische Funktion vieler dieser Gene ist bekannt. Auffällig viele der in Frauenhaut verstärkt transkribierten Gene sind an Immun- und Entzündungsreaktionen – insbesondere an der sogenannten Komplement-Aktivierung – beteiligt. Auf die bei Männern verstärkt abgelesenen Gene trifft das nicht zu. Die Autoren identifizierten eine recht große Schnittmenge zwischen den in Frauenhaut verstärkt abgelesenen Genen und den Risikogenen für Lupus und für systemische Sklerose, zwei Autoimmunerkrankungen mit hohem Frauenanteil. Unter den Genen, die in Männerhaut vermehrt transkribiert werden, fanden sie keine derartigen Assoziationen.
Deutlich erhöht war bei den Frauen zum Beispiel die Herstellung der Proteine BAFF und Integrin α-M, die bei vielen Lupus-Patientinnen im Übermaß vorliegen. Das frauentypische Lupus-Risikogen-Ablesemuster beschränkte sich nicht auf Hautzellen, sondern tauchte auch in Immunzellen wie Monozyten, B- und T-Zellen auf. In der Haut und den Monozyten von Frauen mit Lupus wurden diese Gene außerdem noch stärker abgelesen als in den Zellen gesunder Frauen.
Molekulare Mechanismen: Die Hormone sind es nicht
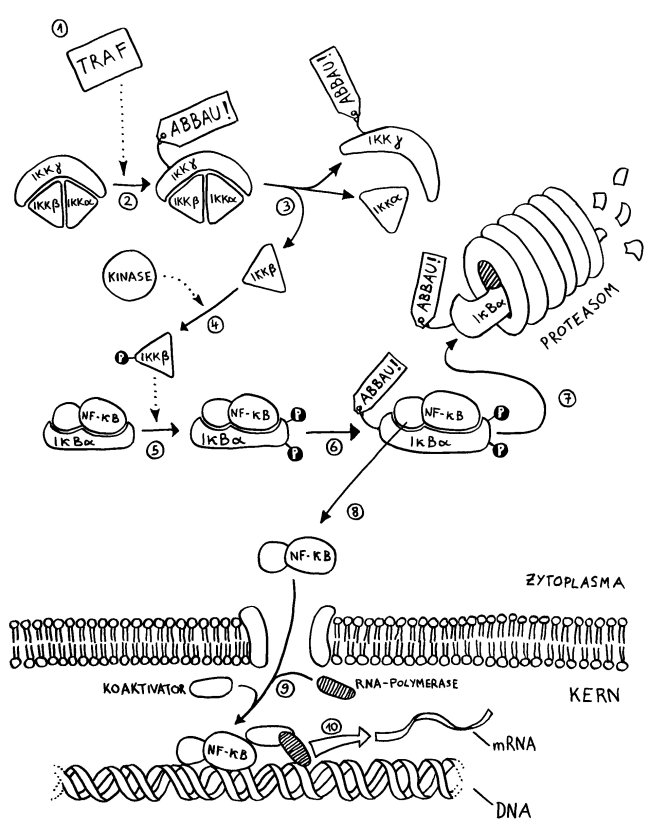
Häufig werden Sexualhormone für eine geschlechtsspezifisch verstärkte Expression bestimmter Proteine verantwortlich gemacht. Schließlich können die Hormone an Rezeptoren auf oder in unseren Zellen binden und damit Signalketten auslösen, die zum Andocken von Transkriptionsfaktoren an die Promotor-Regionen bestimmter Gene führen. (Wer sich in Erinnerung rufen will, wie Transkriptionsfaktoren überhaupt arbeiten, kann sich hier die Schritte 9 und 10 am unteren Bildrand ansehen.) Um das zu prüfen, haben die Autoren Estradiol – eine wichtige Form von Estrogen – und Testosteron in physiologischer, also „normaler“, und in 100-fach erhöhter Konzentration auf Kulturen menschlicher Hautzellen einwirken lassen und die mRNA-Produktion in diesen Zellen analysiert: Die Sexualhormone veränderten Ablesestärke der Immunsystem-Gene nicht.
Es gibt aber auch zahlreiche Transkriptionsfaktoren, die nicht von Sexualhormonen in Gang gesetzt werden. Sechs von ihnen – darunter VGLL3 – werden in Hautzellen von Frauen sehr viel stärker hergestellt als in denen von Männern. Die Autoren konnten die Herstellung von fünf dieser Transkriptionsfaktoren gezielt ausschalten, indem sie die mRNA, mit der die Bauanleitung aus dem Zellkern zu den Proteinfabriken im Zytoplasma transportiert wird, durch komplementäre RNA-Stränge blockierten (sogenannte RNA-Interferenz oder RNAi). Schalteten sie die Produktion von VGLL3 aus, so ging speziell die Ablesestärke der kritischen Immunsystem-Gene stark zurück. Bei den übrigen vier Transkriptionsfaktoren war das nicht der Fall.
VGLL3 fördert die Ablesung vieler Autoimmunitäts-Risikogene
In gesunden weiblichen Hautzellen hält sich VGLL3 vor allem im Zellkern auf, in gesunden männlichen Hautzellen ist es über Zellkern und Zytoplasma verteilt. In den Hautzellen von Lupus-Patienten befindet sich der Transkriptionsfaktor dagegen unabhängig vom Geschlecht stets im Kern. Neben BAFF und Integrin α-M kurbelt VGLL3 offenbar in der Haut die Herstellung von sieben weiteren Immunsystem-Proteinen an. Insgesamt verstärkt es in Hautzellen die Ablesung von gut 200 Genen. Unter den Genen, die in weiblicher Haut verstärkt abgelesen werden, sind auffällig viele dieser von VGLL3 regulierten Gene – unter den in männlicher Haut verstärkt abgelesenen Genen dagegen nicht.
Von 97 (also 47 Prozent) der VGLL3-regulierten Gene sind Varianten bekannt, die das Risiko für Autoimmunerkrankungen erhöhen. Darunter ist zum Beispiel das Gen für das Enzym Matrix-Metallopeptidase 9, das in Patienten mit Lupus, Multipler Sklerose, Sjögren-Syndrom, Polymyositis und rheumatoider Arthritis stärker produziert wird als in Gesunden.
Auch Gene für weitere Transkriptionsfaktoren sind unter den VGLL3-Zielgenen. So können sich riesige geschlechtsspezifische Regulierungskaskaden aufbauen: Ein primärer Transkriptionsfaktor wird in einem Geschlecht stärker produziert und erhöht durch Andocken an seine Zielgene unter anderem die Produktion sekundärer Transkriptionsfaktoren, die wiederum an zahlreiche Zielgene andocken, und so weiter. Bestimmte Varianten des VGLL3-regulierten Transkriptionsfaktor-Gens ETS1 sind mit Lupus, rheumatoider Arthritis und Morbus Bechterew assoziiert.
In Patienten-Biopsien bestätigt
Bis hierhin hatten die Autoren das Wirken von VGLL3 lediglich in Hautzellen gesunder Probanden und in Zellkulturen untersucht. Die vermutete Schlüsselrolle von VGLL3 bei Autoimmunerkrankungen mit Frauenüberhang wollten sie nun durch weitere Transkriptomanalysen überprüfen, und zwar in Hautproben von Patienten mit drei primär die Haut betreffenden Autoimmunerkrankungen, die bei Frauen deutlich häufiger sind als bei Männern: subakuter kutaner Lupus erythematosus oder SCLE, Morphea oder zirkumskripte Sklerodermie und schließlich limitierte Sklerodermie.
Unter den Genen, die bei SCLE verstärkt abgelesen werden, werden demnach 51 von VGLL3 hochreguliert – darunter etliche, deren Protein-Produkte auf Typ-1-Interferone reagieren, was für SCLE typisch ist. Schalteten die Forscher den Transkriptionsfaktor VGLL3 mit der oben erwähnten Technik der RNA-Interferenz aus, ging die Ablesung von Genen, die bei SCLE normalerweise hochreguliert sind, deutlich stärker zurück als die anderer Gene, die mit der Erkrankung nichts zu tun haben.
Bezeichnenderweise fielen die Unterschiede in der Ablesestärke von VGLL3 und den VGLL3-regulierten Genen zwischen den SCLE-Patientinnen und -Patienten viel kleiner aus als zwischen gesunden Frauen und Männern. Genau das war zu erwarten: Bricht eine Autoimmunerkrankung mit starkem Frauenüberhang doch einmal bei einem Mann aus, so gleicht sich sein Gentranskriptionsprofil dem der Frauen an.
Auch in anderen Organen trägt VGLL3 zu Autoimmunerkrankungen mit Frauenüberhang bei
In der Haut von Patientinnen und Patienten mit den beiden anderen untersuchten Autoimmunerkrankungen werden VGLL3-regulierte Gene ebenfalls deutlich stärker abgelesen als in der Haut von Gesunden. Um herauszufinden, ob dieser Zusammenhang womöglich hautspezifisch ist, untersuchten die Forscher auch Proben aus den Speicheldrüsen von Patienten mit Sjögren-Syndrom und von Gesunden: Im erkrankten Drüsengewebe wurden das Gen für VGLL3 und dessen Zielgene deutlich stärker abgelesen als im gesunden Drüsengewebe.
Das galt zum Beispiel für die Gene, die das Zytokin IL-7 und den IL-7-Rezeptor codieren. Man weiß, dass IL-7 beim Sjögren-Syndrom stark am Krankheitsgeschehen beteiligt ist: Das Zytokin verstärkt die Reaktion von T-Helferzellen von Typ 1 (Th1) und damit die Aktivierung von Monozyten und B-Zellen, und es führt zur Produktion von Gamma-Interferon sowie Chemokinen, die weitere Lymphozyten in das entzündete Gewebe locken.
Bei Lupus verändern sich nicht nur die Hautzellen, sondern auch die Monozyten: Immunzellen der angeborenen Abwehr, die zum Beispiel zur Aktivierung von T-Zellen und zur Reifung von B-zellen beitragen. Die Autoren stellten nun fest, dass auch in den Monozyten von Lupus-Patienten eine erhöhte VGLL3-Produktion zu einer übermäßigen Typ-1-Interferon-Reaktion und damit zu den Entzündungen beiträgt.
Die übermäßige Produktion und Aktivität dieses Transkriptionsfaktors ist also keineswegs auf Lupus und auch nicht auf die Haut beschränkt.
Ein Ring, sie zu knechten, sie alle zu finden …
Das Fazit: Mit ihrem aufwändigen Vorgehen haben die Autoren in mehreren Schritten nachgewiesen, dass der Transkriptionsfaktor VGLL3 tatsächlich ein Schlüsselelement in der Pathogenese etlicher Autoimmunerkrankungen mit Frauenüberschuss ist – und zwar nicht nur bei den Patientinnen: Auch bei den betroffenen Männern wird die Produktion von VGLL3 und damit die Ablesung seiner Zielgene hochgefahren, sobald die Krankheit ausbricht.
Unter den Zielgenen von VGLL3 sind etliche Gene des Immunsystems, von denen schon länger bekannt ist, dass gewisse Varianten in ihnen Entzündungen fördern und das Risiko für verschiedene Autoimmunerkrankungen erhöhen – darunter Lupus, systemische Sklerose, Multiple Sklerose, Sjögren-Syndrom, Polymyositis und rheumatoide Arthritis. Das macht die Blockade von VGLL3 zu einer attraktiven indikationsübergreifenden Therapieoption.
Abzuwarten ist allerdings, welche – womöglich geschlechtsspezifischen – Nebenwirkungen bei einer Blockade dieses Strippenziehers eines weit verzweigten Genregulierungs-Netzwerks auftreten können: Schließlich dürfte die VGLL3-Expression bei gesunden Frauen nicht aus Jux und Dollerei höher ausfallen als bei den Männern.
Literatur
Y. Liang et al. (2016): A gene network regulated by the transcription factor VGLL3 as a promoter of sex-biased autoimmune diseases