Als Gegengewicht zum letzten Beitrag, in dem ich meinen Kurzvortrag über schlechte Bücher zum Thema vorgestellt habe, dokumentiere ich hier eine Reihe von Kurzbesprechungen von seriöser Klimawandel-Literatur, die ich im September im Twitter-Account der „Scientists for Future“-Regionalgruppe Köln/Bonn getwittert habe.

Ein verfrühter Gabentisch. Schließlich steht Weihnachten quasi vor der Tür, und ihr sucht verzweifelt nach Geschenken!

Zunächst drei kurze, informative, nüchtern geschriebene Einführungen in den Klimawandel:
- Nelles/Serrer 2018, „Kleine Gase – große Wirkung. Der Klimawandel“, € 5;
- Rahmstorf/Schellnhuber 2018, „Der Klimawandel“, € 9,95;
- Schönwiese 2019, „Klimawandel kompakt“, € 19,90.
Welches passt zu wem?

Nelles‘ und Serrers Einführung eignet sich nicht nur wegen des unschlagbaren Preises als kleines Geschenk: Dank kurzer, klarer Texte und vieler schöner Grafiken ist ideal auch für Menschen in eurem Umfeld, die das Thema bislang scheuten, weil „zu schwierig“ ooder „zu bedrückend“.
Dem Cover und dem Kleinformat zum Trotz ist es kein Kinderbuch, aber für interessierte ältere Kinder und Jugendliche wunderbar geeignet. Prima auch zum Auslegen in Wartezimmern und an anderen Orten, an denen man nach kurzer Lektüre sucht. (Bei uns heißt so etwas „Klo-Buch“.)

Bei Buch Nr. 2 bürgen schon die Autoren für Qualität: Rahmstorf und Schellnhuber sind renommierte Klimawissenschaftler am Potsdam-Institut für Klimafolgenforschung. Für knapp 10 Euro erhält man auf 140 Seiten einen soliden, aktuellen Klimawandel-Überblick einschließlich Schwarzweiß-Abbildungen, Literaturempfehlungen und Sachregister.
Das Taschenbuch hat den Untertitel „Diagnose, Prognose, Therapie“ und fünf Abschnitte:
- Aus der Klimageschichte lernen
- Die globale Erwärmung
- Die Folgen des Klimawandels
- Klimawandel in der öffentlichen Diskussion
- Die Lösung des Klimaproblems.

Das dritte Basis-Buch von Schönwiese steht dem zweiten in Sachen Reputation des Autors, Umfang und Inhalt in nichts nach, ist aber mit knapp 20 Euro teurer und im Layout und der Schreibweise schon „fachbuchähnlicher“, also für Menschen ohne naturwissenschaftliches Studium nicht ganz so zugänglich.
Die 30 Abbildungen sind farbig. Typisch für den recht akademischen Stil Schönwieses: Er steigt ein mit der Herleitung des Wortes „Klima“ aus dem Griechischen. Wer es also etwas gründlicher mag und Definitionen und viele Zahlen nicht scheut, ist hier sehr gut bedient.

Weiter geht es mit drei eher Essay-artigen oder erzählenden Klimawandel-Sachbüchern. Hier spielen Stilvorlieben und Persönlichkeit der Autoren eine größere Rolle; folglich werden auch die Rezensionen subjektiver.

Los geht es mit dem in der Mitte: „Die unbewohnbare Erde“ (2019, € 18) ist im Grunde eine auf 335 Seiten aufgeblasene Version des viel beachteten Essays, den David Wallace-Wells 2017 veröffentlicht hat. Meines Erachtens reicht es, diesen zu lesen. Um dem gegenüber einen echten Mehrwert zu bieten, hätten Autor oder Lektorat noch viel Arbeit in den Text stecken müssen.
Er wimmelt z. B. von erschreckend klingenden, aber kaum vergleichbaren Zahlen. Grundwasser sinkt etwa in einem Satz um 50 Kubikkilometer, um 4,5 Meter und um 70 Prozent; was davon ist jetzt am Schlimmsten? Auch der Übersetzung merkt man die Eile an. So wurden die amerikanischen „Liberals“ (Linke) als „Liberale“ übersetzt, was im Deutschen in die Irre führt – denn die sind bei uns gerade nicht als energische Klimaschützer bekannt.
Fazit: eine gute Quellensammlung, aber kein gut strukturiertes Buch.

Gemischte Gefühle hatte ich auch bei „Losing Earth“ (€ 22). Nathaniel Rich zeichnet akribisch die Geschichte der systematischen Beeinflussung der politischen Meinung zum Klimawandel in den USA nach. Das ist interessant, aber auch zutiefst niederschmetternd, und im Kern wusste man das schon: „Fast jedes Gespräch, das wir 2019 über den Klimawandel führen, wurde schon 1979 geführt.“ (S. 226)
Relevant jedoch für die #Wissenschaftskommunikation: Forscher und Politiker hatten große, kulturell bedingte Verständigungsprobleme.

Weiter geht es mit Friederike Otto: „Wütendes Wetter“ (2019, 18 €). Sie schreibt durchgängig mit Gendersternchen, woran man sich schnell gewöhnt: Nicht nur das Klima wandelt sich, auch die Sprache.
Teil 1 dreht sich um die Enstehung der Attributionswissenschaft (hier und da etwas zäh), Teil 2 (umso spannender und informationsdichter) um ihre Konsequenzen und Macht. So schildert Otto die ersten Klagen (u. a. von armen Bauern) gegen Verursacher des Klimawandels wie RWE, die sich nun erstmals auf lückenlose Kausalketten stützen können. Eine klare Empfehlung!

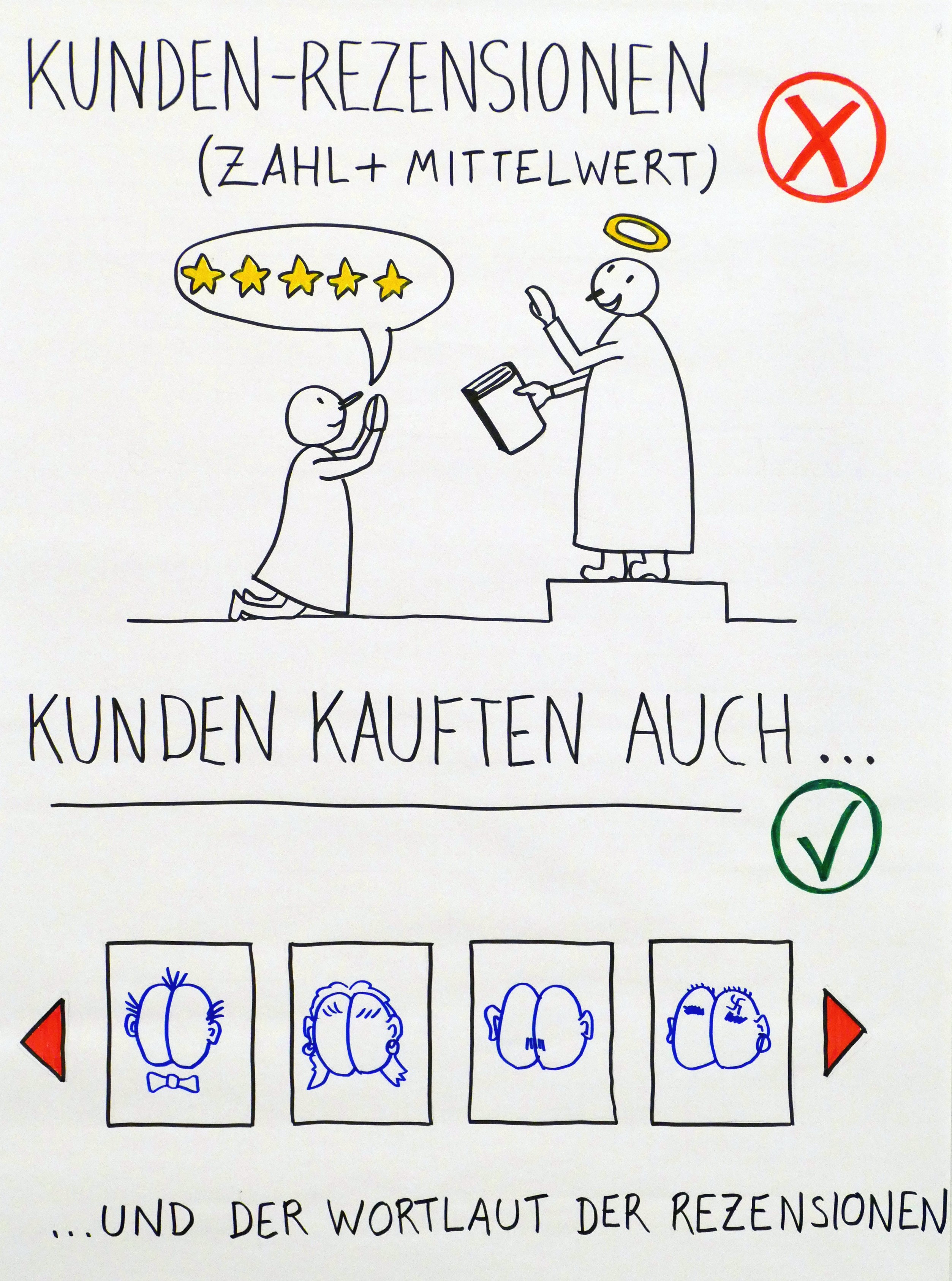
Ein Exkurs zu zwei älteren Sachbüchern über Klimageschichte – aus aktuellem Anlass: Ein Diagramm von Lamb über die mittelalterliche Warmzeit wird von Klimawandel-Leugnern zur Relativierung der aktuellen Erwärmung eingesetzt. Auch Behringer wird gerne von Leugnern erworben, wie die „Kunden kauften auch“-Funktion bei Amazon zeigt.
Lambs nur noch antiquarisch erhältliches Buch ist zu alt (ursprünglich 1982), um daraus Belege für die jetzige Entwicklung abzuleiten. Bei Behringer (ursprünglich 2007) sind die Relativierung und der Spott über die Warner schon irritierender. Sieht man davon ab, sind beide Werke sehr interessant, weil sie die Anpassungsfähigkeit der Menschen an (allerdings viel langsamere) Klimaveränderungen in der Vergangenheit – und auch deren Grenzen – aufzeigen.
Behringer ist bei der Bundeszentrale für politische Bildung nicht mehr erhältlich; eine kluge Entscheidung. Der Originalverlag Beck vertreibt ihn aber – in anderer Aufmachung als hier im Foto – weiter.

Kommen wir zur englischsprachigen Fachliteratur. „Biodiversity and Climate Change“ (2019, 36€) kann ich nur empfehlen; mein Workshop beim Sommerkongress von „Fridays for Future“ basierte vor allem auf diesem Buch.
Es hat 28 Kapitel in fünf Teilen:
- Überblick: Was ist Klimawandel?
- Welche Veränderungen gibt es?
- Was sagt uns die Vergangenheit?
- Was bringt die Zukunft?
- Wie können Naturschutz und Politik reagieren?
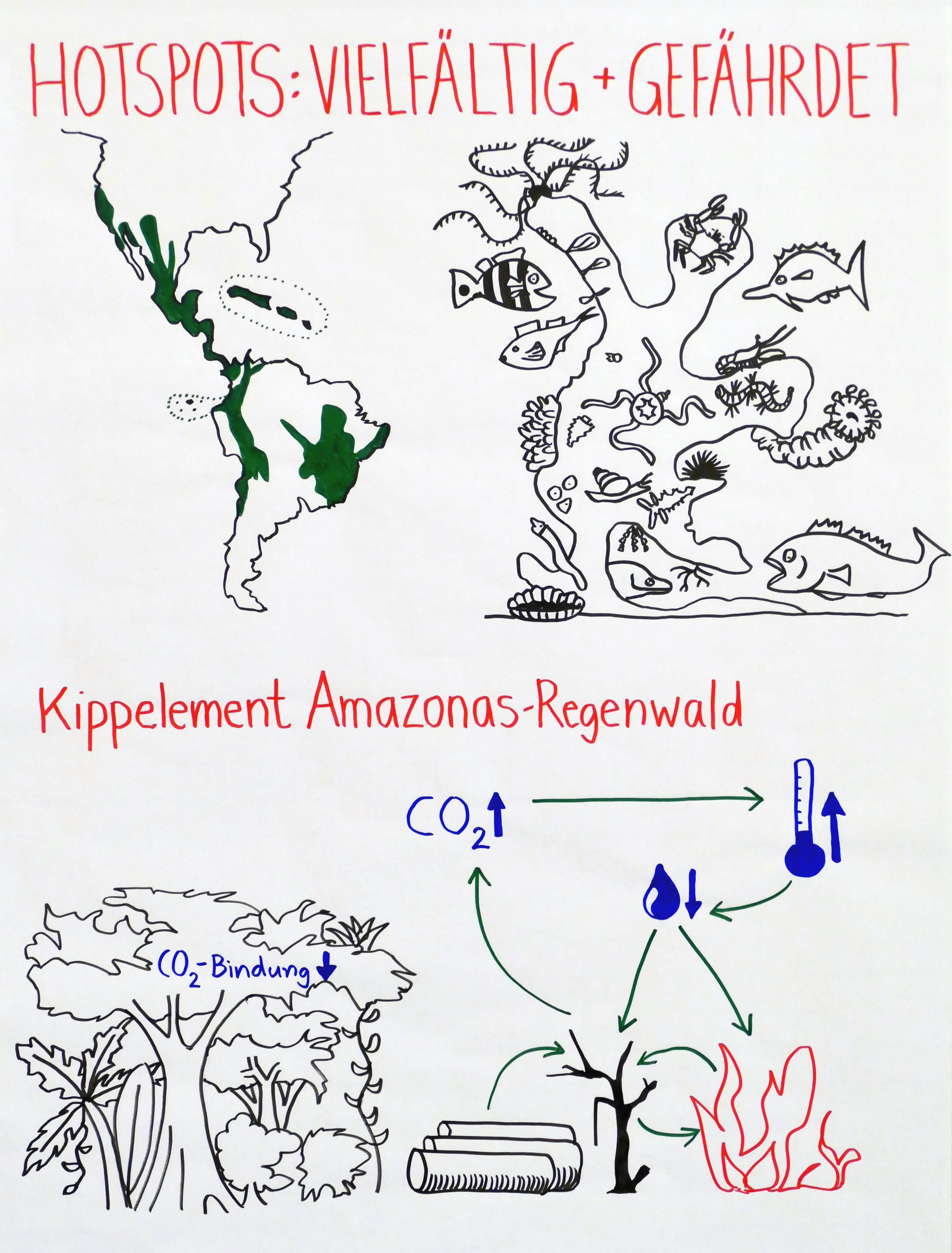
Bieris Sachbuch „Natur aus den Fugen: Die Verbreitung invasiver Arten“ (2018, 20€) behandelt den Klimawandel leider kaum, ist aber eine anschauliche, niederschwellige Einführung in das Phänomen der invasiven Arten. Das von Lovejoy und Hannah herausgegebene Fachbuch macht allerdings klar: Durch den Klimawandel werden praktisch alle Arten invasiv, denn sie müssen jetzt wandern, dem Klima hinterher.
 William W. Hay, „Experimenting on a Small Planet“ (2016, ca. 59€): Ich will nicht so tun, als hätte ich den 800-Seiten-Wälzer bereits durchgelesen. Der Autor ist ein renommierter Geologe. Trotz der vielen Diagramme, Tabellen, Formeln usw. sieht er sein Werk nicht als Fachbuch, sondern als Einführung für (amerikanische) Laien. Und er erklärt Klimawandel wirklich gut, also nicht abschrecken lassen!
William W. Hay, „Experimenting on a Small Planet“ (2016, ca. 59€): Ich will nicht so tun, als hätte ich den 800-Seiten-Wälzer bereits durchgelesen. Der Autor ist ein renommierter Geologe. Trotz der vielen Diagramme, Tabellen, Formeln usw. sieht er sein Werk nicht als Fachbuch, sondern als Einführung für (amerikanische) Laien. Und er erklärt Klimawandel wirklich gut, also nicht abschrecken lassen!
Sympathisch-spleenig: Zu jedem Kapitel empfiehlt er die passende Musik und alkoholische Getränke. Da er nicht gerade optimistisch ist, was unsere Chancen angeht, die Katastrophe abzuwenden, ist neben gutem Wein auch Schnaps dabei.
32 Kapitel, Cartoons, Lektüretipps, Zeitleisten usw. – so was wie Mann’s Klima-MOOC in Buchform. Ich freue mich auf die weitere Lektüre!

Und die vorerst letzte Mini-Buchbesprechung: Anthony J. McMichael ist leider gegen Ende der Arbeit an „Climate Change and the Health of Nations“ verstorben; zwei Kollegen haben das Werk zum Glück fertiggestellt.
Dargestellt werden Auswirkungen klimatischer Veränderungen (in alle Richtungen: kälter, wärmer, instabiler) auf die Menschheit seit ihren ersten Anfängen bis in die Gegenwart. Gesundheit wird dabei weit ausgelegt; es geht nicht nur um direkte Veränderungen der Sterblichkeit durch Hitze, Kälte, Dürre oder Fluten, sondern auch um Kriege und Unruhen, Verarmung, Seuchen usw. So bekommt man ein Gespür für das Ausmaß und die Grenzen der Anpassungsfähigkeit von Individuen und Gesellschaften, deren Umwelt sich ungünstig entwickelt.
Zentral ist das Goldlöckchen-Prinzip, Lebewesen gedeihen nur, wenn Umweltparameter „genau richtig“ sind; extreme Abweichungen vom diesem Korridor sind in beide Richtungen fatal. Das Buch endet mit einem Blick in die Zukunft: Energische Klimaschutzmapnahmen und ein Ende der Wachstumsideologie sind nötig, werden aber durch enorme psychologische Widerstände und kurzfristige Wirtschaftsinteressen erschwert. (Erscheinungsjahr 2017, €38)
Hoffentlich war etwas Passendes für euch (oder für Geschenke an andere) dabei!