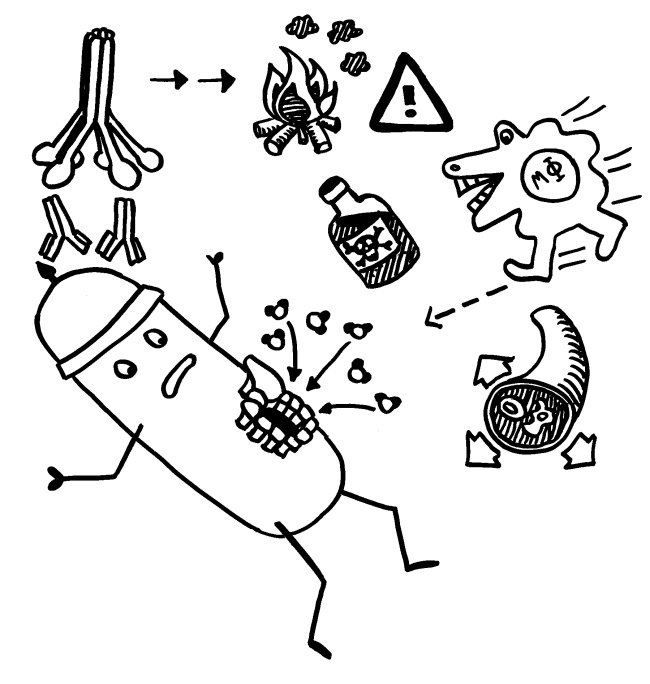
Darmzellen – und nur sie – stellen aus unserer Nahrung Vitamin A her. Dieses Molekül löst in den örtlichen dendritischen Zellen die Herstellung bestimmter Zytokine aus, die wiederum in den aktivierten T-Zellen die Produktion darmspezifischer Lockstoff-Rezeptoren bewirken. Der Darm wird diesen T-Zellen gewissermaßen als Heimatort in den Pass eingetragen, und wenn sie bei ihrer Wanderung durch die Blutgefäße in eine Gegend kommen, die entsprechende Lockstoffe herstellt, beenden sie ihre Reise und nehmen ihre Arbeit auf.
In den Hautzellen – und nur in ihnen – entsteht durch die UV-B-Strahlung Vitamin D3. Dieses Molekül löst in den dendritischen Zellen der Haut die Herstellung von Substanzen aus, die in aktivierten T-Zellen die Produktion hautspezifischer Lockstoff-Rezeptoren bewirken. In den Reisepass wird also die Heimat Haut eingetragen.
Nach diesem Prinzip gelangen auch alle anderen T-Zellen an ihren Einsatzort. Durch die Rezirkulation nach ihrer Aktivierung agieren die T-Zellen nicht nur in der engsten Umgebung ihres Aktivierungsorts, sondern im gesamten Organ oder Gewebe. Die chemische Erkennung ihres Reiseziels verhindert, dass sie am falschen Ort ihr Pulver verschießen oder Schaden anrichten.
Sie dürfen diese Zeichnung gerne in Folien etc. übernehmen, sofern Sie die Quelle angeben: Dr. Andrea Kamphuis, https://autoimmunbuch.de