Wie bin ich noch gleich auf das Thema Thymus gekommen, damals im September? Ach ja: Ich wollte im Autoimmunbuch-Manuskript „mal rasch“ erklären, wann und wie der Thymus während der Embryonalentwicklung entsteht. Ha! Haha! Nach der einen oder anderen Abschweifung komme ich nun auf diese Frage zurück – und verfolge den Werdegang des Organs gleich bis ins hohe Alter.
Entstehung des Thymus
Der Thymus wird beim Menschen recht früh angelegt, und zwar nicht dort, wo sich das Organ später befindet (zwischen Brustbein und Herz), sondern weiter oben: in der Region der dritten Kiementasche am Hals des Embryos. Dass Säugetier-Embryonen zunächst Kiementaschen ausbilden, ist einer der zahlreichen Belege für unsere stammesgeschichtliche Verwandtschaft mit den Fischen, die ja ebenfalls zu den Wirbeltieren gehören und auch (mindestens) einen Thymus haben. (Haie haben fünf Thymi, Knochenfische nur einen, wie wir Säugetiere.)
Stammzellen aus dem Endoderm – dem innersten der drei Keimblätter im jungen Embryo, aus dem unter anderem der Verdauungstrakt, die Leber und die Lunge entstehen – entwickeln sich hier zu Epithelzellen. In manchen, durchaus auch neuen Lehrbüchern ist noch von einer Beteiligung eines zweiten Keimblatts die Rede, nämlich des Ektoderms, das unter anderem die Haut und das Nervensystem hervorbringt. Tatsächlich haben Thymuszellen mit diesen Organen einiges gemeinsam, etwa die Keratinproduktion oder die Kommunikation über Neuropeptide. Nach derzeitigem Wissensstand stammen sie dennoch alle aus dem Endoderm.
Anfangs ist noch kein Unterschied zwischen einer Rinde und einem Mark zu erkennen, und es fehlen die Hohlräume zwischen den Zellen sowie die Blutgefäße. Besiedelt wird der junge Thymus mit T-Zell-Vorläufern aus dem blutbildenden Knochenmark, das wiederum dem mittleren Keimblatt entstammt: dem Mesoderm, das neben Knochen und Blut auch die Muskeln, die Nieren und das Herz hervorbringt. Die Besiedlung beginnt etwa ab Tag 60 der Schwangerschaft. Die durch Lockstoffe (Chemokine) angezogenen und anfangs – mangels Blutgefäßen – direkt durch das Gewebe einwandernden T-Zell-Vorläufer regen den jungen Thymus zur Ausbildung seiner charakteristischen Schwammstruktur, zur Differenzierung in Rinde und Mark sowie zur Ausbildung von Blutgefäßen an, über die dann weitere Prä-Thymozyten nachkommen.
Die T-Zell-Produktion setzt weit vor der Geburt ein
Sobald die Architektur steht, setzen die positive und die negative Selektion ein. Ab der 9. Schwangerschaftswoche produziert der junge Thymus zunächst sogenannte γδ-T-Zellen, die bei Erwachsenen nur etwa fünf Prozent aller Lymphozyten ausmachen und vor allem in der Haut und den Schleimhäuten sehr schnell auf Gewebsveränderungen (etwa durch Infektionen) reagieren können, da sie bereits voraktiviert in das Gewebe einwandern. Ihre T-Zell-Rezeptoren bestehen aus einer Gamma- und einer Delta-Kette und weisen eine viel geringere Diversität auf als die später viel häufigeren αβ-T-Zellen.
Ab der 10. Woche werden auch T-Zellen mit Rezeptoren aus α- und β-Ketten hergestellt, also Helferzellen (CD4+), zytotoxische T-Zellen (CD8+) und regulatorische T-Zellen (Tregs). Die Nachfahren der Einwanderer aus dem Knochenmark vermehren sich dabei enorm, sowohl im Thymus als auch anschließend in der Peripherie. So ist jeder individuelle T-Zell-Rezeptor mit dem ihm eigenen Antigen-Erkennungsmuster, der die Selektion im Thymus bestanden hat, im menschlichen Körper auf schätzungsweise 1000 bis 10.000 naiven (d. h. noch nie mit „ihrem“ Antigen konfrontiert gewesenen) T-Zellen vertreten, die von einem einzigen Thymozyten abstammen, also einen Klon bilden. Wenn eine T-Zelle ein Antigen erkennt, setzt eine weitere starke Vermehrung ein, damit der expandierte Klon die Gefahr schnell und gründlich eindämmen kann.
Der Thymus schrumpft – relativ ab der Geburt, absolut spätestens ab der Pubertät
Im voll entwickelten Thymus kommen auf jede Thymus-Epithelzelle etwa 1000 Thymozyten, also künftige T-Zellen. Bei der Geburt des Kindes wiegt das Organ – nunmehr an seiner endgültigen Position vor dem Herzen angelangt – etwa 15 Gramm, in der Pubertät etwa 35 Gramm, mit 25 Jahren etwa 25 Gramm, bei 60-Jährigen höchstens noch 15 Gramm und mit 70 Jahren gelegentlich sogar weniger als 5 Gramm. Das relative Gewicht sinkt bereits von der Geburt an kontinuierlich.
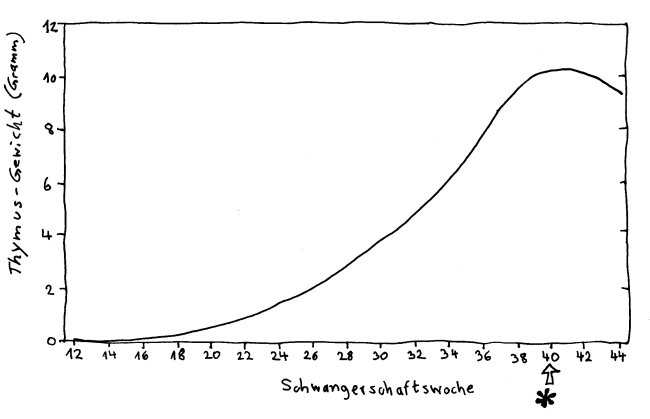
Das Thymusgewicht erreicht zur Geburt seinen vorläufigen Höhepunkt. In der Kindheit wächst der Thymus zwar weiter, aber langsamer als der Rest des Körpers. Nach FitzSimmons et al. (1988): Normal length of the human fetal gastrointestinal tract.
Schon mit etwa einem Jahr setzt beim Menschen die sogenannte Involution oder Atrophie des Thymus ein, die von außen nach innen voranschreitet: Thymus-Epithelzellen werden durch Adipozyten, also Fettzellen, sowie Bindegewebszellen ersetzt. Durch diesen Umbau kann das Gewicht noch einige Jahre weiter ansteigen, obwohl die Involution bereits in vollem Gange ist. Übrig bleiben schließlich in jedem Läppchen vereinzelte Inseln mit einem Rinden- und einem Mark-Anteil, getrennt durch nichtfunktionales Gewebe. Durch den Schwund des funktionalen Thymusgewebes sinkt auch der tägliche Output an neuen naiven T-Zellen. Weiterlesen

