Neulich fragte ein Leser meiner alten Blogartikel zu den Sialinsäuren und Siglecs, warum der Mensch vor 2-3 Millionen Jahren das Primaten-Siglec verloren hat, das die Sialinsäure N-Glycolylneuraminsäure (Neu5Gc) erkennt. Auf der Basis eine neuen Artikels von Vered Padler-Karavani et al. (Rapid evolution of binding specificities and expression patterns of inhibitory CD33-related Siglecs in primates, The FASEB Journal, 05.12.2013) möchte ich das so erklären:
Die grundsätzliche Funktion von Siglecs, nämlich die Erkennung von säugetierzelltypischen Sialinsäuren zwecks Blockade überzogener Immunreaktionen, habe ich im vorigen Beitrag dargestellt. Damit diese Blockade gelingt, muss zum einen die körpereigene Zelle (hier eine Darmschleimhautzelle, links) ihre Sialinsäuren vorzeigen (Peace-Zeichen). Zum anderen muss die Immunzelle (rechts) diese Sialinsäuren erkennen und von anderen Sialinsäuren unterscheiden können, die zum Beispiel zu einem Pathogen gehören. Das Siglec ist also ein Rezeptor, der genau zum Signal passt:
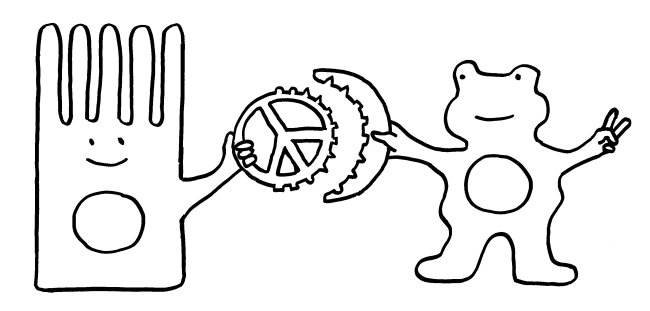 Jedes derartige Erkennungssystem ist von zwei Seiten angreifbar. Zum einen können Pathogene die Sialinsäuren der Körperzellen als Anker verwenden, um an die Zellen anzudocken und dann in sie einzudringen. Ein bekanntes Beispiel sind die Influenza-Viren, die mit den Hämagglutininen auf ihren Hüllen an die Sialinsäure N-Acetylneuraminsäure (Neu5Ac) binden. Aber auch Bakterien können mit dem passenden Rezeptor an die Sialinsäuren von Schleimhautzellen o. ä. andocken:
Jedes derartige Erkennungssystem ist von zwei Seiten angreifbar. Zum einen können Pathogene die Sialinsäuren der Körperzellen als Anker verwenden, um an die Zellen anzudocken und dann in sie einzudringen. Ein bekanntes Beispiel sind die Influenza-Viren, die mit den Hämagglutininen auf ihren Hüllen an die Sialinsäure N-Acetylneuraminsäure (Neu5Ac) binden. Aber auch Bakterien können mit dem passenden Rezeptor an die Sialinsäuren von Schleimhautzellen o. ä. andocken:
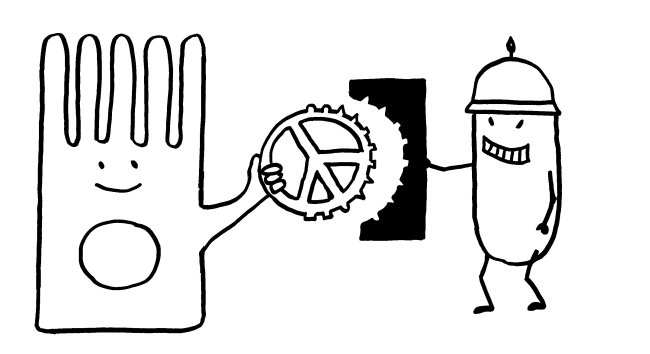 Andere Pathogene bedecken sich mit Sialinsäuren, um an die Siglecs der Immunzellen zu binden, in diese einzudringen und sich in ihnen zu vermehren. Sie fälschen gewissermaßen die Peace-Zeichen, um sich als Säugetierzellen zu tarnen (molekulare Mimikry):
Andere Pathogene bedecken sich mit Sialinsäuren, um an die Siglecs der Immunzellen zu binden, in diese einzudringen und sich in ihnen zu vermehren. Sie fälschen gewissermaßen die Peace-Zeichen, um sich als Säugetierzellen zu tarnen (molekulare Mimikry):
 Die Pathogene und ihre Wirte können auf diese Weise in ein doppeltes evolutionäres Wettrüsten geraten:
Die Pathogene und ihre Wirte können auf diese Weise in ein doppeltes evolutionäres Wettrüsten geraten:
Mit Sialinsäuren überzogene Krankheitserreger zwingen die Säugetier-Immunzellen, ihre Siglecs so zu modifizieren, dass sie nicht mehr auf die gefälschten Friedenszeichen hereinfallen. Die Veränderung der Siglecs zieht dann Modifikationen der molekularen Mimikry der Pathogene nach sich, und so weiter (oberer Teufelskreis im nächsten Bild).
Krankheitserreger mit Siglec-artigen Rezeptoren zwingen die Säugetierzellen dagegen, ihre Sialinsäure-Signatur zu verändern, um nicht mehr infiziert zu werden. Diese Signaturänderung wiederum zwingt die Pathogene, ihre Siglec-artigen Rezeptoren zu modifizieren, um weiter an ihre Wirte andocken zu können (unterer Teufelskreis).
Bei all diesen Änderungen darf aber die Passung zwischen der Säugetier-Sialinsäure und dem entsprechenden Immunzellen-Siglec nicht verloren gehen; auch hier üben beide Seiten aufeinander einen Selektionsdruck aus (mittlerer Teufelskreis).
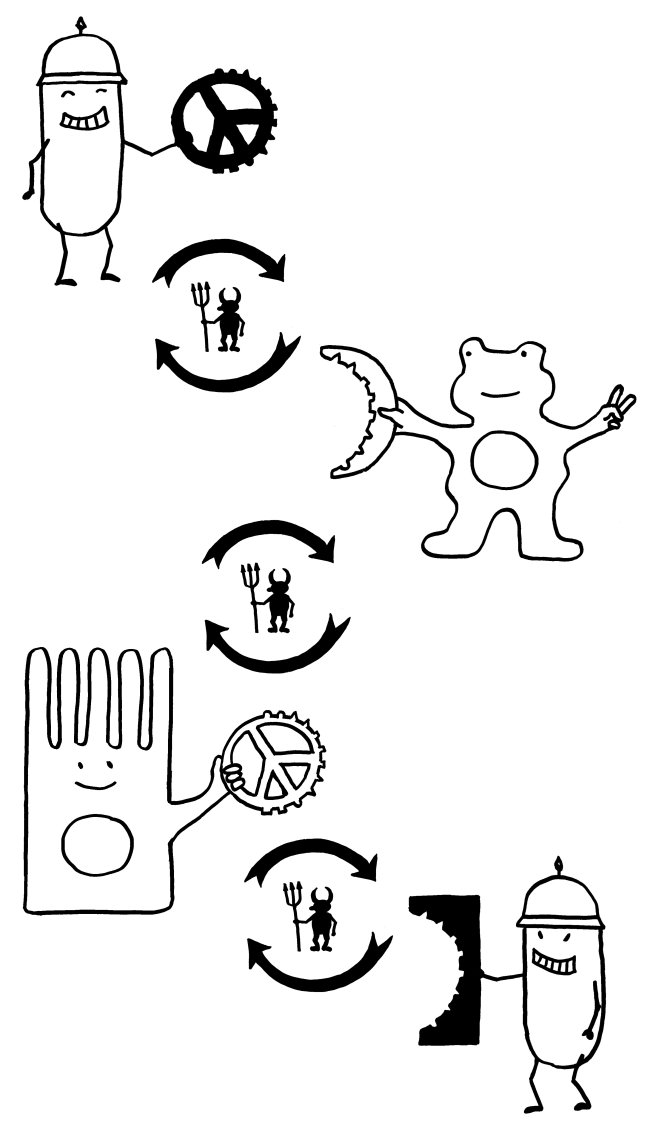 Manchmal lassen sich all diese Selektionsbedingungen für das Säugetier nicht mehr gleichzeitig erfüllen. Das scheint bei unseren Vorfahren vor zwei bis drei Millionen Jahren mit dem Paar Neu5Gc und Siglec-12 geschehen zu sein: Durch wiederholte Angriffe von mehreren Seiten verloren die beiden Gene ihre Funktion. Menschliche Zellen stellen seither kein Neu5Gc her, bauen es aber in ihre Membranen ein, wenn wir es mit der Nahrung aufnehmen. Und unsere Immunzellen erkennen dieses Neu5GC nicht mehr als harmlos, sondern lösen u. U. Immunreaktionen dagegen aus.
Manchmal lassen sich all diese Selektionsbedingungen für das Säugetier nicht mehr gleichzeitig erfüllen. Das scheint bei unseren Vorfahren vor zwei bis drei Millionen Jahren mit dem Paar Neu5Gc und Siglec-12 geschehen zu sein: Durch wiederholte Angriffe von mehreren Seiten verloren die beiden Gene ihre Funktion. Menschliche Zellen stellen seither kein Neu5Gc her, bauen es aber in ihre Membranen ein, wenn wir es mit der Nahrung aufnehmen. Und unsere Immunzellen erkennen dieses Neu5GC nicht mehr als harmlos, sondern lösen u. U. Immunreaktionen dagegen aus.







