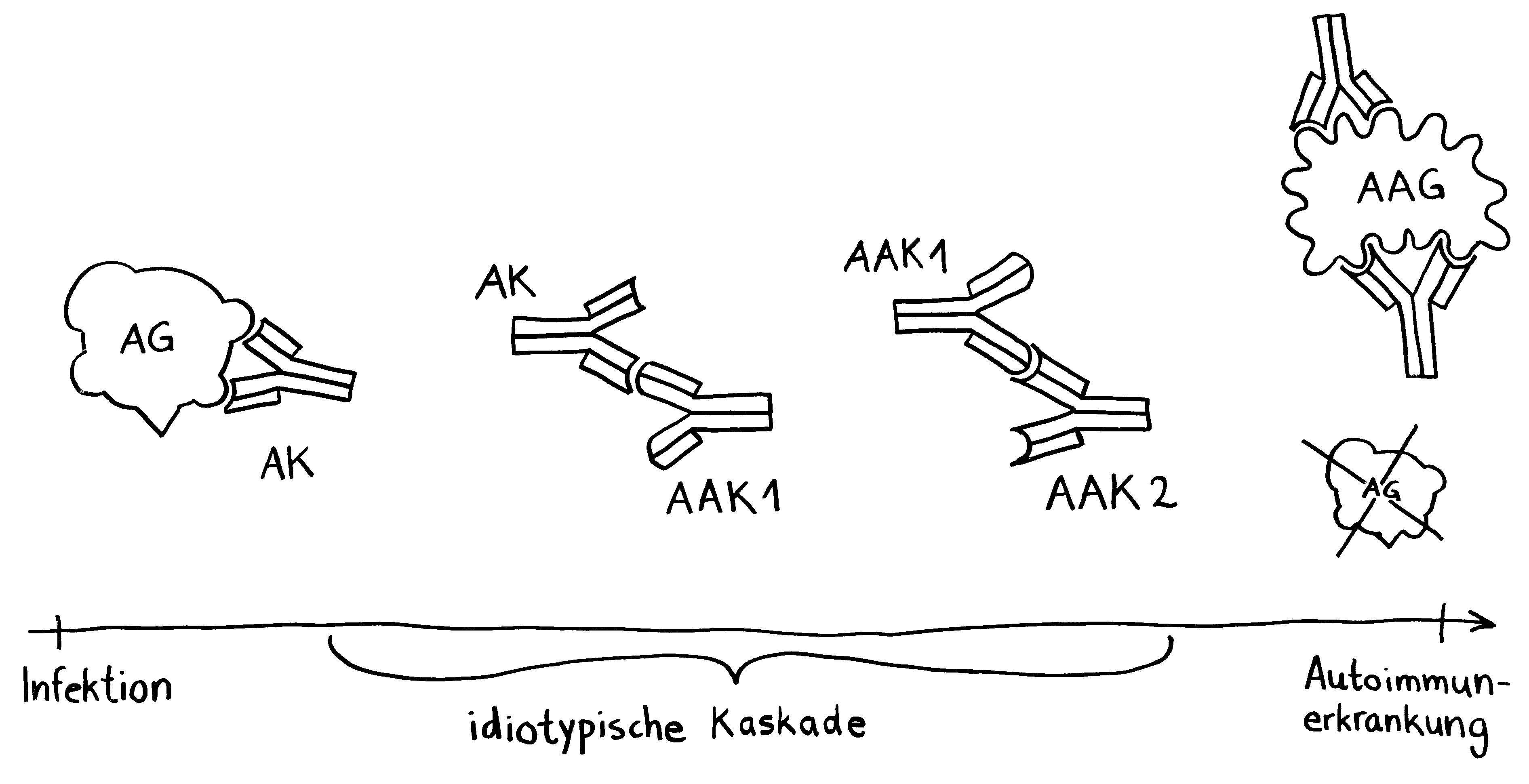
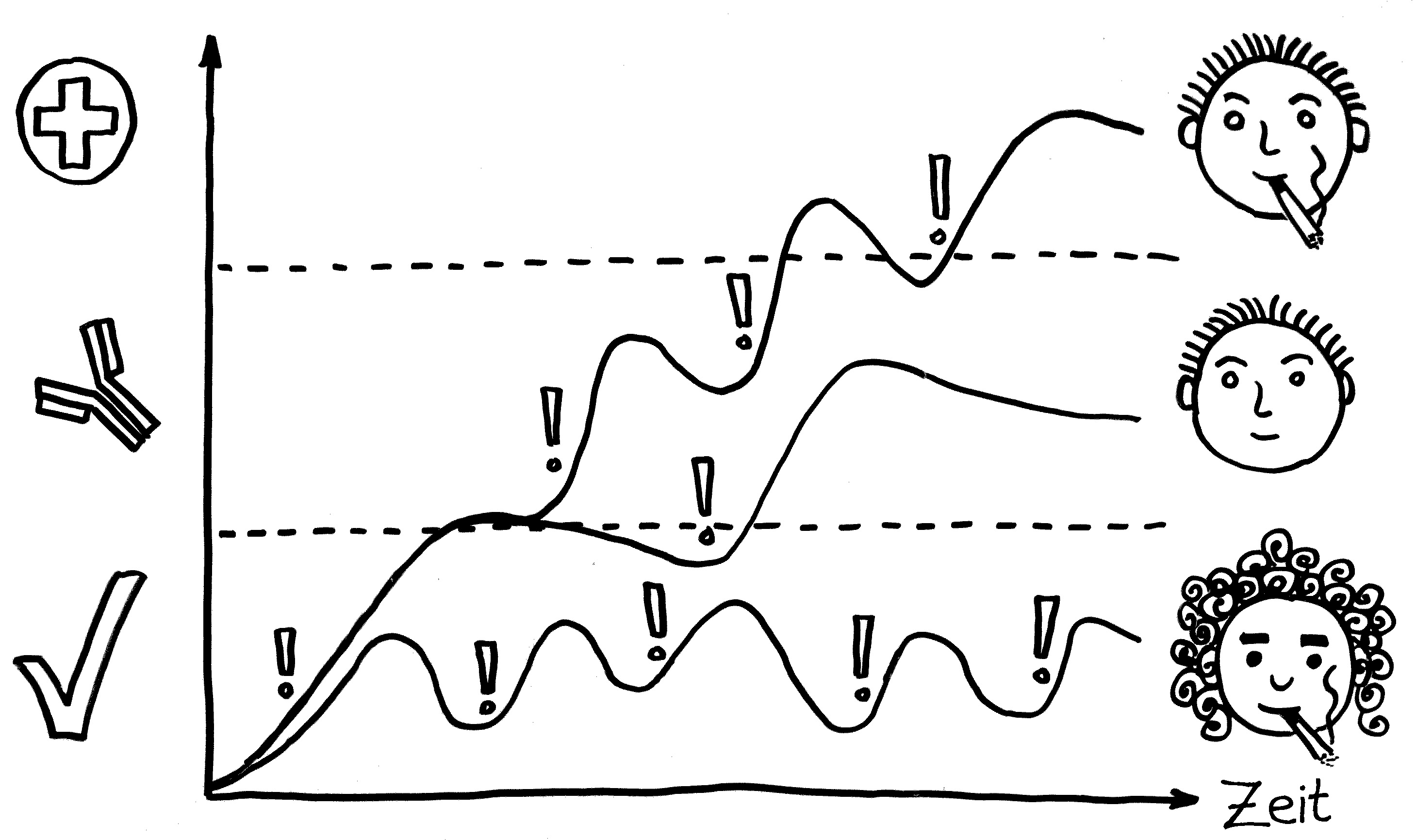
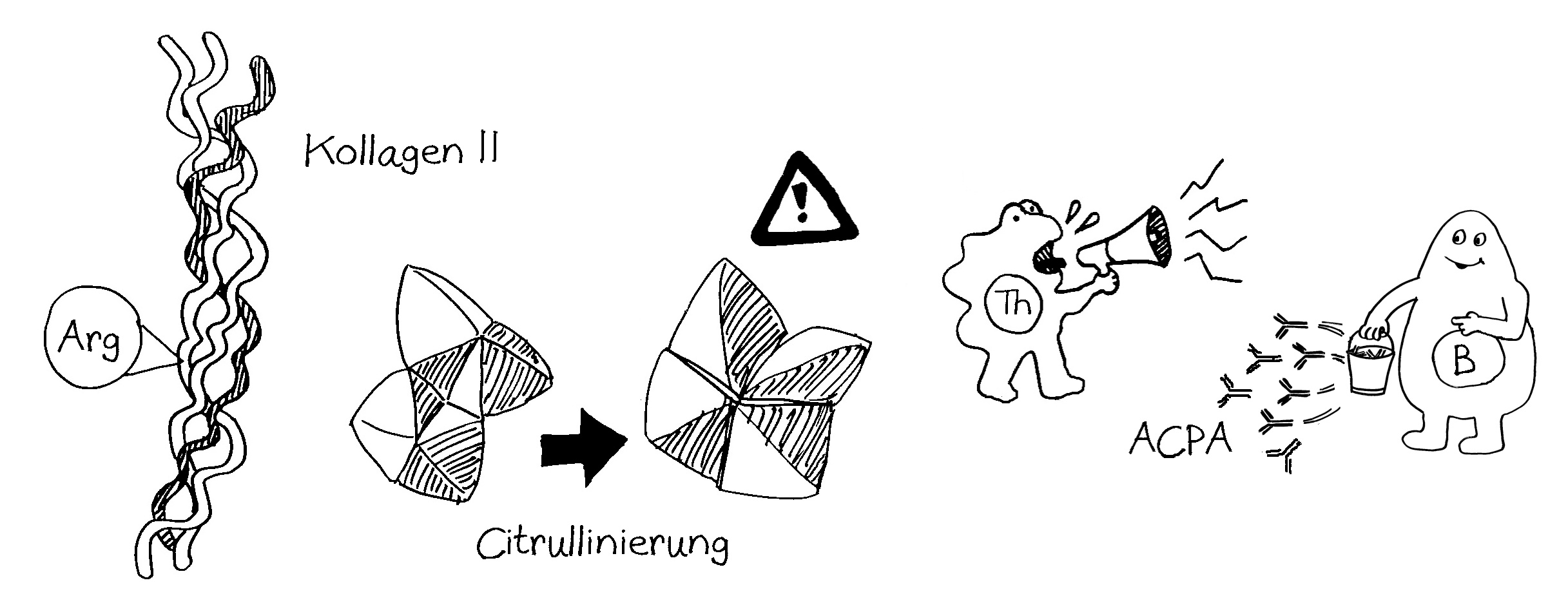
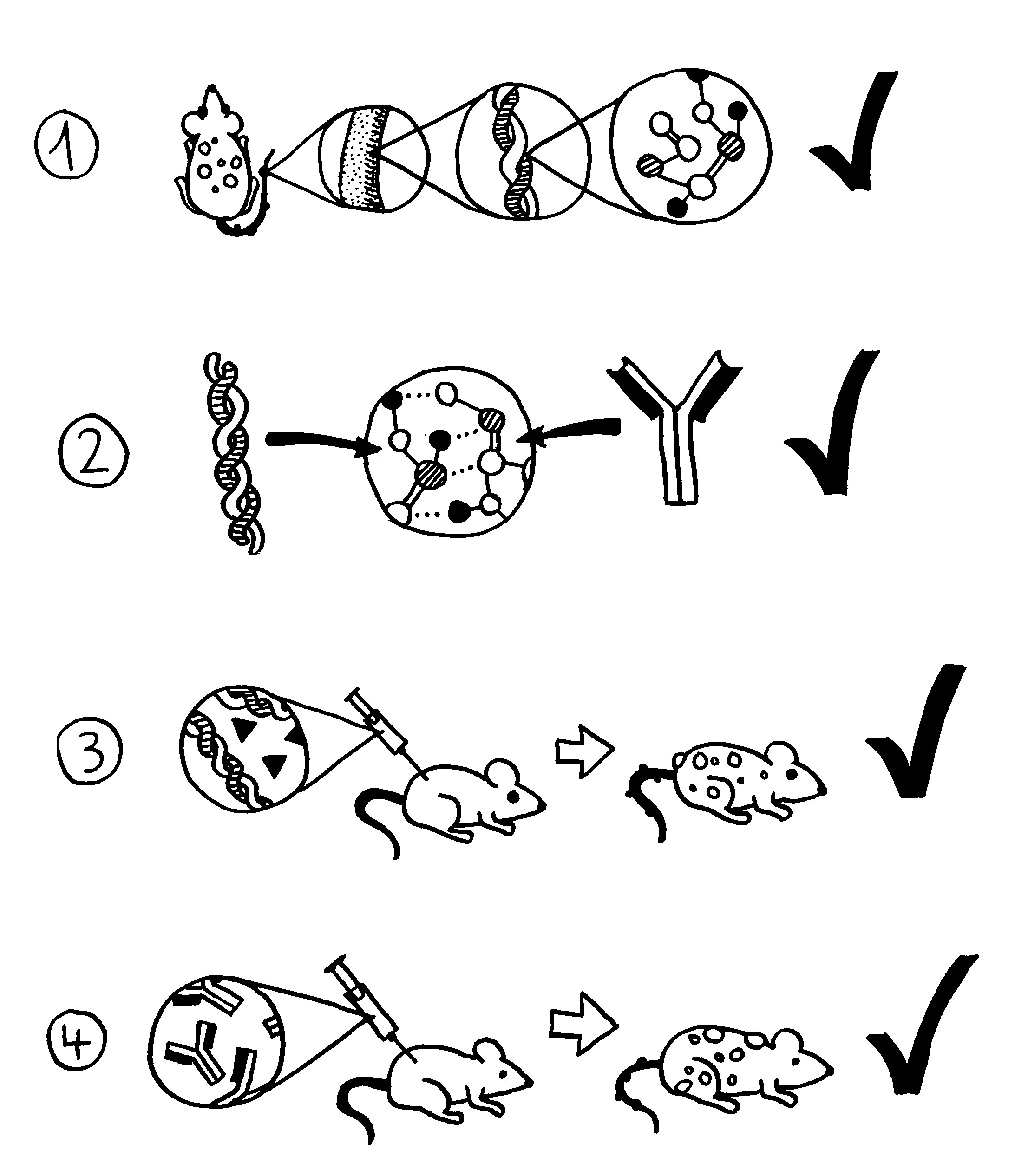
Vor allem für mich selbst als Erinnerungsstütze trage ich zwei Erkenntnisse aus der Karelien-Literatur nach:
(1) Kondrashova et al., Signs of β-Cell Autoimmunity in Nondiabetic Schoolchildren (2007): Zwar ist Typ-1-Diabetes in Finnland viel häufiger als im russischen Karelien. Aber Betazellautoimmunität, angezeigt durch verschiedene Autoantikörper, ist im russischen Teil genauso häufig wie in Finnland (mit Ausnahme des Antikörpers gegen Tyrosinphosphatase IA-2, der in Finnland häufiger ist). Das heißt: Die Autoimmunprozesse setzen bei den Kindern mit etwa derselben Quote ein, aber in Finnland führen sie zu einer Erkrankung, während sie im russischen Karelien viele Jahre lang keinen Schaden anrichten. Das spricht für die Theorie, dass Autoimmunerkrankungen nicht durch das bloße Aufkommen von Autoimmunvorgängen bedingt sind, sondern durch ein Versagen der Regulierungsmechanismen, die solche Vorgänge zwar nicht abschalten, aber in Schach halten können.
(2) Kondrashova-Dissertation, 2009: Bei den untersuchten Schuldkindern (mittleres Alter: 11 Jahre) waren Schilddrüsen-Autoantikörper bei den Mädchen fast acht Mal so häufig wie bei den Jungen: etwa dasselbe Verhältnis wie bei den Prävalenzen erwachsener Frauen und Männer. Das heißt: Um den starken Frauenüberschuss bei Hashimoto-Thyreoiditis zu erklären, muss man vielleicht gar nicht auf Sexualhormone und Mikrochimerismus durch Schwangerschaften zurückgreifen; der reine X-Dosis-Effekt könnte ausreichen. Die Hormonveränderungen während der Pubertät könnten allerdings einen Beitrag leisten, denn die meisten der Kinder, bei denen Schilddrüsen-Aantikörper nachgewiesen wurden, waren älter als 11.