Martinez-Medina M et al. Western diet induces dysbiosis with increased E coli in CEABAC10 mice, alters host barrier function favouring AIEC colonisation. Gut 2014;63:116-124
Hold GL. Western lifestyle: a ‚master‘ manipulator of the intestinal microbiota? Gut 2014;63-1 (Kommentar zu Martinez-Medina M et al. 2014)
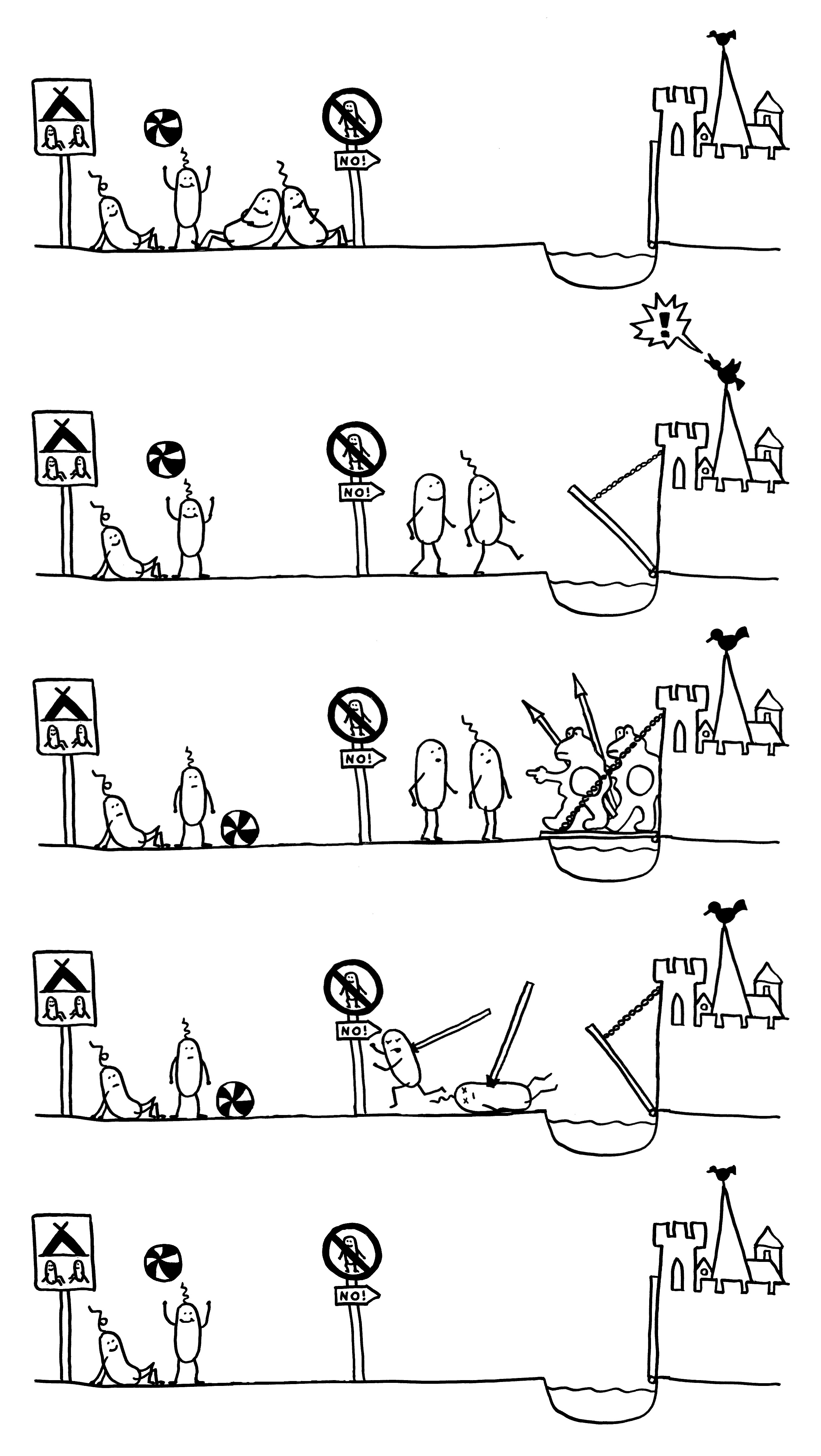
Gegenstand der Studie an einem neuen Maus-Modell für Morbus Crohn: Auswirkungen fett- und zuckerreicher „westlicher Kost“ auf die Zusammensetzung der Darmflora, den Zustand der Darmschleimhaut und die Anfälligkeit für AIEC-Infektionen in CEABAC10-Mäusen, die bestimmte humane Zelladhäsionsmoleküle (CEACAMs) exprimieren. AIEC = adhärent-invasive Escherichia coli.
Westliche Kost ist mit reduzierter Darmflora bei gleichzeitiger Zunahme von schleimabbauenden Bakterien aus dem Stamm Bacteroidetes (Gruppe Bacteroides/Prevotella) sowie Ruminococcus torques (Familie Lachnospiraceae, Stamm Firmicutes) assoziiert, wobei die genetischen Anlagen des Wirts sein Mikrobiom ebenfalls beeinflussen.
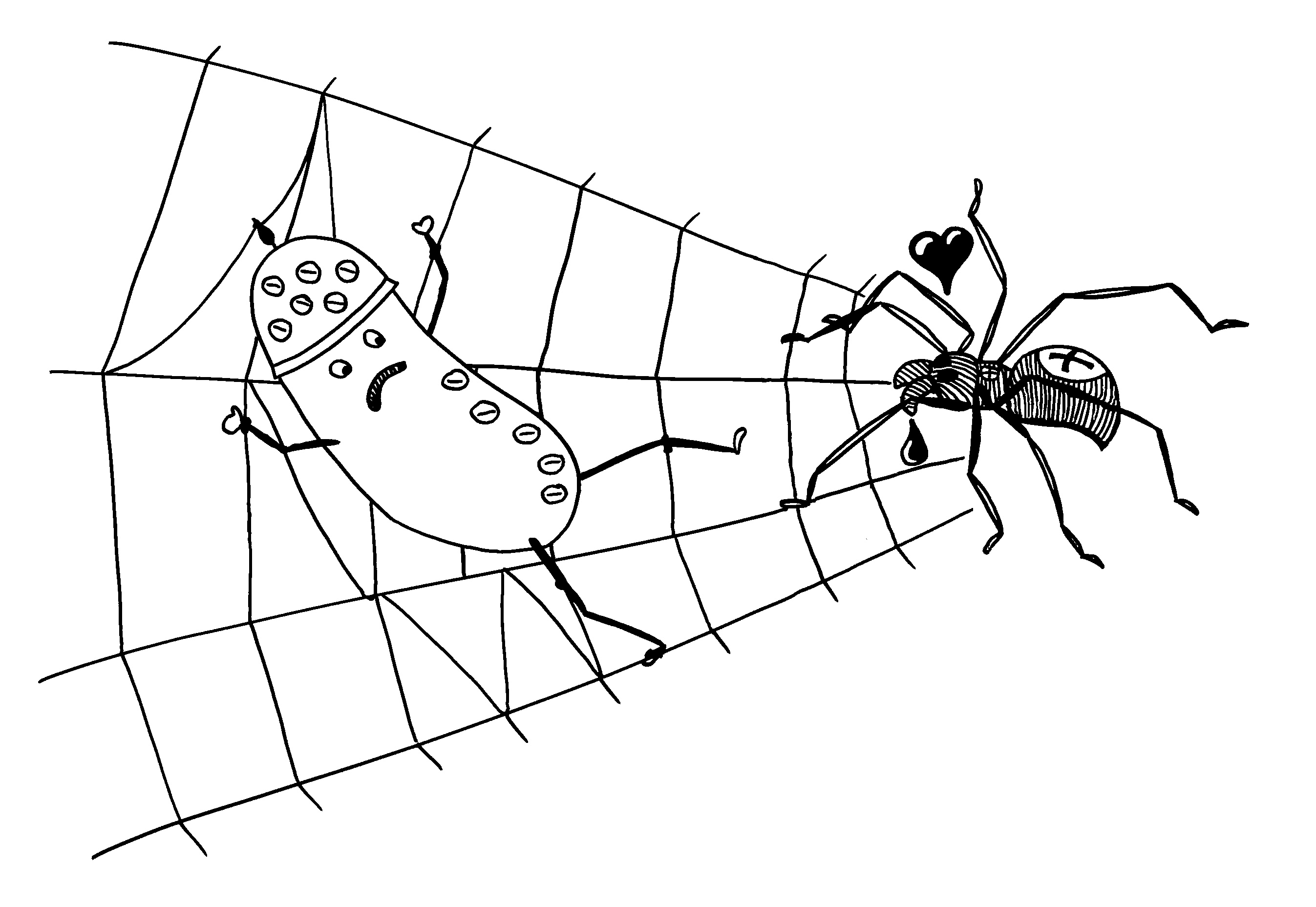
Zunahme der AIEC in den Mäusen entspricht der Situation in Morbus-Crohn-Patienten, vor allem, wenn deren Ileum (Krummdarm) betroffen ist: AIEC haben Typ-I-Pili und Geißeln, die an CEACAM6 binden – ein typisches Oberflächenprotein, das durch das Bakterium und auch durch proinflammatorische Zytokine des Wirts hochreguliert wird. Hochregulierung -> noch mehr von diesen Bakterien in der Lamina propria (Bindegewebsschicht unter dem Epithel der Schleimhaut) und in Makrophagen; Bakterien überleben in deren Phagolysosomen.
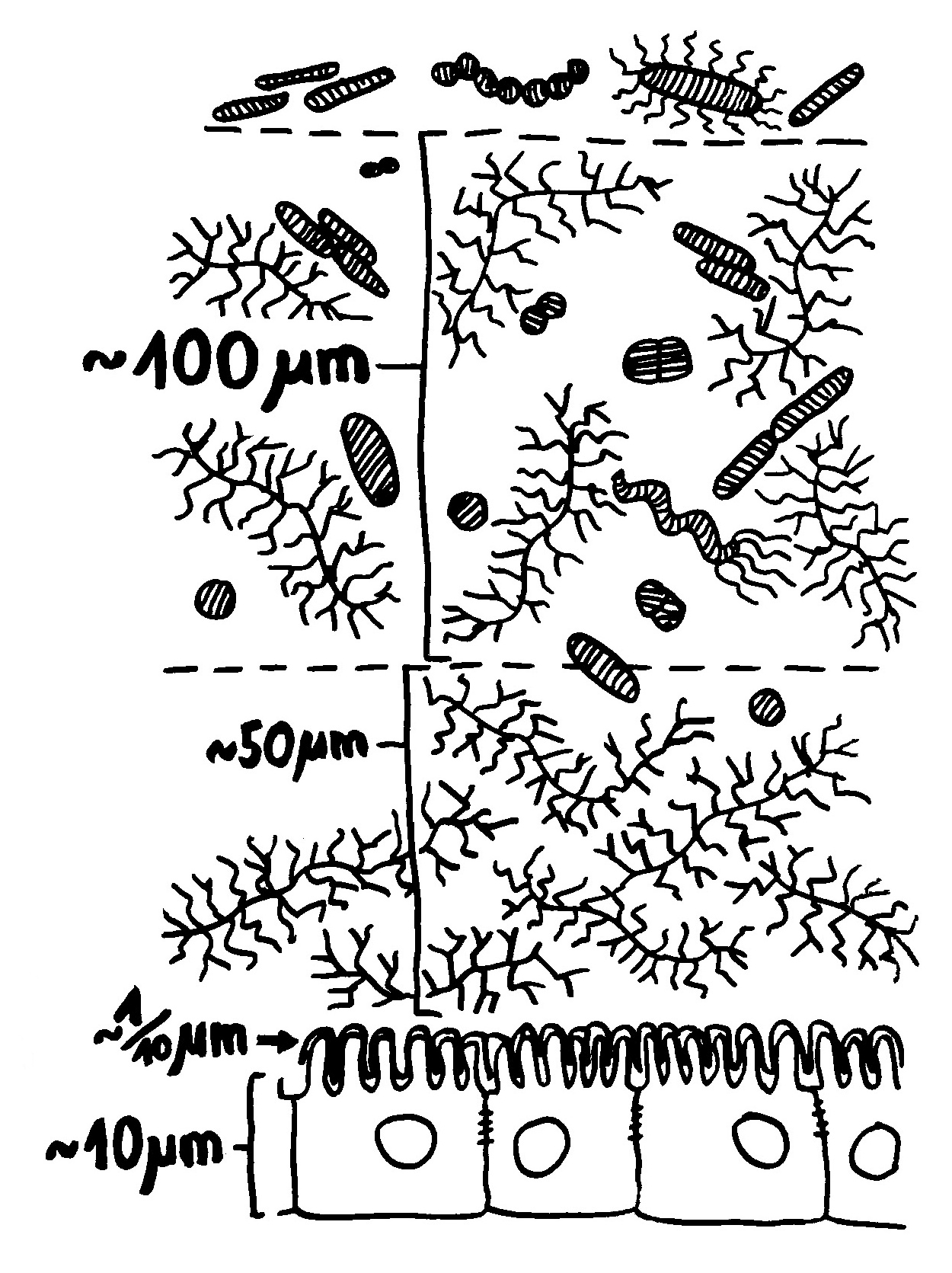
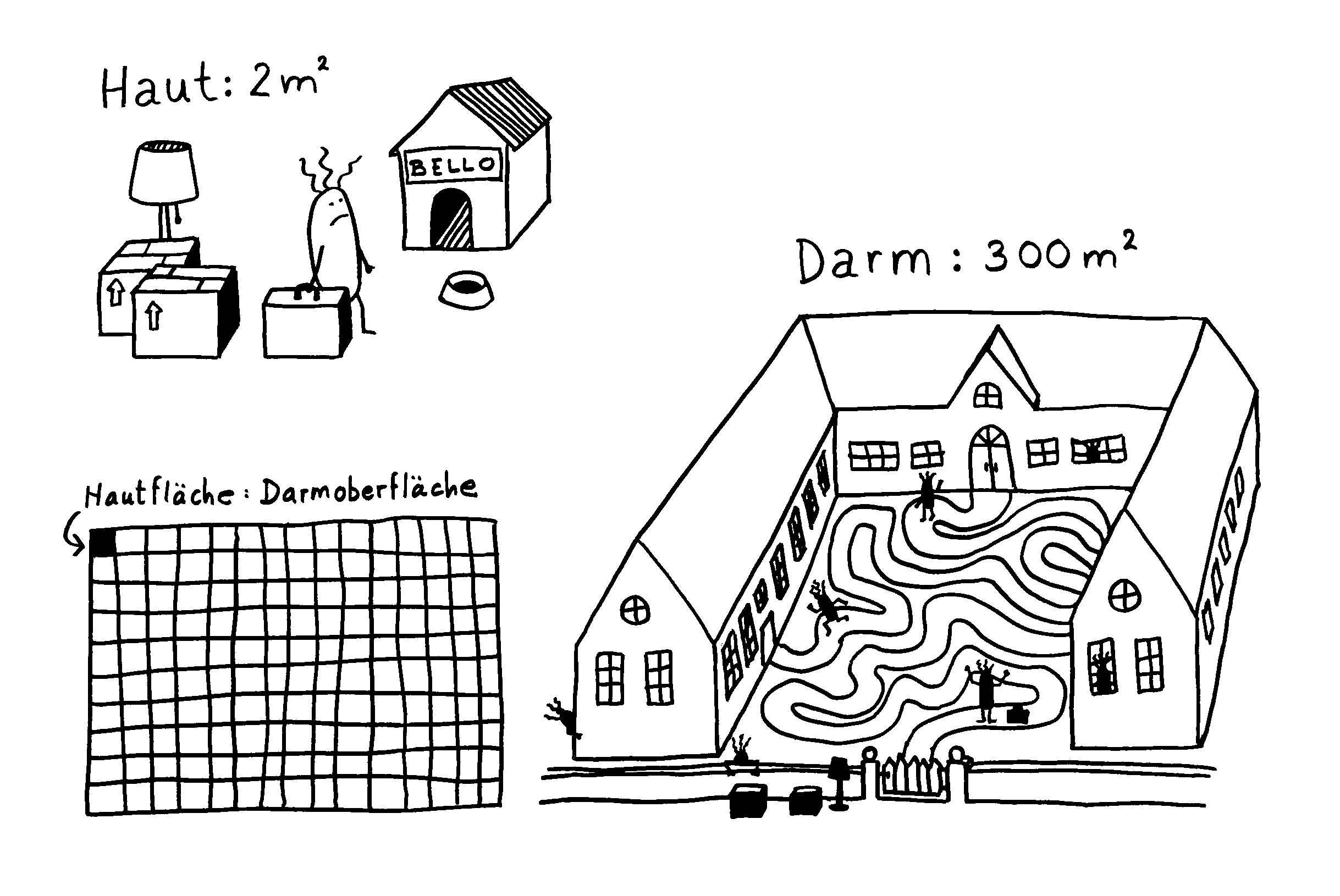
Verschiebung der Mikrobiom-Zusammensetzung -> Darmschleimhaut wird durchlässiger, Barrierefunktion (Zahl der Becherzellen, Mucin-Expression, Dicke der Schleimschicht) beeinträchtigt, Expression von Genen der angeborenen Abwehr verstärkt, Entzündungskaskaden hochgeregelt: mehr Nod2 (intrazellulärer Rezeptor, der Bakterienzellwandbestandteile erkennt) und TLR5 (Rezeptor, der Flagellin erkennt) -> MAP-Kinase-Weg und NF-κB-Signalweg -> Sekretion entzündungsfördernder Zytokine wie TNFα.
AIEC profitiert als opportunistisches Pathogen (Pathobiont) von den lokalen Bedingungen, die bei entsprechender genetischer Disposition durch westliche Kost geschaffen werden.
Zusammenfassung des Morbus-Crohn-Modells in Abb. 6: Westliche Kost (Ursache 1) -> Dysbiose -> leichte Entzündung (TNFα hochreguliert); bei genetischer Disposition des Wirts (CEACAM-Überexpression, Ursache 2) -> stärkere Dysbiose; bei Gegenwart von AIEC-Keimen (Ursache 3) -> Besiedlung des Darms durch den Pathobionten -> Entzündung verstärkt (TNFα noch weiter hochreguliert). Barrierefunktion wird immer schwächer, Immunreaktion immer stärker.
Offene Frage: Übertragbarkeit der Tierversuchsergebnisse auf Menschen; anderes Mikrobiom, andere Immunreaktionen …