Bevor ich die vor dem Urlaub begonnene Artikelserie zum Immunsystem, Krebs und Autoimmunerkrankungen zu Ende bringe, möchte ich auf einige neuere Arbeiten über das Immunsystem und das Mikrobiom von Menschen- und Mäusekindern hinweisen. Den Anfang macht eine Studie an jungen NOD-Mäusen:
Antibiotic Therapy During Infancy Increases Type 1 Diabetes Risk in Mice: eine Meldung zu A. E. Livanos et al., „Antibiotic mediated gut microbiome perturbation accelerates development of type 1 diabetes in mice“ (Bezahlschranke, daher nur Abstract gelesen)
Für Typ-1-Diabetes gibt es genetische Risikofaktoren, aber auch Trigger in unserer Lebenweise – anders lässt sich der rasante Anstieg der Prävalenz in den westlichen Ländern im letzten halben Jahrhundert nicht erklären. Schon länger hat man die Veränderung der frühkindlichen Darmflora durch Antibiotika im Verdacht, den Ausbruch der Erkrankung in späteren Jahren zu fördern.
In dieser Studie erkrankten Mäuse des für Typ-1-Diabetes anfälligen NOD-Stamms mit höherer Wahrscheinlichkeit, wenn sie in der ersten Lebensphase mit Antibiotika behandelt wurden. Die Jungmäuse erhielten die erste Tylosin-Gabe, während sie noch gesäugt wurden, und zwei kurz danach. Diese Pulse sollten dem Timing vieler Antibiotika-Behandlungen von Kleinkindern entsprechen.
Mit 32 Wochen war der Anteil der an Diabetes erkrankten männlichen Mäuse im Tylosin-Arm doppelt so hoch wie im Vergleichsarm. Kurz nach den Antibiotika-Gaben veränderte sich zudem die Darmflora der männlichen Tiere; vor allem Bifidobacteria und die Bacteroidales der S247-Familie gingen zurück. Diese Bakterien-Taxa werden beim Menschen mit einer gesunden, ungestörten Darmflora assoziiert: Bifidobacteria helfen Säuglingen, den Zucker aus der Muttermilch abzubauen, und S247-Bacteroidales sind bei isoliert lebenden indigenen Gruppen viel stärker vertreten als bei US-Amerikanern.
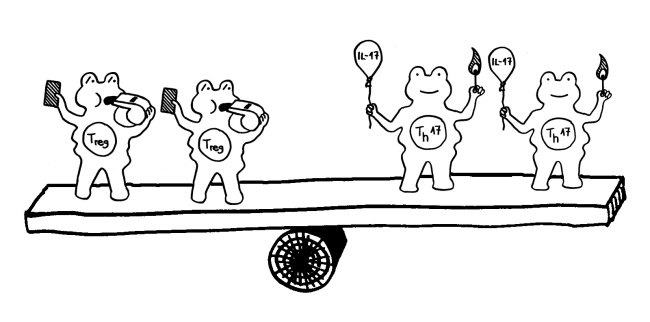
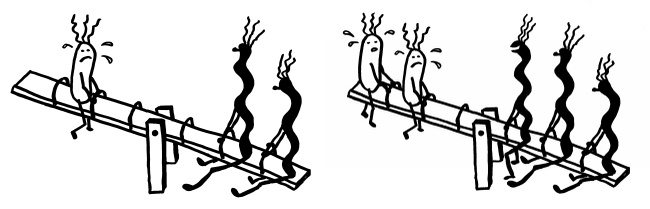
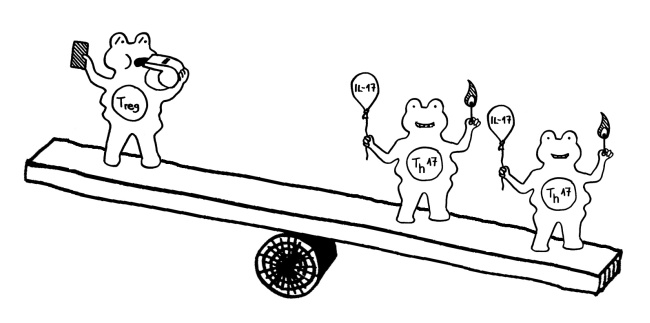
Auch das Immunsystem der Mäuse veränderte sich infolge der Antibiotika-Gaben: In der Darmschleimhaut fanden sich weniger Th17-Helferzellen und weniger regulatorische T-Zellen (Tregs), zu deren Aufgaben die Abwehr von Pathogenen gehört. Im Darm der behandelten Mäuse wurde unter anderem das Gen für das Protein Serum-Amyloid A (SAA) schwächer exprimiert. Normalerweise regen Darmbakterien die Darmschleimhautzellen zur Produktion von SAA an, das wiederum Th17-Helferzellen anlockt. Auch der Lipidstoffwechsel der Bakterien und die Expression von Mäusegenen, die an der Cholesterinsynthese beteiligt sind, waren gestört. – Zu prüfen wäre nun, ob Antibiotika bei Menschenkindern ähnlich wirken.