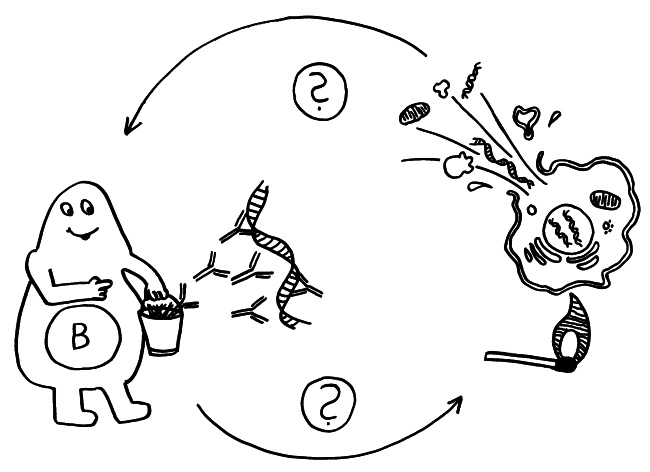
Endlich wieder eine Skizze fürs Buch: Um die irrsinnig komplexen Regelungsvorgänge im Immunsystem zu verstehen, muss man sich vergegenwärtigen, dass unsere Immunzellen eine Vielzahl von Aufgaben wahrnehmen. Sie sind nicht einfach auf die Pathogen-Abwehr optimiert.
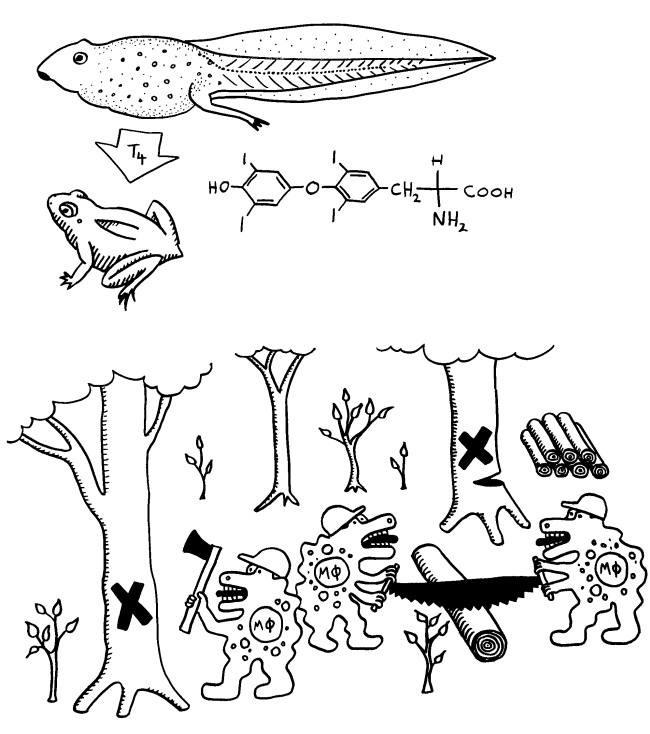
Makrophagen und andere phylogenetisch alte Zellen des angeborenen Immunsystems sorgen auch für den sicheren Abbau und Abtransport von Zellen und Geweben, die während der Embryonalentwicklung oder auch bei der Amphibien-Metamorphose überflüssig werden. So schaffen sie Platz für neue Organe. (Wer früher Kaulquappen im Aquarium gehalten hat, erinnert sich vielleicht noch an die Verwunderung, dass der fertige Frosch deutlich kleiner ist als die Kaulquappe kurz vor der Verwandlung.)
Das Hormon, das die Metamorphose der Kaulquappen auslöst, ist übrigens genau das, das ich jeden Morgen schlucke: Thyroxin (T4). Der Regelkreis, der bei Menschen mit Hashimoto-Thyreoiditis wegen der allmählichen autoimmunen Zerstörung der Schilddrüse entgleist, existiert schon bei den Amphibien.
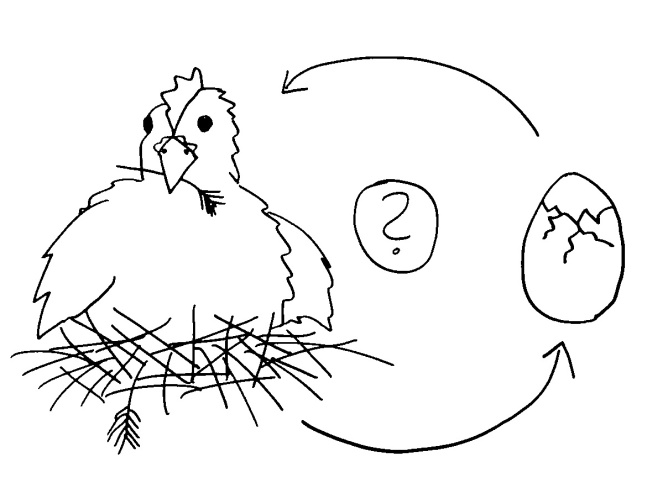
 Noch eine Skizze fürs Buch. Der niederländische Verhaltensforscher Nikolaas Tinbergen (1907-1988) vertrat den Standpunkt, eine biologische Erklärung müsse vier Fragen beantworten, um vollständig zu sein:
Noch eine Skizze fürs Buch. Der niederländische Verhaltensforscher Nikolaas Tinbergen (1907-1988) vertrat den Standpunkt, eine biologische Erklärung müsse vier Fragen beantworten, um vollständig zu sein: