Vor dem Hintergrund des Schutzes vor Autoimmunerkrankungen und Asthma, den verschiedene parasitische Würmer vor allem bei Infektionen während der Kindheit zu vermitteln scheinen, fand ich das ernüchternde Ergebnis dieses Cochrane-Reviews interessant:
David C. Taylor-Robinson et al.: Deworming drugs for soil-transmitted intestinal worms in children: effects on nutritional indicators, haemoglobin and school performance. The Cochrane Library, 11. Juli 2012, DOI: 10.1002/14651858.CD000371.pub4
(Berichte/Kommentare dazu hier und hier)
Übersetzung der allgemeinverständlichen Zusammenfassung:
„Die wichtigsten über Böden übertragenen Würmer sind Fadenwürmer, Hakenwürmer und Peitschenwürmer. In den Tropen und Subtropen sind sie vor allem in Kindern aus armen Gegenden mit schlechter/fehlender Kanalisation, hoher Bevölkerungsdichte, schlechter Bildung und schlechtem Zugang zum Gesundheitswesen weit verbreitet. Die Infektionen verursachen bei Kindern manchmal Unterernährung, Wachstumsstörungen und Anämie, und einige Experten glauben, sie würden auch die schulische Leistung beeinträchtigen. Neben Verbesserungen der Kanalisation und der Hygiene werden auch Medikamente gegen Würmer eingesetzt.
Ein Ansatz besteht darin, nur diejenigen Individuen zu behandeln, die sich bei Massentests als infiziert erwiesen haben. Indizien deuten darauf hin, dass dies das Gewicht und evtl. auch die Hämoglobinwerte verbessert, aber die Belegbasis ist klein. Bei einem anderen, derzeit von der WHO empfohlenen und viel besser untersuchten Ansatz werden alle Schulkinder mit Wurmmitteln behandelt.
Nach Untersuchungen nach einer einzelnen Wurmmittelgabe oder nach mehreren Dosen bleibt ungewiss, ob solche Programme Ernährungsindikatoren wie Gewicht oder Körpergröße, die kognitiven Fähigkeiten, die Unterrichtsteilnahme oder die schulischen Leistungen positiv beeinflussen. Es sieht so aus, als hätten sie keine Auswirkung auf den Hämoglobingehalt des Blutes. Einer Untersuchung an einer Million Schulkindern, bei der Todesfälle untersucht wurden, wurde bereits 2005 abgeschlossen, aber die Forscher haben ihre Ergebnisse noch nicht veröffentlicht.“
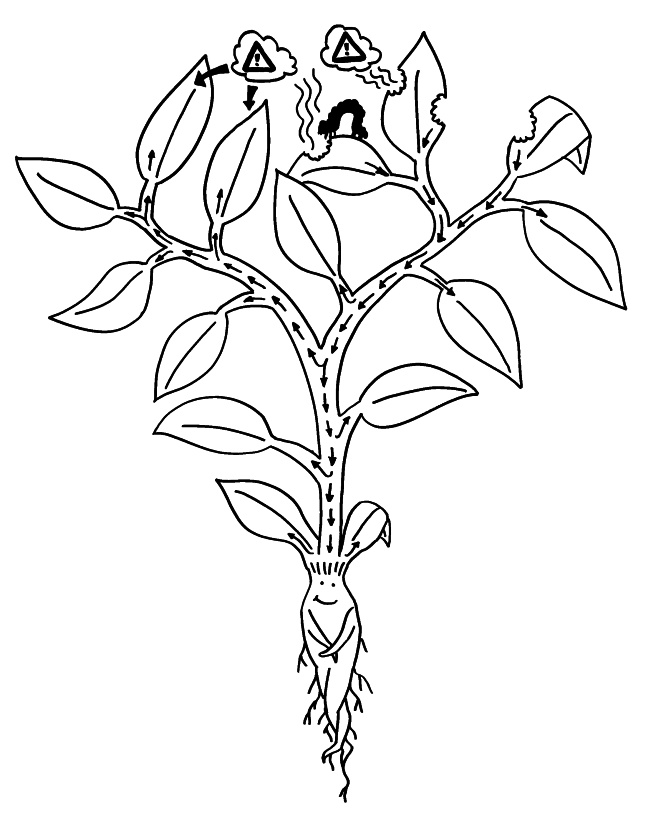 Pflanzen enthalten keine frei beweglichen Immunzellen, sondern müssen die Abwehr von Pathogenen und Fressfeinden lokal organisieren. Bei einem lokalen Angriff steht zu erwarten, dass als nächstes ein Blatt ganz in der Nähe des bereits befallenen oder angenagten Gewebes angegriffen wird. Botenstoffe, die über die Leitbündel transportiert würden, wären u. U. sehr lange unterwegs und würden zu stark verdünnt. Daher setzen Pflanzen auf flüchtige Warnstoffe, die über den kürzeren Luftweg ans Ziel gelangen und dort prophylaktisch die Abwehr ankurbeln (Priming).
Pflanzen enthalten keine frei beweglichen Immunzellen, sondern müssen die Abwehr von Pathogenen und Fressfeinden lokal organisieren. Bei einem lokalen Angriff steht zu erwarten, dass als nächstes ein Blatt ganz in der Nähe des bereits befallenen oder angenagten Gewebes angegriffen wird. Botenstoffe, die über die Leitbündel transportiert würden, wären u. U. sehr lange unterwegs und würden zu stark verdünnt. Daher setzen Pflanzen auf flüchtige Warnstoffe, die über den kürzeren Luftweg ans Ziel gelangen und dort prophylaktisch die Abwehr ankurbeln (Priming).