In der vergangenen Woche wurde unter anderem bei Spiegel Online über eine neue Aids-ähnliche Immunschwäche berichtet, die vor allem bei älteren Erwachsenen aus Thailand und Taiwan auftritt und nicht durch HIV-Viren ausgelöst wird, sondern durch Autoantikörper gegen das Zytokin Gamma-Interferon (IFN-γ).
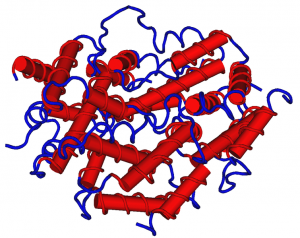
Der Fachartikel ist nicht frei zugänglich, würde mir für mein Buch aber auch nicht weiterhelfen, da die Mechanismen, die zu der Autoimmunreaktion führern, noch völlig unklar sind. Aus dem Abstract geht hervor, dass 88 Prozent der Betroffenen, bei denen – ähnlich wie bei unbehandelten Aids-Patienten – zahlreiche opportunistische Infektionen auftreten, Autoantikörper im Serum haben, die das körpereigene Gamma-Interferon attackieren und ausschalten. Dieser wichtige Botenstoff wird bei bakteriellen Infektionen von Th1-Zellen ausgeschüttet, sobald sie Kontakt mit einer antigenpräsentierenden Zelle hatten (einem Makrophagen, der Bakterien oder Bakterienteile verschlungen hat). Er aktiviert weitere Makrophagen und löst die Herstellung antibakterieller Peptide aus. Durch seinen Ausfall können die Infektionen nicht richtig bekämpft werden.
Aufgrund der ähnlichen Symptome kann die Erkrankung leicht mit Aids oder mit Tuberkulose verwechselt werden. Da sie nicht familiär gehäuft auftritt, ist sie wohl nicht im engeren Sinne erblich. Warum sie aber bisher nur bei Asiaten nachgewiesen wurde, ist unklar. Wenn ich raten sollte: Vielleicht betreibt irgendein ansonsten harmloser Erreger, der vor allem in Asien auftritt, molekulare Mimikry mit Gamma-Interferon als „Vorlage“, sodass unsere gegen den Erreger gerichteten Antikörper bei entsprechender genetischer Prädisposition (z. B. bei bestimmten MHC-Varianten, die vielleicht auf Asiaten beschränkt sind) übers Ziel hinausschießen und auch das ähnlich strukturierte Gamma-Interferon angreifen.
Der Fall zeigt, dass Immunschwäche und Autoimmunerkrankungen, obwohl sie gewissermaßen entgegengesetzte Störungen (Unter- und Überreaktionen) des Immunsystems sind, einander nicht ausschließen: Eine Autoimmunreaktion kann, wenn sie sich ausgerechnet gegen eine andere Komponente des Immunsystems richtet, auch zu einer Immunschwäche führen.