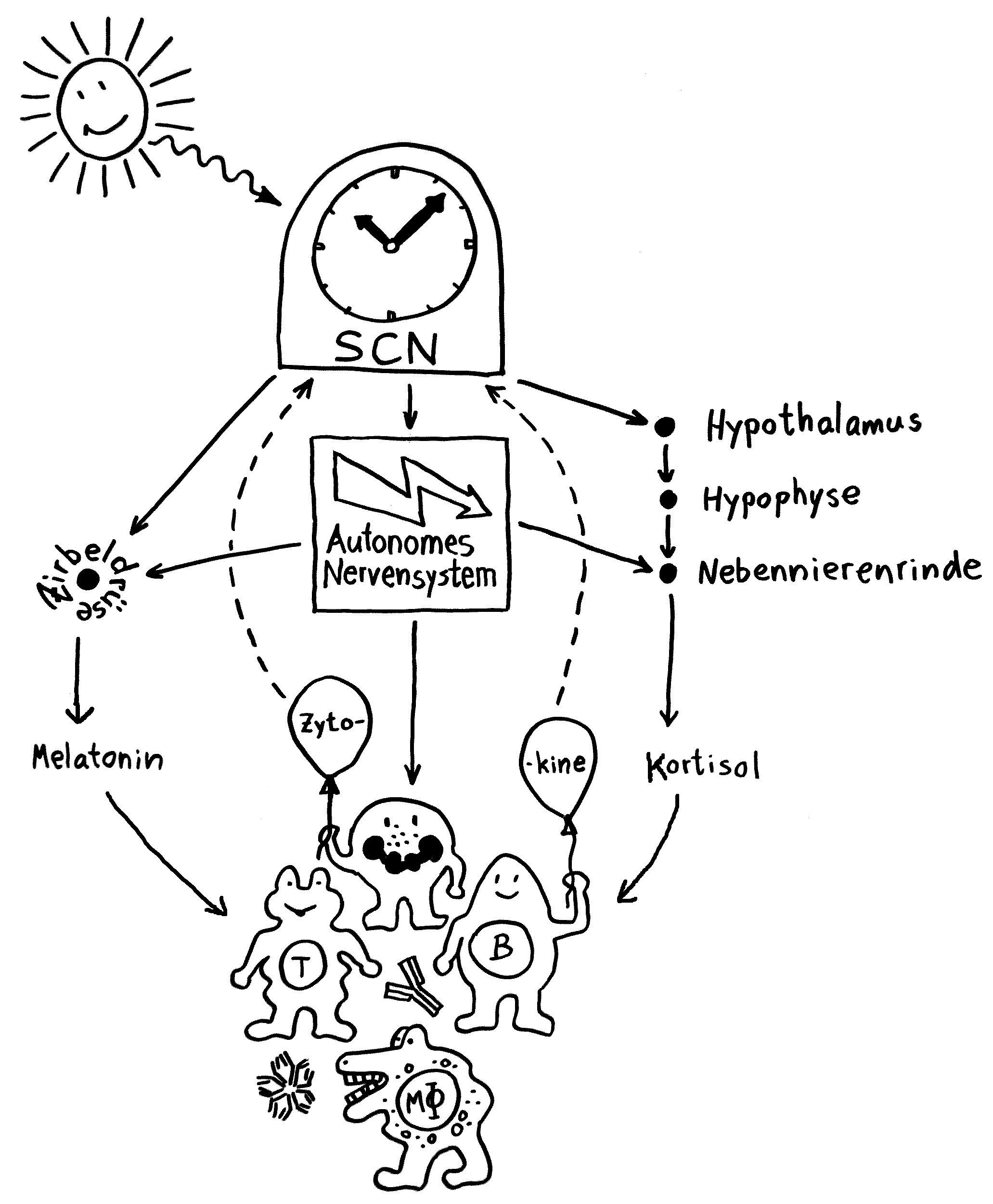
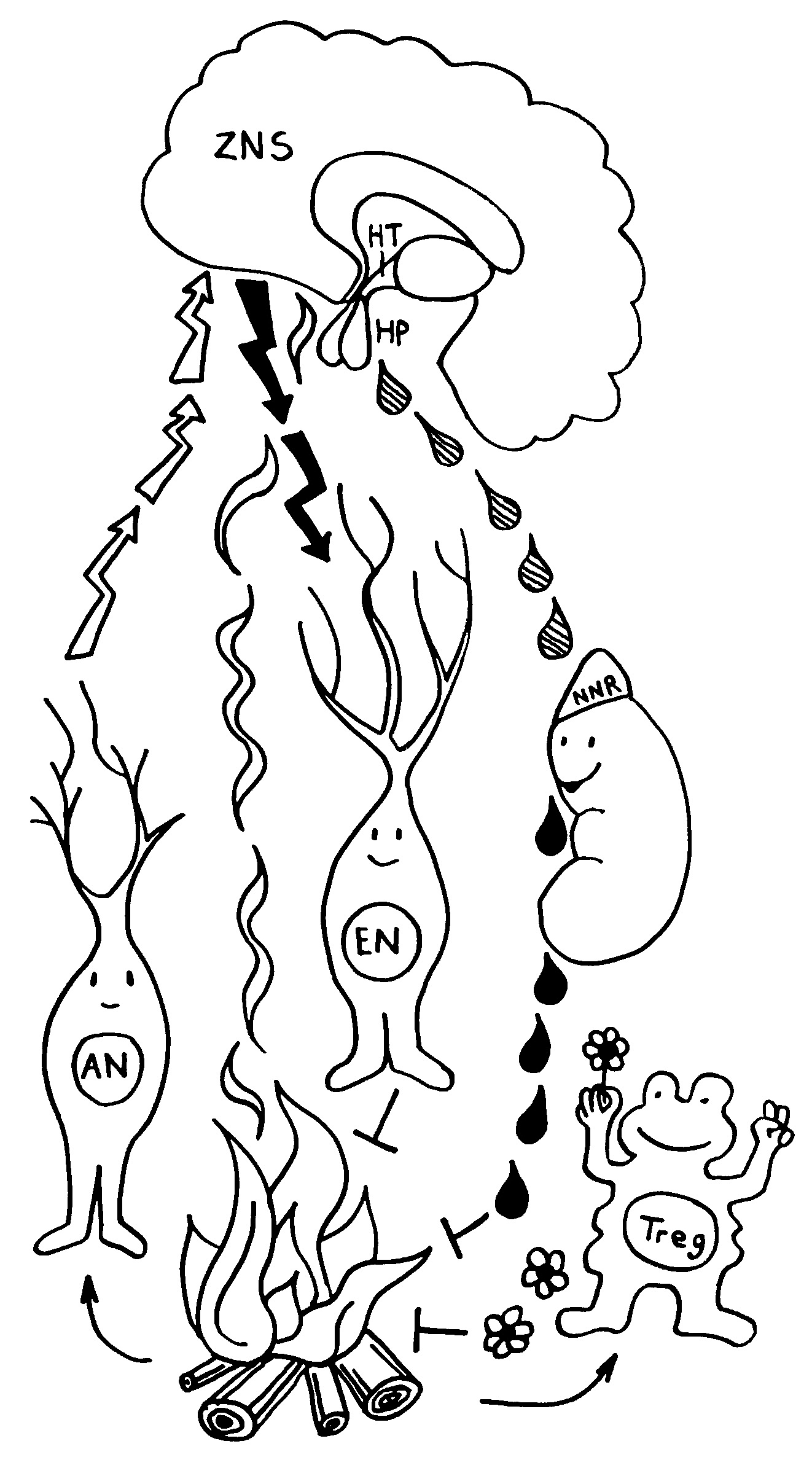
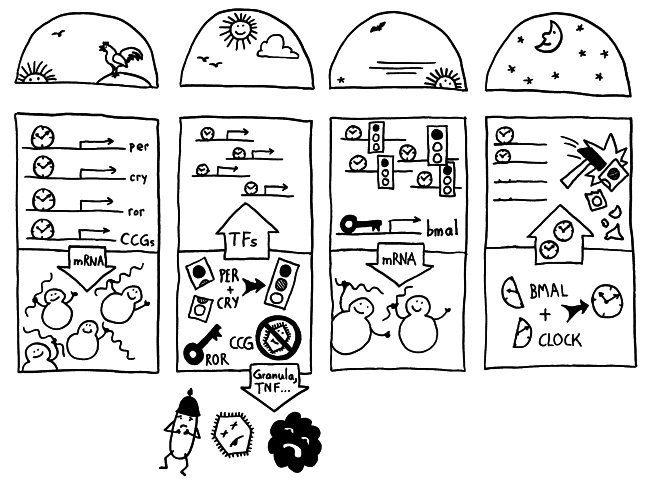
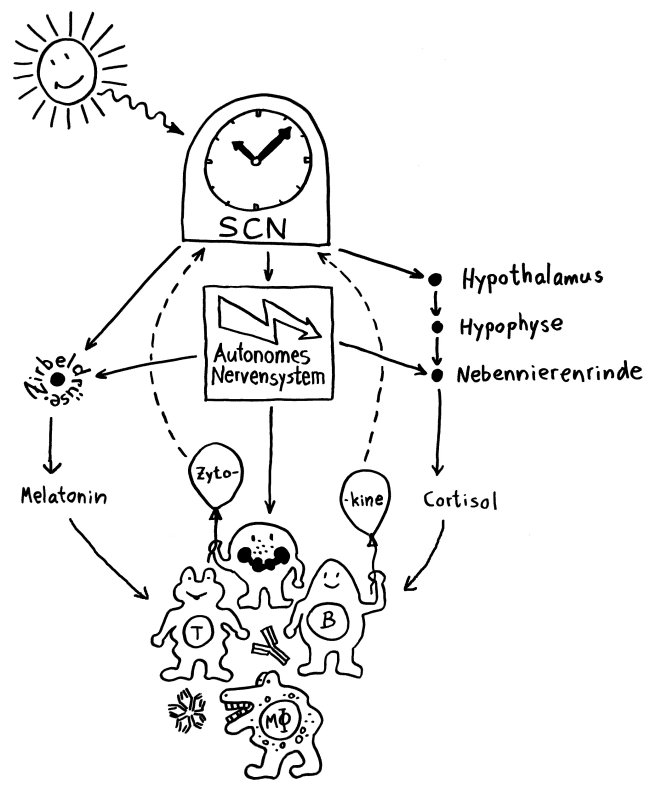
Wenn Tiere oder Menschen krank sind, zeigen sie charakteristische Verhaltensweisen, die zusammen als sickness behaviour bezeichnet werden. Mit Verhalten sind hier keine bewussten Handlungen gemeint, die sich ebenso bewusst unterbinden oder lenken lassen, sondern tief einprogrammierte, körpernahe Phänomene. Hier habe ich sie 2017 vorgestellt – und auch auf den Hypothalamus als beteiligte Hirnregion hingewiesen.
Neben dem Hypothalamus ist auch das Stammhirn an diesen Verhaltensweisen beteiligt, die bei akuten Erkrankungen der Genesung dienen, indem sie möglichst viele Ressourcen an das Immunsystem umleiten – bei chronischen Erkrankungen wie Autoimmunkrankheiten aber vermutlich Fehlsteuerungen darstellen, da beispielsweise Lethargie oder Nahrungsverweigerung auf die Dauer nicht zur Heilung beitragen. Bislang wusste man aber nicht, welche Neuronengruppen im Gehirn dafür verantwortlich sind.
Einem Beitrag in The Scientist entnehme ich, dass eine Forschergruppe um Anoj Ilanges diese Neuronen im Stammhirn von Mäusen mithilfe eines trickreichen mehrschrittigen Versuchs ausfindig gemacht hat. Die Nervenzellgruppen werden kurz als NTS und AP bezeichnet; die nur für Neurolog*innen aussagekräftigen Langnamen erspare ich uns. Einem anderen Team war kürzlich Ähnliches mit Hypothalamus-Neuronen gelungen, die offenbar für die Koordinierung von Fieber, Appetitverlust und das Aufsuchen von Wärme zuständig sind.
Noch ist nicht belegt, was genau diese Verhaltensänderungen im Krankheitsfall auslöst. Aber im Allgemeinen empfängt der NTS Signale vom Vagusnerv, der Informationen aus den inneren Organen übermittelt, während die AP auf humorale (in Flüssigkeit gelöste) Signale reagiert, also etwa Zytokine, die von Immunzellen am Infektionsort in die Blutbahn ausgeschüttet wurden. Die Nervensignale treffen schneller im zentralen Nervensystem ein als die Botenstoffe aus der Blutbahn.
Bestimmte Verhaltensweisen aus dem Komplex sickness behaviour treten auch bei Autoimmunerkrankungen, Krebserkrankungen oder etwa ME/CFS auf, beispielsweise Fatigue – in unterschiedlichen Ausprägungen. Daher lohnt es sich, diese Forschungsrichtung weiter zu verfolgen. In meistens sehr leichter und nur wenige Tage anhaltender Form kann Krankheitsverhalten übrigens auch nach Impfungen auftreten.
Die Originalarbeit ist in Nature erschienen und frei zugänglich: Ilanges et al.: Brainstem ADCYAP1+ neurons control multiple aspects of sickness behaviour