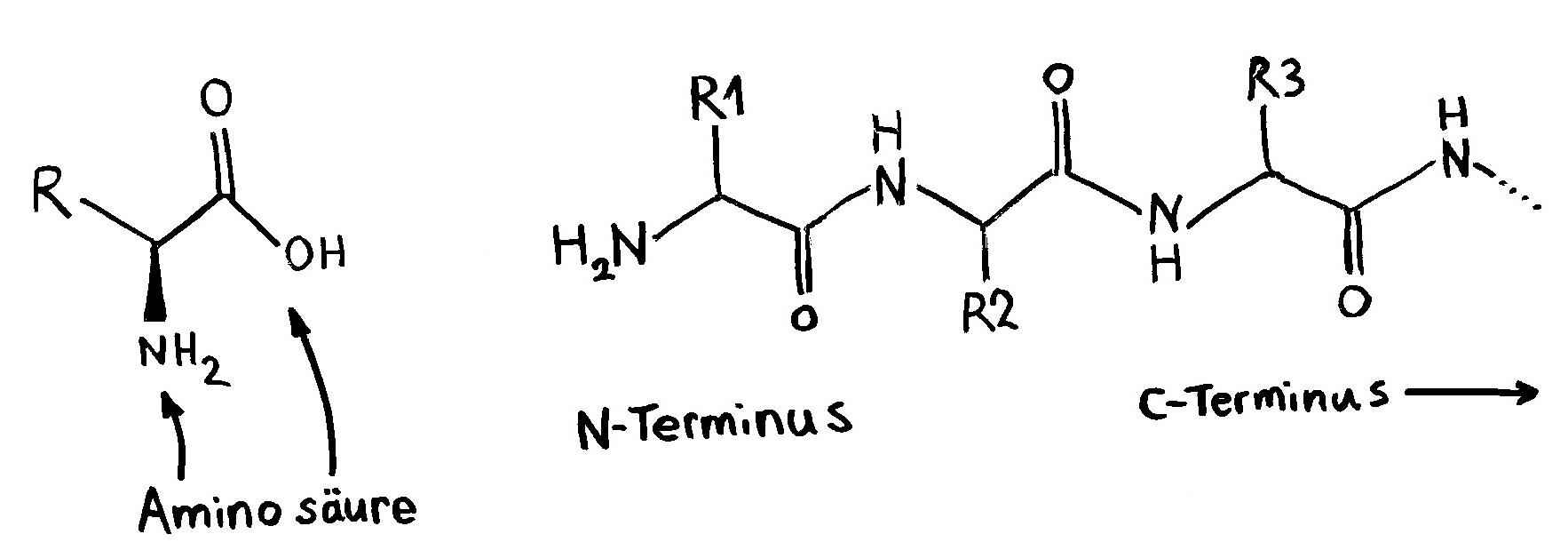
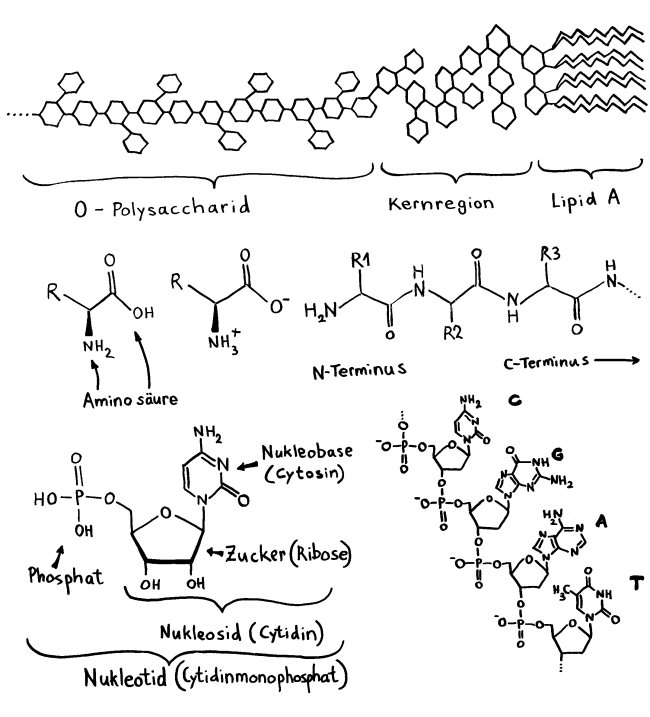
Manche Fachbegriffe fordern Missverständnisse geradezu heraus; „degeneriert“ gehört sicherlich dazu. Gemeint ist, dass das Repertoire der T-Zell-Rezeptoren in jedem einzelnen Menschen zwar groß ist (schätzungsweise 1-100 Millionen unterschiedliche Typen), aber längst nicht ausreicht für eine hochspezifische 1:1-Erkennung jeweils eines Antigen-Peptids durch einen Rezeptortyp. Die Zahl der Peptide, die die antigenpräsentierenden Zellen im Laufe unseres Lebens auf ihren MHC-Molekülen präsentieren können, ist einfach gigantisch. Daher muss ein T-Zell-Rezeptor auf zahlreiche verschiedene Peptid-MHC-Komplexe reagieren können. Und so geht’s:
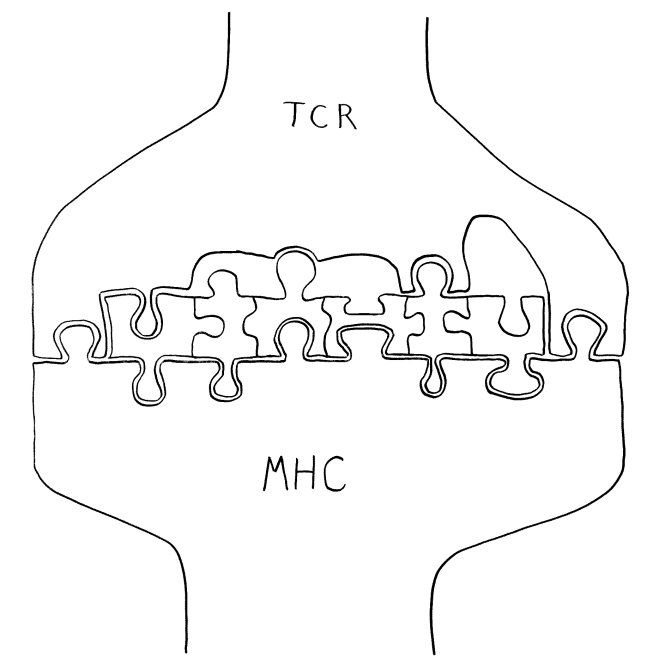
Unten das MHC-Molekül, das als Präsentierteller in der Membran einer antigenpräsentierenden Zelle (etwa einer dendritischen Zelle oder einer B-Zelle) verankert ist. In der Mitte das Peptid, also die Aminosäurenkette, die diese Zelle aus einem aufgenommenen Antigen gewonnen hat und nun vorführt. Und oben der T-Zell-Rezeptor, der in der Membran einer T-Zelle verankert ist. Dieser Rezeptor braucht nur an wenige Stellen – teils an der Oberfläche des MHC-Moleküls, teils an der ihm zugewandten Seite des Peptids – wirklich gut zu binden, um die T-Zelle zu aktivieren. Die Hohlräume zeigen: Welche Aminosäure-Seitenketten ihm an den anderen Stellen entgegengestreckt werden, ist dem Rezeptor egal.
Folglich erkennt eine T-Zelle mit ihrem individuellen Rezeptortyp nicht nur ein Antigen, sondern etliche. Hier sind es zwei Pickelhauben (in meinen Cartoons die typische Kopfbedeckung pathogener Bakterien), aber leider auch ein harmloser Bauhelm – also ein Antigen, das vielleicht von einem Pflanzenpollenkorn, von einem gutartigen Bakterium aus unserem Mikrobiom oder von einer körpereigenen Zelle stammt:
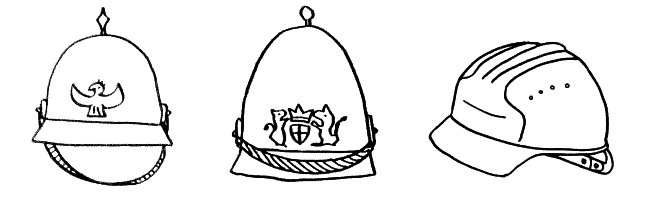
Und hier noch eine „realistischere“ oder zumindest weniger schematische Darstellung der Bindungsstelle eines MHC-Moleküls und des passenden T-Zell-Rezeptors:

Wir blicken aus der Perspektive der T-Zelle auf die Front eines MHC-Moleküls der antigenpräsentierenden Zelle. Die Kontur des darauf präsentierten Antigen-Peptids ist gepunktet. Die sechs „Würmer“ sind die entscheidenden Erkennungsschlaufen an der Front des ansonsten unsichtbaren T-Zell-Rezeptors. Normalerweise binden nur die mittleren zwei oder drei Schlaufen Aminosäuren des Antigen-Peptids, während die äußeren Schlaufen vor allem mit der Oberfläche des MHC-Moleküls Kontakt haben.
Da die mittleren Schlaufen nicht starr, sondern ein wenig verformbar sind, akzeptieren sie unterschiedliche Peptide als Bindungspartner. Ab und zu leider auch solche, die aus Autoantigenen stammen. Und wenn dann noch ein paar Kontrollmechanismen versagen, kommt eine Autoimmunreaktion in Gang.
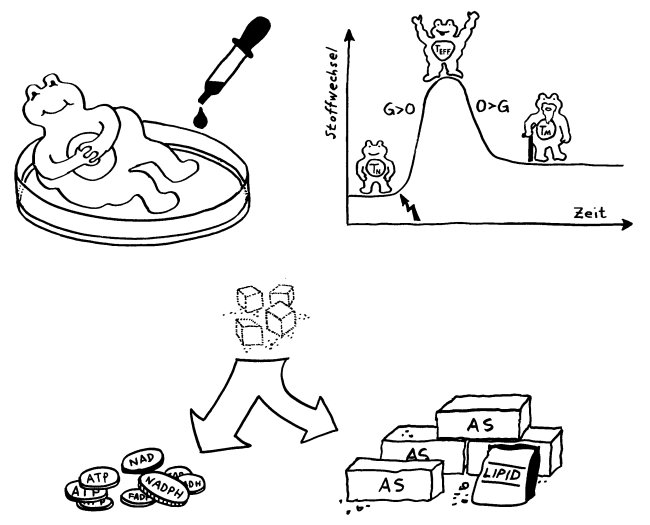
 Action oder Substanz? Eine Immunzelle kann Ressourcen wie Zucker entweder in eine Energiewährung wie ATP oder NADPH umsetzen, die Abwehrreaktionen ermöglicht, oder in Makromolekül-Bausteine wie Aminosäuren (AS), die bei Zellteilungen gebraucht werden.
Action oder Substanz? Eine Immunzelle kann Ressourcen wie Zucker entweder in eine Energiewährung wie ATP oder NADPH umsetzen, die Abwehrreaktionen ermöglicht, oder in Makromolekül-Bausteine wie Aminosäuren (AS), die bei Zellteilungen gebraucht werden.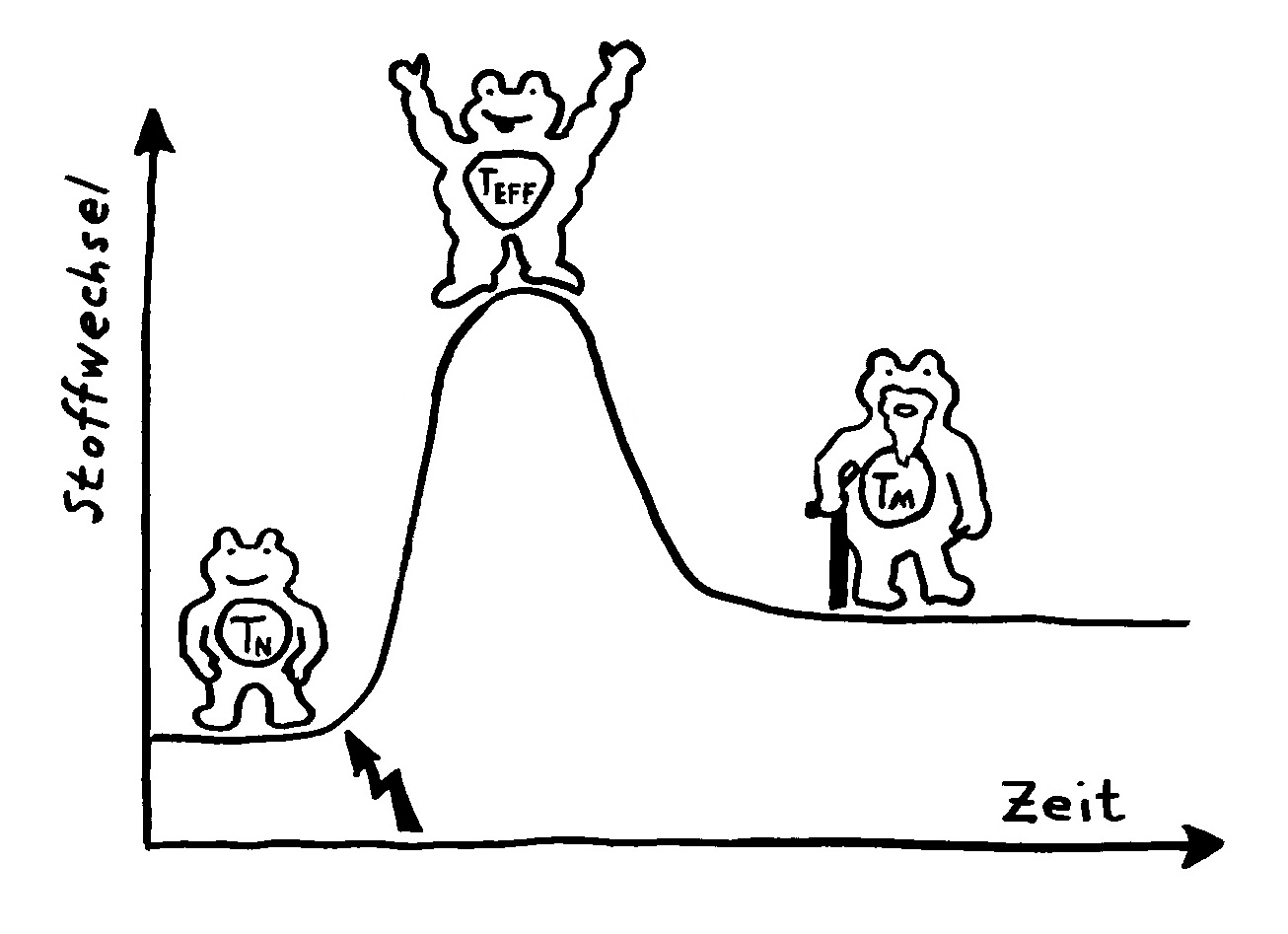 Naive T-Zellen haben einen niedrigen Energieverbrauch. Nach ihrer Aktivierung (Blitz) müssen sie sich rasant vermehren, also Substanz aufbauen. Dabei überwiegt ein Stoffwechselweg namens aerobe Glykolyse, bei dem Glukose abgebaut wird. Während der Abwehrreaktion teilen sie sich nicht mehr, brauchen aber viel Energie für ihre Arbeit. Gedächtniszellen haben wieder einen geringeren Energieverbrauch und bevorzugen denselben gemächlich-effizienten Stoffwechselweg wie die naiven T-Zellen, die sogenannte oxidative Phosphorylierung.
Naive T-Zellen haben einen niedrigen Energieverbrauch. Nach ihrer Aktivierung (Blitz) müssen sie sich rasant vermehren, also Substanz aufbauen. Dabei überwiegt ein Stoffwechselweg namens aerobe Glykolyse, bei dem Glukose abgebaut wird. Während der Abwehrreaktion teilen sie sich nicht mehr, brauchen aber viel Energie für ihre Arbeit. Gedächtniszellen haben wieder einen geringeren Energieverbrauch und bevorzugen denselben gemächlich-effizienten Stoffwechselweg wie die naiven T-Zellen, die sogenannte oxidative Phosphorylierung. In Zellkulturen werden Immunzellen meist so mit Nährstoffen verwöhnt, dass man sich fragen
In Zellkulturen werden Immunzellen meist so mit Nährstoffen verwöhnt, dass man sich fragen