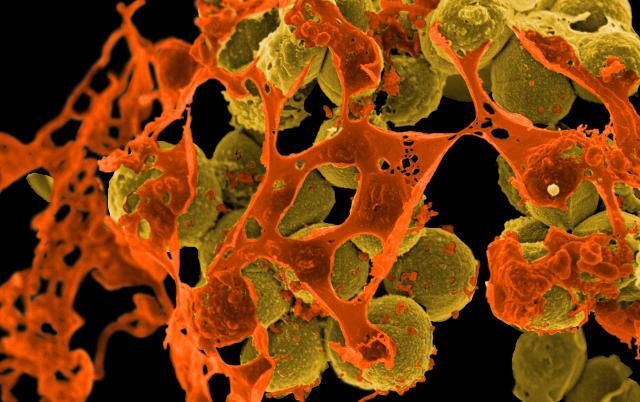
Neulich beschrieb ich das Autoimmunbuchprojekt als „Türme von Hanoi“ mit 500.000 Scheibchen und 200 pulsierenden Stapeln. Das Bild ist natürlich schief, denn „Türme von Hanoi“ ist ein deterministisches Spiel, ein einfacher rekursiver Algorithmus. Mein Projekt verhält sich weniger vorhersagbar: Ständig sortiere ich die Literatur um, spalte ein Unterthema auf, fusioniere welche, werfe andere über Bord, nehme neue hinein … Zu Beginn hatte ich mir etwa vorgenommen, Krebs komplett auszuklammern, um nicht noch ein großes Fass aufzumachen. Aber manchmal werfen neue Erkenntnisse unsere Pläne über den Haufen: Tumoren haben so viel mit dem Immunsystem und wohl auch mit Autoimmunreaktionen zu tun, dass ich sie nicht ignorieren kann.
Zu allem Unglück werden nicht nur Autoimmunerkrankungen, sondern auch Krebserkrankungen und Krebstherapien vom Mikrobiom beeinflusst – und wirken umgekehrt auf dieses ein. Die boomende Mikrobiomforschung treibt mich ohnehin in den Wahnsinn, weil all die Einflüsse, Abhängigkeiten, Synergien und Hemmnisse zwischen unseren zahlreichen mikrobiellen Mitbewohnern, unserem Immunsystem, unserem Erbgut, dem Rest unseres Körpers und unserer Umwelt unglaublich schlecht in der linearen Erzählstruktur eines Sachbuchs abzubilden sind.
Bevor aber die drei Arbeiten, die ich gerade gelesen habe, vor lauter Zögern und Hadern Staub ansetzen, zerschlage ich den gordischen Knoten und versuche die wichtigsten Erkenntnisse aus der aktuellen Forschung festzuhalten – ganz gleich, wo im Buch sie letzten Endes landen.
Mit Magenkrebs fing es an
Seit J. Robin Warren und Barry J. Marshall Ende der 1970er entdeckten, dass Gastritis, Magengeschwüre und im worst case auch Magenkrebs oft auf das Magenbakterium Helicobacter pylori zurückgehen, ist klar, dass Pathogene in ihrer Umgebung Krebs auslösen oder fördern können. Das gilt auch für andere Teile des Verdauungstrakts: Mäuse entwickeln eher Darmkrebs, wenn man in ihrer Darmflora die Bakterien Citrobacter rodentium oder Helicobacter hepaticus ansiedelt. Und Menschen mit Darmkrebs haben eine anderes zusammengesetzte Darmflora als Gesunde, etwa einen Überschuss der normalerweise in der Mundhöhle anzutreffenden Gattungen Fusobacterium und Porphyromonas. Ein Forscherteam konnte 2014 aus der relativen Häufigkeit von 22 Bakterienarten im Stuhl von Versuchsteilnehmern sogar ablesen, ob sie Darmkrebs hatten oder nicht.
Henne oder Ei?
Aber was kommt zuerst, der Krebs oder die Veränderung der Darmflora? Im Tierversuch ließ sich das klären: Man behandelte Mäuse zunächst mit Antibiotika, um die Mikrobiom-Zusammensetzung zu verändern, und verabreichte ihnen dann ein Karzinogen sowie eine entzündungsfördernde Substanz. Im Vergleich zu Mäusen, die keine Antibiotika erhalten hatten, entwickelten sie weniger und zudem kleinere Tumoren. Die meisten Tumoren bildeten keimfrei aufgezogene Mäuse aus, denen man die Darmflora bereits krebskranker Mäuse verabreichte.
Eine solche lokal krebsfördernde Wirkung bestimmter Komponenten der Darmflora kann beispielsweise durch eine von den Bakterien ausgelöste Entzündung der Darmschleimhaut vermittelt werden, die zu einer Freisetzung von reaktiven Sauerstoffspezies (ROS) und Wachstumsfaktoren aus den angeschlagenen Schleimhautzellen führt. Die ROS können das Erbgut anderer Zellen in der Nähe mutieren lassen, sodass sie zu „Tumorkeimen“ werden, und die Wachstumsfaktoren können eine übermäßige Zellteilung und die Bildung neuer Blutgefäße fördern, die die entstehenden Tumoren mit Nährstoffen versorgen.
Fernwirkungen
Dass Veränderungen im Darm (etwa eine Dysbiose) weitere Veränderungen im Darm (etwa die Bildung von Tumoren) nach sich ziehen können, ist nicht unbedingt überraschend. Seit einigen Jahren zeichnet sich aber ab, dass es auch Fernwirkungen gibt: Die Darmflora beeinflusst das Krebsrisiko in weit entfernten Organen. Teils verringert, teils erhöht sie die Gefahr, dass sich dort Tumoren bilden.
So entwickelten Mäuse nach der Infektion mit Helicobacter hepaticus nicht nur Darmkrebs, sondern auch Brustkrebs oder Prostatakrebs. Und die Melanome, die man Mäusen des Zuchtstamms „Black 6“ in die Haut implantierte, entwickelten sich je nach dem Zuchtlabor, aus dem die Tiere stammten, ganz unterschiedlich – weil sich ihre Mikrobiome unterschieden. Sobald man sie eine Weile im selben Käfig hielt, verschwanden die Unterschiede in der Fähigkeit des Immunsystems, die Melanome in Schach zu halten.
Die krebshemmende Wirkung ging von Bakterien der Gattung Bifidobacterium aus, die offenbar dendritische Zellen aktivieren. Diese wiederum präsentierten T-Zellen Antigene aus den Bakterien oder aus den Krebszellen und befähigten sie so, die Krebszellen aufzusuchen und zu töten. Diese Aktivierung ist nötig, weil viele Krebszellen an ihrer Oberfläche molekulare „Self“-Signale präsentieren, um das Immunsystem von Attacken abzuhalten.
Bakterien beeinflussen den Therapieerfolg
Doch nicht nur die natürliche Fähigkeit des Immunsystems, Krebsvorstufen und Tumoren zu bekämpfen, wird durch die Darmflora gefördert oder behindert: Chemotherapien und andere Krebstherapien verlaufen je nach Zusammensetzung des Mikrobioms mehr oder weniger erfolgreich. Auch dies wurde zunächst an Mäusen entdeckt, und zwar etwa zeitgleich von den Arbeitsgruppen um Romina Goldszmid und Giorgio Trinchieri am amerikanischen National Cancer Institute und um Laurence Zitvogel am französischen INSERM: Keimfrei aufgezogene oder mit Antibiotika behandelte Tiere, die entweder eine angeborene Neigung zu Lungenkrebs hatten oder verschiedenartige Tumoren implantiert bekamen, sprachen auf Chemotherapien schlechter an als Artgenossen mit intakter Darmflora.
Die Mechanismen setzen offenbar teils an der angeborenen, unspezifischen und teils an der erworbenen, antigenspezifischen Abwehr an:
- Platin-Chemotherapien und Immuntherapien mit CpG-Oligonukleotiden bekämpfen Krebs, indem sie Entzündungen fördern. Ein Übermaß entzündungshemmender Bakterien kann dem in die Quere kommen.
- In anderen Fällen will man eine Entzündung gerade vermeiden. Ein Probiotikum (also eine Bakterienmischung) namens Prohep brachte etwa Lebertumoren in Mäusen zum Schrumpfen, wohl weil es Entzündungen im Darm hemmt.
- Monoklonale Antikörper binden als sogenannte Checkpoint-Inhibitoren an bestimmte Proteine auf der Oberfläche von Krebszellen, etwa PD-L1 oder CTLA-4, die sonst an passende Rezeptoren auf aktivierten T-Zellen andocken und die T-Zellen durch Vortäuschung eines gutartigen Charakters friedlich stimmen. Bestimmte Bakterien (bei Mäusen etwa Bifidobacteria oder Bacteroides) verstärken diese Form der Krebsbekämpfung – zum Teil indirekt durch ihre Wirkung auf die angeborene Abwehr und zum Teil direkt, indem sie dieselben T-Zell-Rezeptoren stimulieren.
- Eine Chemotherapie mit Cyclophosphamid macht die Darmschleimhaut durchlässig, sodass Bakterien die Barriere überwinden und sich im Lymphgewebe des Darms ansammeln. Dies gelingt nur Arten, die nicht im Darmlumen, sondern in der zähen Schleimschicht direkt über der Schleimhaut angesiedelt sind, etwa Lactobacillus johnsonii, nicht aber Escherichia coli. In den Lymphknoten und der Milz fördern sie die Bildung von T-Helferzellen des Typs 1 (Th1) und des Typs 17 (Th17), die dann zum Tumor wandern und dort Krebszellen abtöten.
Nützliche Autoimmunität – gefährliche Hygiene?
Nach Ansicht von Laurence Zitvogel und anderen Forschern kann man solche vom Mikrobiom beeinflussten Anti-Tumor-Aktivitäten unseres Immunsystems als nützliche Form der Autoimmunität auffassen. Unsere Abwehrzellen greifen schließlich die gefährlichen, aber körpereigenen Wucherungen an, weil sie ihre Toleranz gegen die sich harmlos gebenden Krebszellen abgelegt haben – und zwar aufgrund der teils antigenspezifischen, teils unspezifischen Stimulation durch Bestandteile von Bakterien. Was bei Autoimmunerkrankungen zu ernsten, teils lebensbedrohlichen Angriffen auf normales Gewebe führt, wäre bei der Bekämpfung von Krebs und Krebsvorstufen demnach lebensnotwendig: die Kreuzreaktivität von Immunzellen, die sowohl auf Bakterienbestandteile als auch auf ähnlich aufgebaute Marker an der Oberfläche körpereigener Zellen anspringen.
Und so, wie man sich die Zunahme von Autoimmunerkrankungen und Allergien zum Teil durch eine Verarmung unseres Mikrobioms und die daraus folgende Unterstimulation unseres Immunsystems erklären kann, so lässt sich auch eine „Krebs-Hygiene-Hypothese“ formulieren: Zumindest einige Krebsarten wie chronische lymphatische Leukämie (CLL) oder das Hodgkin-Lymphom treten häufiger bei Menschen auf, die als Kinder selten Infektionen hatten oder in sogenannten guten Verhältnissen aufwuchsen, die im Allgemeinen mit einer besseren Hygiene korrelieren.
Und dann noch die Gene …
Wie eingangs erwähnt, wird die Sache durch weitere Wechselwirkungen unübersichtlich. So wird der Einfluss des Mikrobioms auf Krebs und Krebstherapien seinerseits durch unser Erbgut beeinflusst. Bestimmte Mutationen im Gen für einen Rezeptor der angeborenen Abwehr, TLR5, verhindern eine starke Reaktion der Immunzellen auf das weit verbreitete Bakterienprotein Flagellin. Brustkrebs-Patientinnen, die außer einer Mutation im Estrogenrezeptor auch diese TLR5-Genvariante aufweisen, haben besonders schlechte Prognosen. Bei Eierstock-Krebs hingegen haben Trägerinnen derselben Mutation eine höhere Überlebenswahrscheinlichkeit als Frauen ohne die Mutation.
An Mäusen fand man heraus, dass diese Mutation Zytokinkonzentrationen verändert: Mit ihr produzieren unsere Zellen weniger Interleukin 6, aber mehr Interleukin 17 als mit der Standard-Genvariante – allerdings nur, wenn sie mit einem Mikrobiom konfrontiert werden: In keimfrei aufgezogenen Mäuse mit oder ohne die Mutation schreitet der Krebs gleich schnell voran.
Zurück auf Los: Was ist überhaupt Krebs?
Auch die nächsten Blogbeiträge werden sich um Krebs drehen. Im nächsten Artikel stelle ich die vermeintlich banale Frage, was Krebs überhaupt ist, und beantworte sie anhand des unverwüstlichen Leitspruchs von Theodosius Dobzhansky: „Nichts in der Biologie hat einen Sinn außer im Lichte der Evolution.“ Und im übernächsten Artikel dringe ich zur eigentlichen Schnittmenge mit dem Thema meines Buches vor: Lassen sich Autoimmunerkrankungen als aus dem Ruder gelaufene Krebsabwehr verstehen – und was wäre damit gewonnen?
Literatur
Kate Yandell: Microbes Meet Cancer. The Scientist Magazine, 1. April 2016 – wissenschaftsjournalistische Zusammenfassung mit guter Grafik
Laurence Zitvogel et al.: Microbiome and Anticancer Immunosurveillance. Cell 165, 7. April 2016 – gute Übersichtsarbeit, ebenfalls gut illustriert
S. Viaud et al.: Gut microbiome and anticancer immune response: really hot Sh*t! Cell Death and Differentiation 22, 2015 – mit Details überfrachtete, nicht sehr sorgfältig durchgearbeitete und anstrengend zu lesende Übersichtsarbeit mit wirrer Grafik