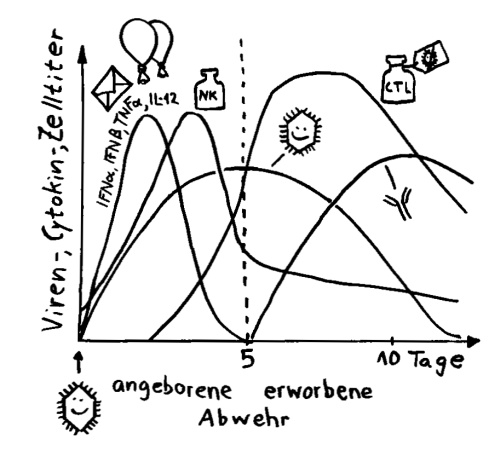
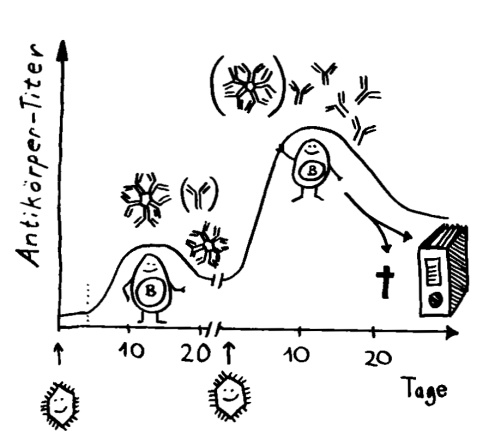
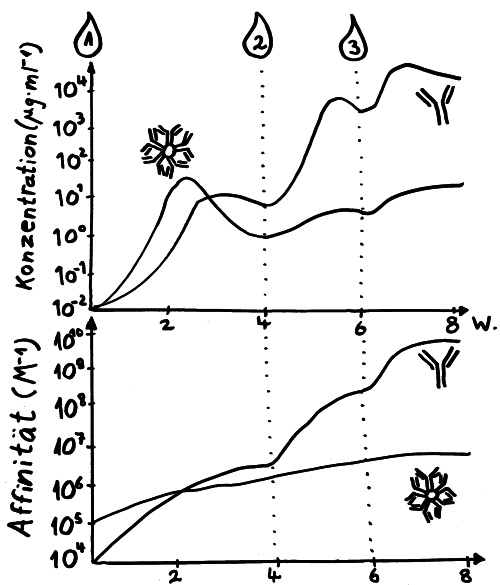
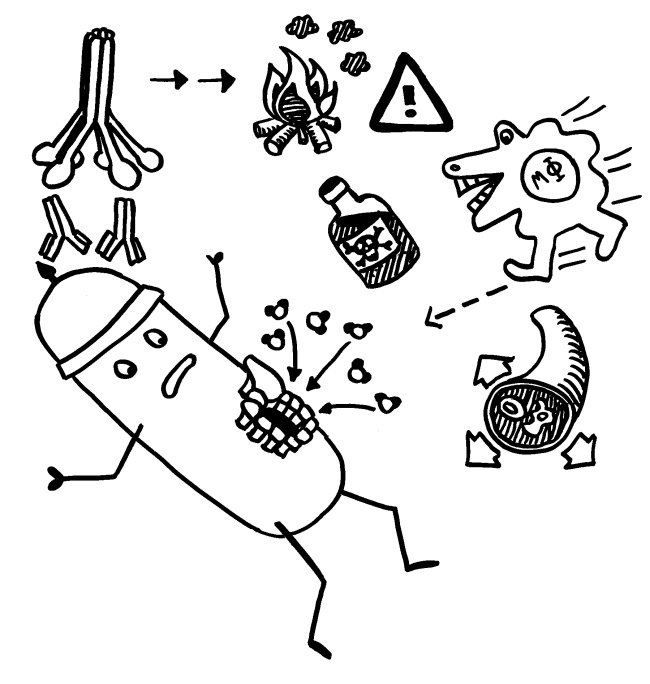
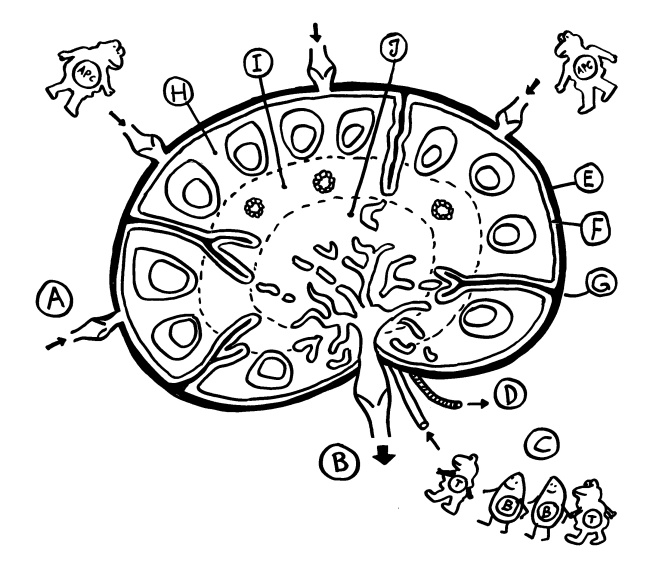
Zwei Skizzen für den dritten Teil des Autoimmunbuchs, in dem ich die Evolution des Immunsystems erläutere. Bis vor wenigen Jahren hielt man die erworbene Immunabwehr für etwas Wirbeltierspezifisches. Inzwischen weiß man, dass auch Bakterien eine erworbene (und darüber hinaus erbliche) Immunabwehr haben: das CRISPR/Cas-System.*
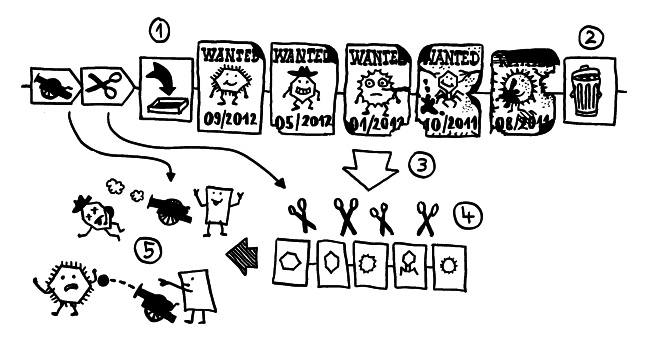 Der entsprechende Abschnitt der Bakterien-DNA beginnt mit einigen Cas-Genen, hier vereinfacht durch zwei Pfeile mit einer Kanone und einer Schere dargestellt. Es folgt eine Erkennungssequenz, die den Anfang des CRISPR-Sektors markiert, hier als Posteingang symbolisiert. Unmittelbar hinter diesem sogenannten CRISPR-Leader werden DNA-Abschnitte aus Bakterienviren (Phagen) oder parasitären Plasmiden eingebaut, die das Bakterium infiziert haben – sogenannte Spacer (1). Sie werden von charakterisitischen, immer gleichen Repeats flankiert, die hier nicht abgebildet sind. Sammelt ein Bakterium zu viele Spacer an, kann es am hinteren Ende (also an der „Mülltonne“) alte Erinnerungen an sehr lang zurückliegende Infektionen entsorgen, damit sein Erbgut nicht zu umfangreich wird (2). Es handelt sich also um einen FIFO-Speicher (first in, first out). Die gesamte Sequenz wird zu einer einzigen Prä-crRNA transkribiert (3), die dann von Cas-Genprodukten in crRNAs zerlegt wird, die jeweils die Erinnerung an ein Infektionsereignis enthalten (4). Befällt derselbe Parasit die Bakterienzelle noch einmal, so lenkt die entsprechende crRNA den Abwehrkomplex (die Kanone) auf ihr spezifisches Ziel, woraufhin die DNA oder RNA des Parasiten auf noch nicht ganz verstandene Weise inaktiviert und abgebaut wird (5). Und was hat das mit Autoimmunerkrankungen zu tun? Weiterlesen →
Der entsprechende Abschnitt der Bakterien-DNA beginnt mit einigen Cas-Genen, hier vereinfacht durch zwei Pfeile mit einer Kanone und einer Schere dargestellt. Es folgt eine Erkennungssequenz, die den Anfang des CRISPR-Sektors markiert, hier als Posteingang symbolisiert. Unmittelbar hinter diesem sogenannten CRISPR-Leader werden DNA-Abschnitte aus Bakterienviren (Phagen) oder parasitären Plasmiden eingebaut, die das Bakterium infiziert haben – sogenannte Spacer (1). Sie werden von charakterisitischen, immer gleichen Repeats flankiert, die hier nicht abgebildet sind. Sammelt ein Bakterium zu viele Spacer an, kann es am hinteren Ende (also an der „Mülltonne“) alte Erinnerungen an sehr lang zurückliegende Infektionen entsorgen, damit sein Erbgut nicht zu umfangreich wird (2). Es handelt sich also um einen FIFO-Speicher (first in, first out). Die gesamte Sequenz wird zu einer einzigen Prä-crRNA transkribiert (3), die dann von Cas-Genprodukten in crRNAs zerlegt wird, die jeweils die Erinnerung an ein Infektionsereignis enthalten (4). Befällt derselbe Parasit die Bakterienzelle noch einmal, so lenkt die entsprechende crRNA den Abwehrkomplex (die Kanone) auf ihr spezifisches Ziel, woraufhin die DNA oder RNA des Parasiten auf noch nicht ganz verstandene Weise inaktiviert und abgebaut wird (5). Und was hat das mit Autoimmunerkrankungen zu tun? Weiterlesen →
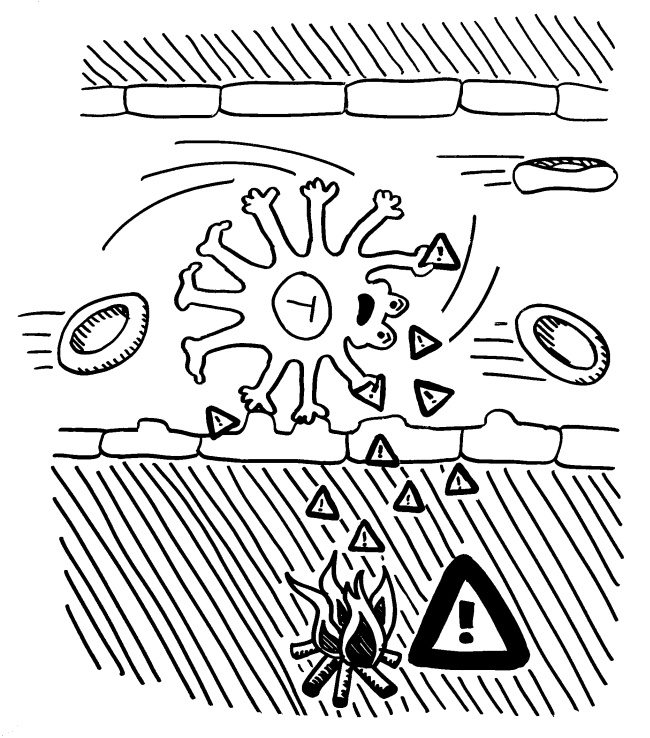
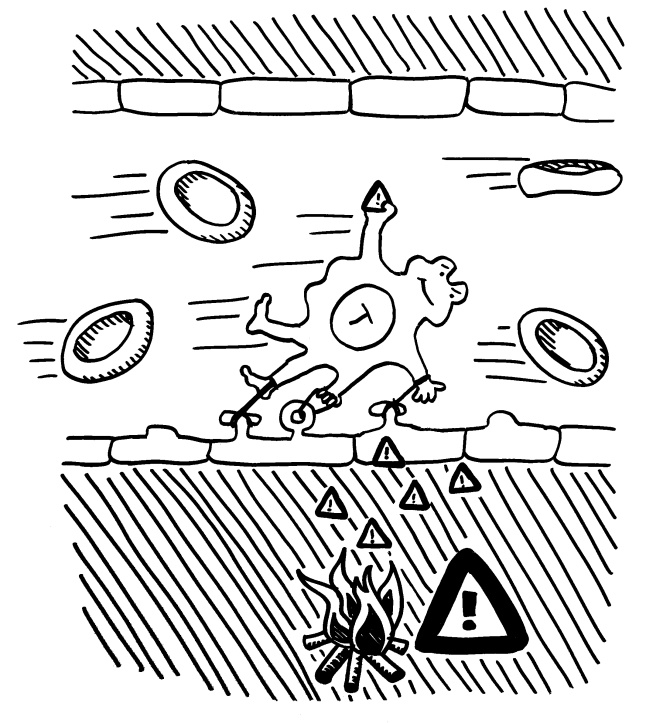
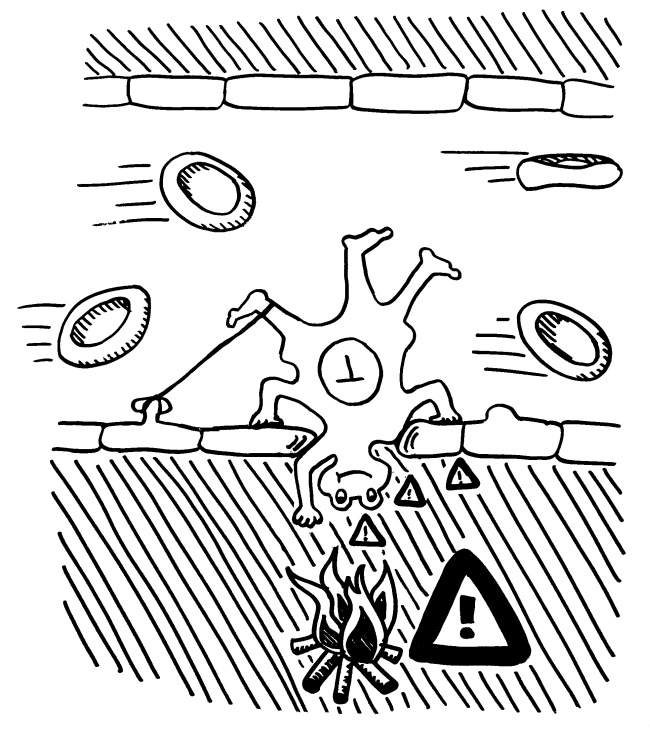
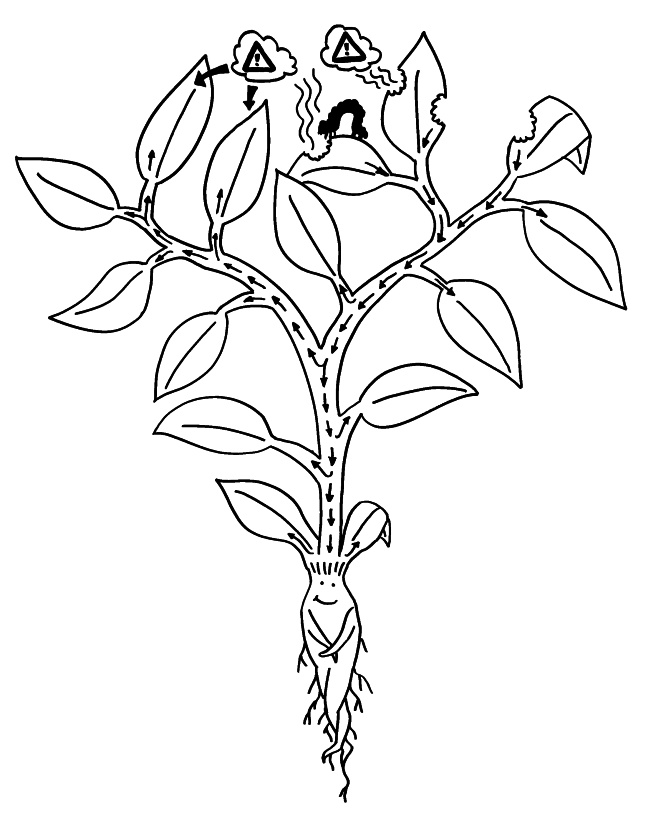 Pflanzen enthalten keine frei beweglichen Immunzellen, sondern müssen die Abwehr von Pathogenen und Fressfeinden lokal organisieren. Bei einem lokalen Angriff steht zu erwarten, dass als nächstes ein Blatt ganz in der Nähe des bereits befallenen oder angenagten Gewebes angegriffen wird. Botenstoffe, die über die Leitbündel transportiert würden, wären u. U. sehr lange unterwegs und würden zu stark verdünnt. Daher setzen Pflanzen auf flüchtige Warnstoffe, die über den kürzeren Luftweg ans Ziel gelangen und dort prophylaktisch die Abwehr ankurbeln (Priming).
Pflanzen enthalten keine frei beweglichen Immunzellen, sondern müssen die Abwehr von Pathogenen und Fressfeinden lokal organisieren. Bei einem lokalen Angriff steht zu erwarten, dass als nächstes ein Blatt ganz in der Nähe des bereits befallenen oder angenagten Gewebes angegriffen wird. Botenstoffe, die über die Leitbündel transportiert würden, wären u. U. sehr lange unterwegs und würden zu stark verdünnt. Daher setzen Pflanzen auf flüchtige Warnstoffe, die über den kürzeren Luftweg ans Ziel gelangen und dort prophylaktisch die Abwehr ankurbeln (Priming).