Bevor die Tab-Leiste des Browsers explodiert und meine Bookmarks wegen Nichtbeachtung Harakiri begehen, notiere ich hier in aller Eile ein paar Stichworte zu aktueller (na ja, fast aktueller) Mikrobiom-Literatur.
Bevor die Tab-Leiste des Browsers explodiert und meine Bookmarks wegen Nichtbeachtung Harakiri begehen, notiere ich hier in aller Eile ein paar Stichworte zu aktueller (na ja, fast aktueller) Mikrobiom-Literatur.
Und damit die Männerquote bei den Wissenschaftler-Porträts im Buch nicht weiter bei traurigen 100 Prozent liegt, habe ich Lynn Margulis in die Galerie aufgenommen – jene 2011 verstorbene US-amerikanische Biologin, die für symbiotische Organismen (also z. B. Mensch + Mikrobiom) den Begriff „Holobionten“ geprägt hat.
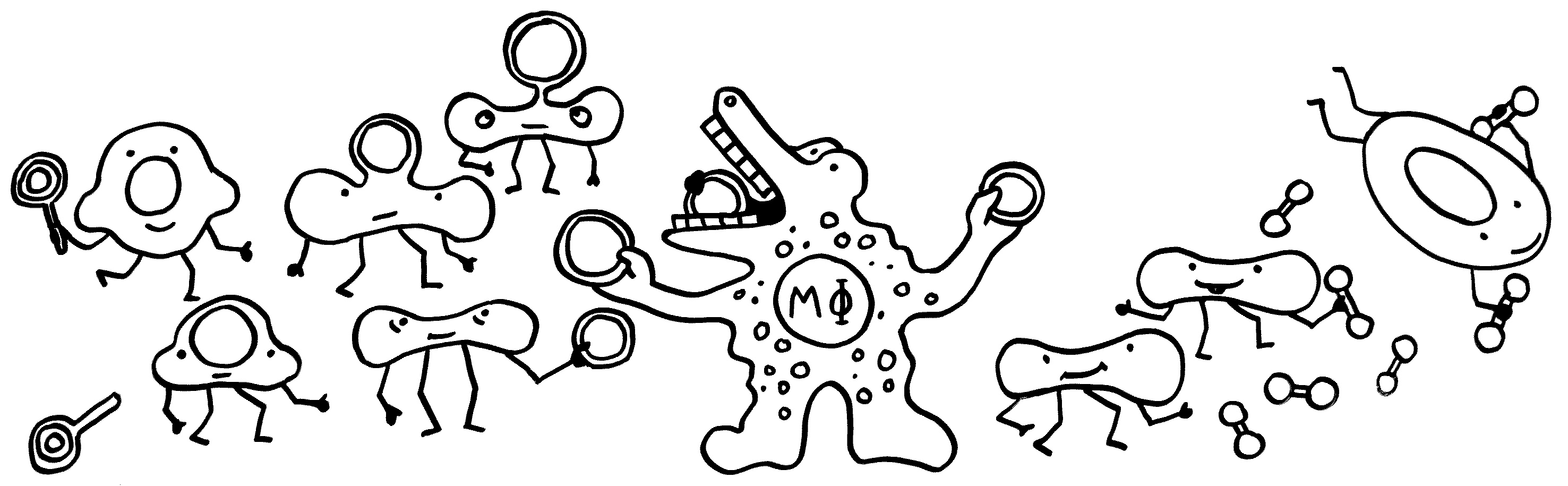
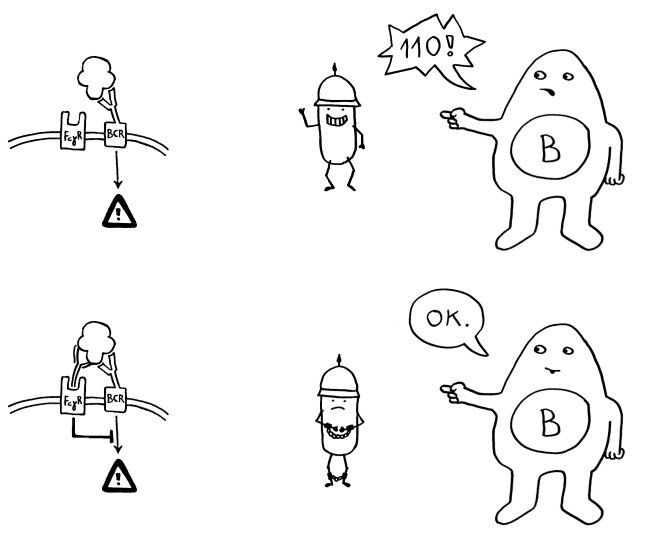
Ruth Williams (2014): Repurposed Retroviruses: Die T-Zell-unabhängige Aktivierung von B-Zellen durch Polysaccharid-Antigene geht bei Mäusen offenbar mit einer Transkription zahlreicher DNA-Sequenzen aus endogenen Retroviren (ERVs) einher, und die dabei entstehende RNA wird zum Teil vom Enzym Reverse Transkriptase in DNA-Stränge rückübersetzt. Das ist vermutlich keine funktionslose oder gar schädliche Nebenwirkung, sondern Teil des B-Zell-Aktivierungsmechanismus.
Kate Yandell (2015): Commensal Defense: Bacteroidetes in unserer Darmflora entgehen der Vernichtung durch antimikrobielle Peptide, mit denen unser Organismus Pathogene im Verdauungstrakt vernichtet, durch ein Enzym, das die Lipopolysaccharide (LPS) in ihrer Membran verändert. Diese im Resistenzgen IpxF codierte Phosphatase knipst negativ geladene Phosphatgruppen von den LPS ab, wodurch die positiv geladenen antimikrobiellen Peptide schlechter an unsere Symbionten binden als an die Pathogene. Weiterlesen